
Орг_Хим_Все лекции_презы
.pdf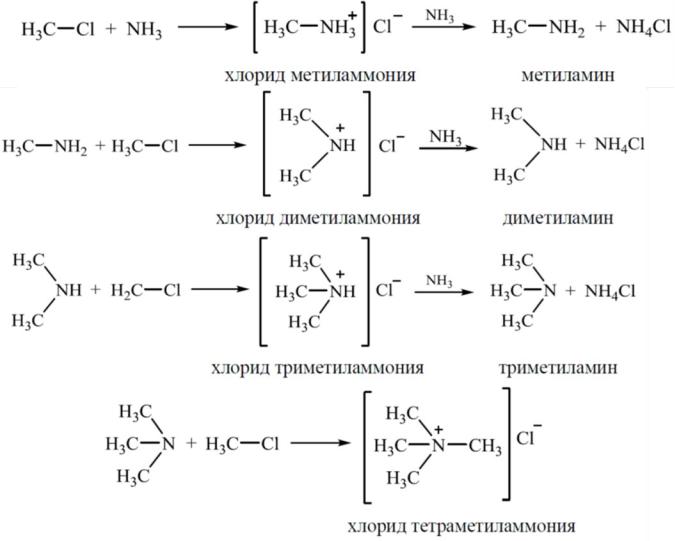
Способы получения алкиламинов
Алкиламины – это продукты замещения одного, двух или трех атомов водорода в аммиаке алкильными группами
1. Взаимодействие галогеналканов с аммиаком (реакция Гофмана).
При значительном избытке аммиака увеличивается выход первичного амина, в случае избытка галогеналкана в смеси преобладает соль четвертичного аммониевого основания. Образующуюся смесь первичных, вторичных и третичных аминов разделяют фракционной перегонкой.
Способы получения алкиламинов
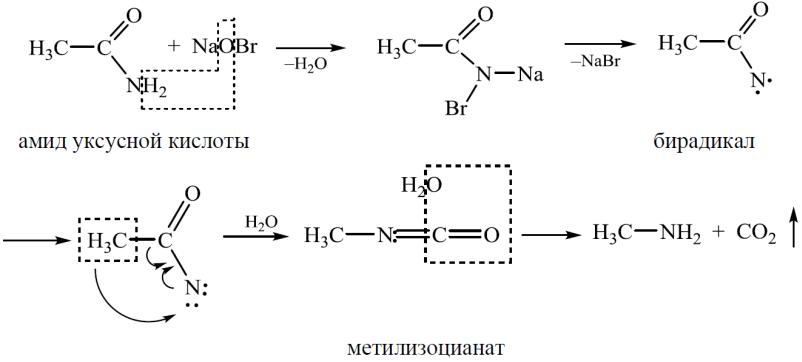
2. Расщепление незамещенных амидов карбоновых кислот натрия гипобромитом (перегруппировка Гофмана).
При обработке незамещенных амидов карбоновых кислот гипобромитом натрия (смесь брома и гидроксида натрия) образуются первичные амины, при этом углеродная цепь укорачивается на один атом:
Способы получения алкиламинов
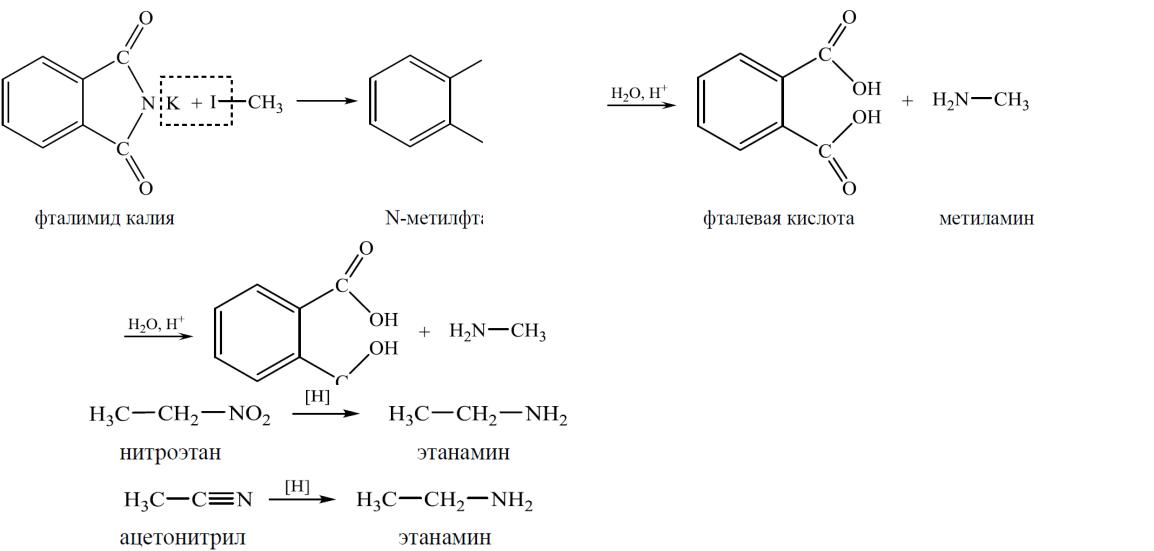
3.Синтез Габриэля
4.Восстановление нитроалканов и нитрилов
Восстановление проводят водородом в присутствии катализатора (Ni, Pd, Pt) или водородом в момент выделения
Физические свойства алкиламинов
В обычных условиях
•метиламин, диметиламин и триметиламин – бесцветные газы;
•алкиламины, содержащие 4…15 атомов углерода, – жидкости;
•высшие амины – твердые вещества.
•Низшие амины хорошо растворимы в воде, причем с увеличением молекулярной массы растворимость снижается. Высшие амины не растворимы в воде.
•Газообразные амины имеют запах аммиака, жидкие амины обладают резким неприятным запахом, напоминающим запах селедочного рассола. Твердые амины не имеют запаха.
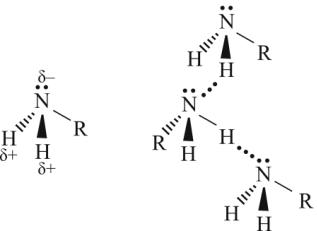
•Температуры кипения третичных аминов значительно ниже, чем первичных и вторичных с тем же числом атомов углерода. Это связано со способностью первичных и вторичных аминов образовывать, подобно спиртам, водородные связи. Амины образуют менее прочные ассоциаты, чем соответствующие спирты, поскольку электроотрицательность атома азота меньше, чем атома кислорода. Третичные амины не имеют атома водорода при атоме азота, поэтому они не способны к ассоциации.
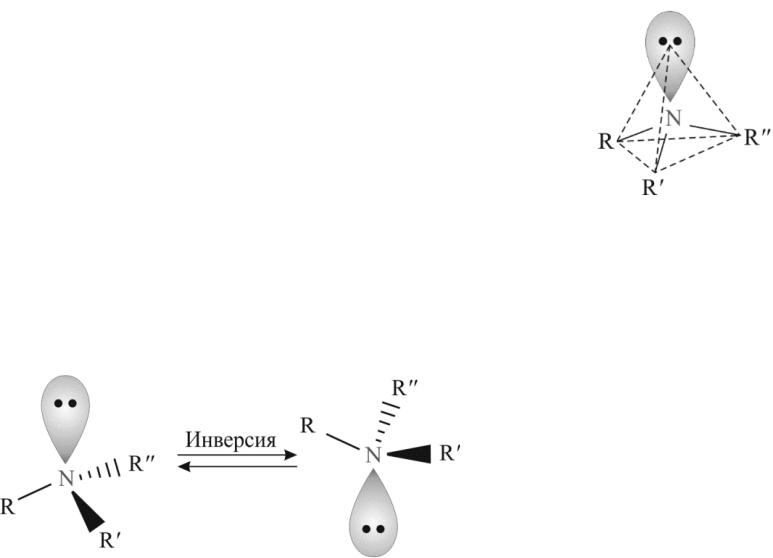
Пространственное строение алкиламинов
Пространственная модель молекулы алкиламина имеет форму четырехгранной пирамиды, в вершине которой находится атом азота. Валентные углы между связями равны 107…108°, т. е. близки к тетраэдрическому.
Исходя из этого, атом азота в аминах находится в sp3-гибридизации, а неподеленная пара электронов занимает sp3-гибридную орбиталь.
Такое строение предполагает существование оптической изомерии у соединений, имеющих три разных заместителя у атома азота (роль четвертого заместителя выполняет неподеленная пара электронов). Однако вследствие инверсии (т. е. быстрого взаимного пре-вращения одной тетраэдрической конфигурации в другую) разделить оптические изомеры не представляется возможным:
Химические свойства алкиламинов
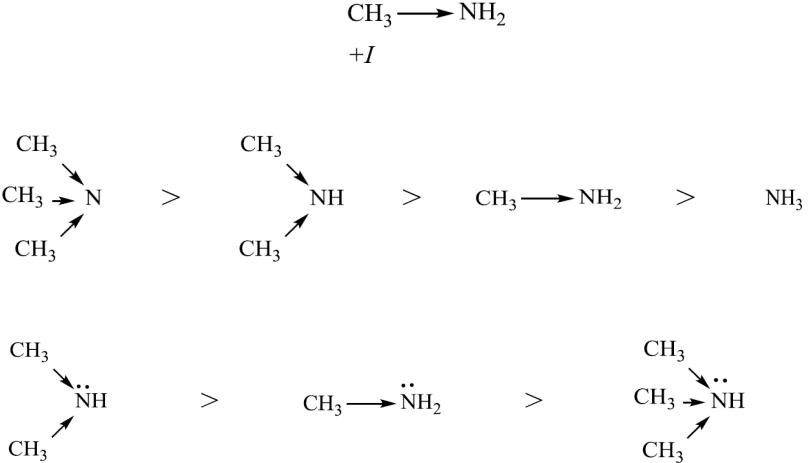
1. Основность
Являясь производными аммиака, алкиламины подобно аммиаку проявляют ярко выраженные основные свойства, которые обусловлены способностью атома азота с неподеленной парой электронов к присоединению протона с образованием иона замещенного аммония. При этом амины в 10 раз сильнее, чем аммиак
Вгазовой фазе и в неводных растворах третичные алкиламины, будут более сильными основаниями, чем вторичные, а вторичные – более сильными, чем первичные и аммиак
Вводных растворах наряду с электронными эффектами заместителей влияет и сольватационный эффект растворителя.
Химические свойства алкиламинов
1. Основность
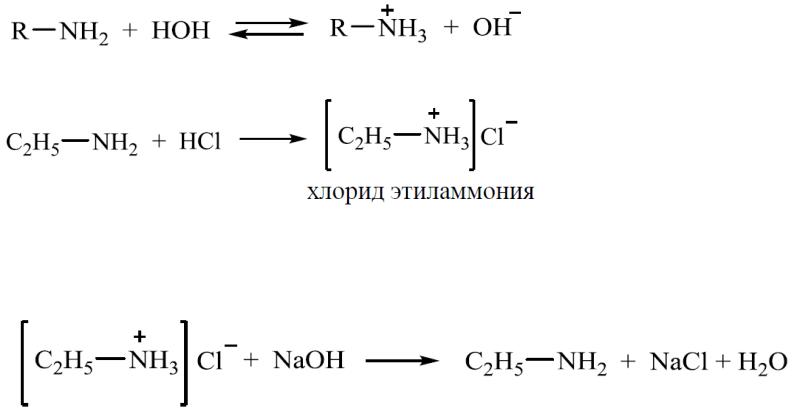
Водные растворы алкиламинов имеют щелочной характер
С кислотами алкиламины образуют соли алкиламмония
При действии на аммониевую соль сильного основания (гидроксида натрия) высвобождается исходный амин
Химические свойства алкиламинов
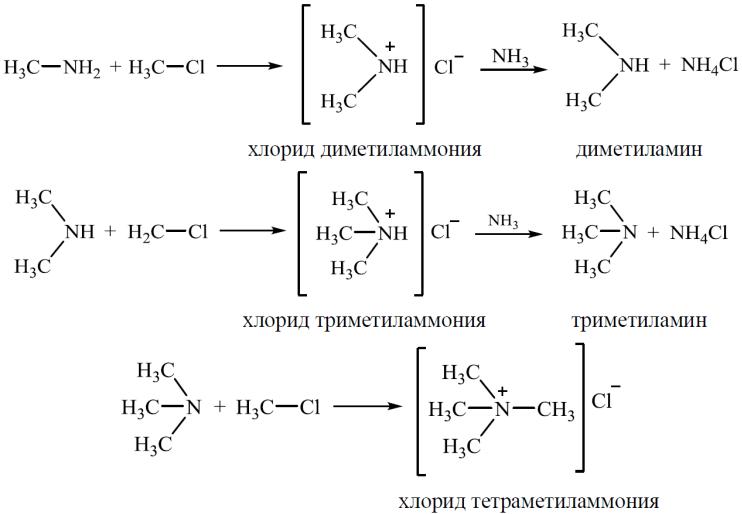
2. Взаимодействие с галогеналканами (реакция Гофмана)
В зависимости от природы галогеналкана и алкиламина реакция может протекать по механизму SN1 или SN2.
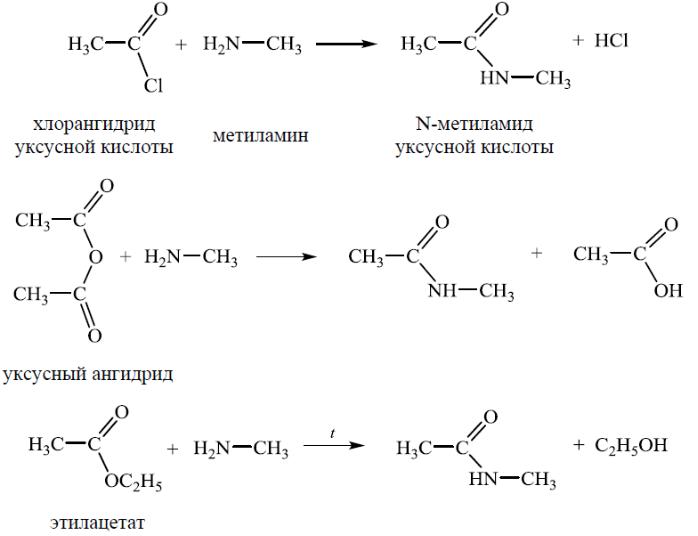
Химические свойства алкиламинов
3. Ацилирование
Третичные амины не содержат атома водорода при атоме азота и поэтому в реакцию ацилирования не вступают.
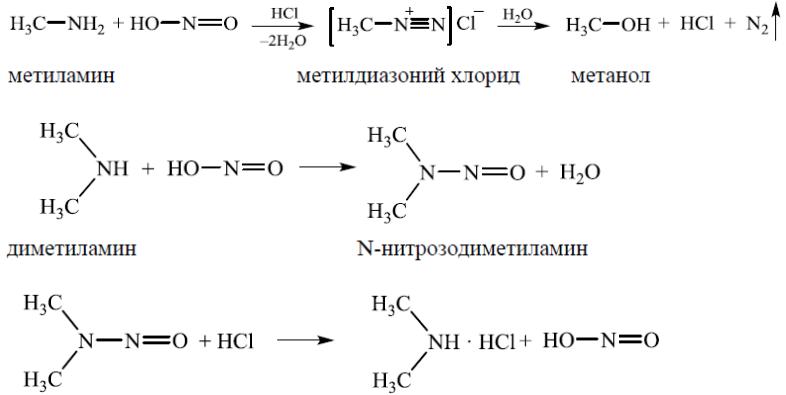
Химические свойства алкиламинов
4.Взаимодействие с азотистой кислотой
Вэту реакцию вступают первичные и вторичные алкиламины
Третичные алкиламины в обычных условиях с азотистой кислотой не реагируют
