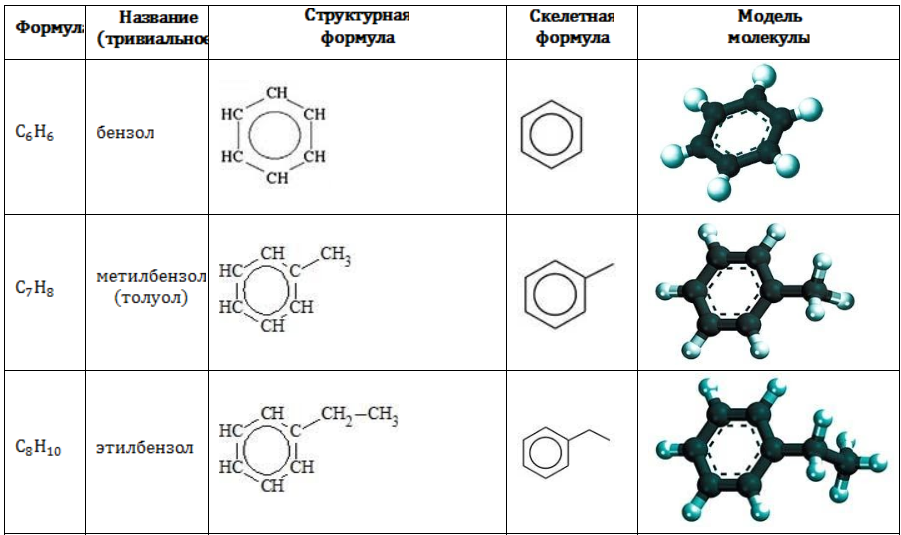
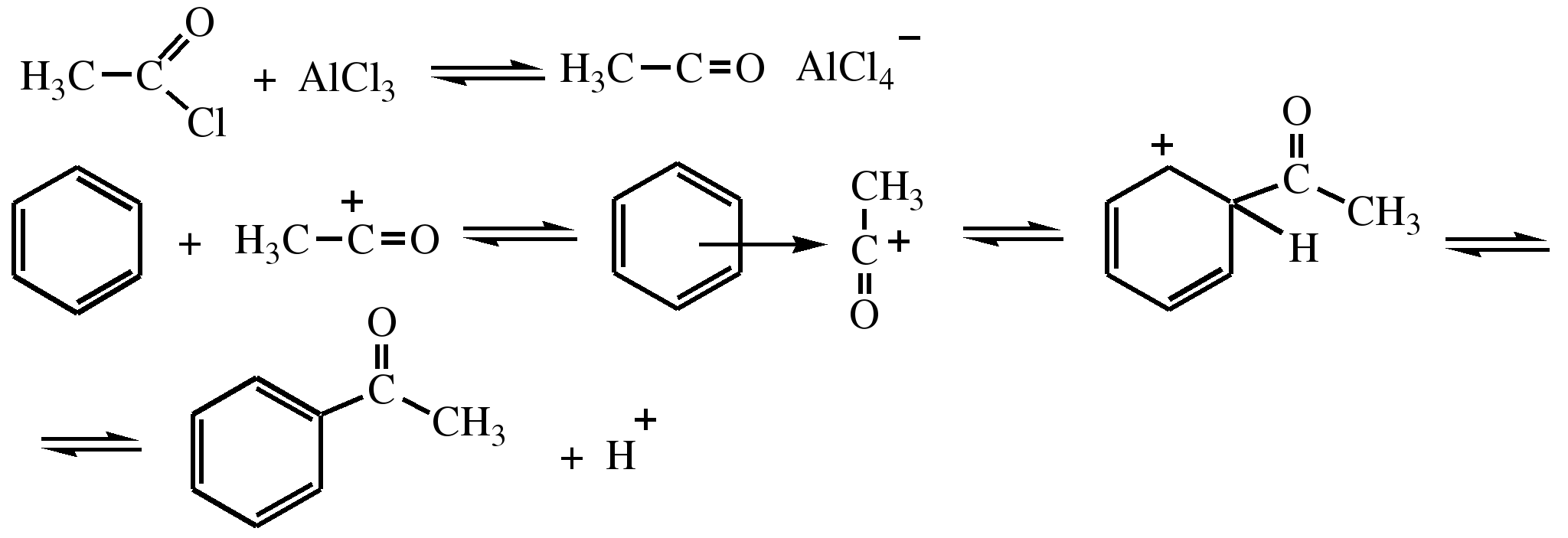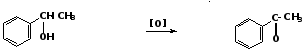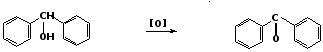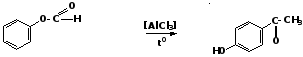49. Ароматические углеводороды. Получение и химические свойства.
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей. Общая формула: CnH2n-6 при n ≥ 6. |
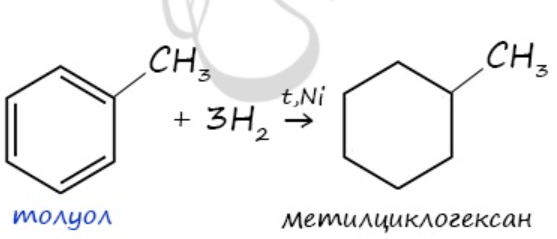
1. Реакции присоединения 1.1. Гидрирование t, p, (Ni, Pt ) При гидрировании бензола образуется циклогексан:
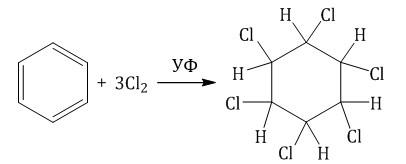
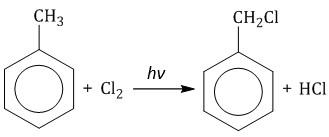
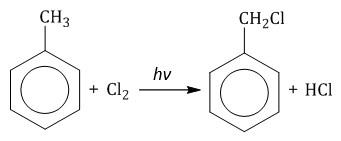
1.2. Хлорирование аренов по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения. При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
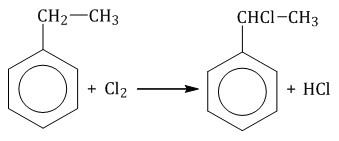
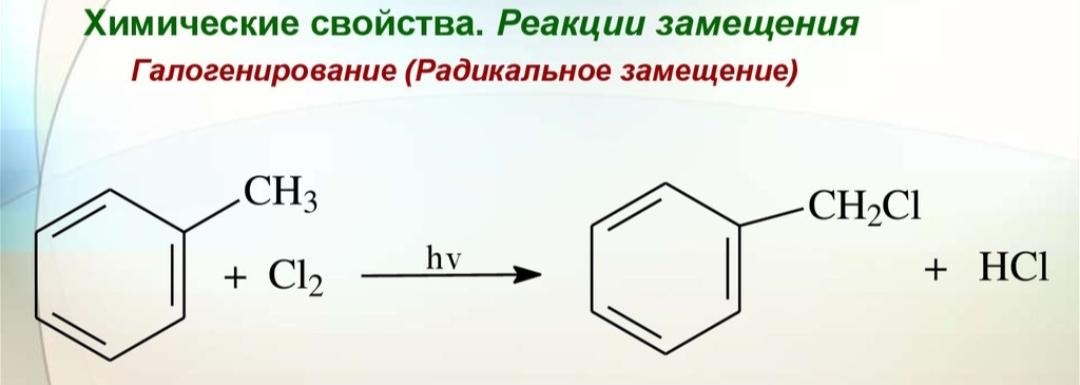
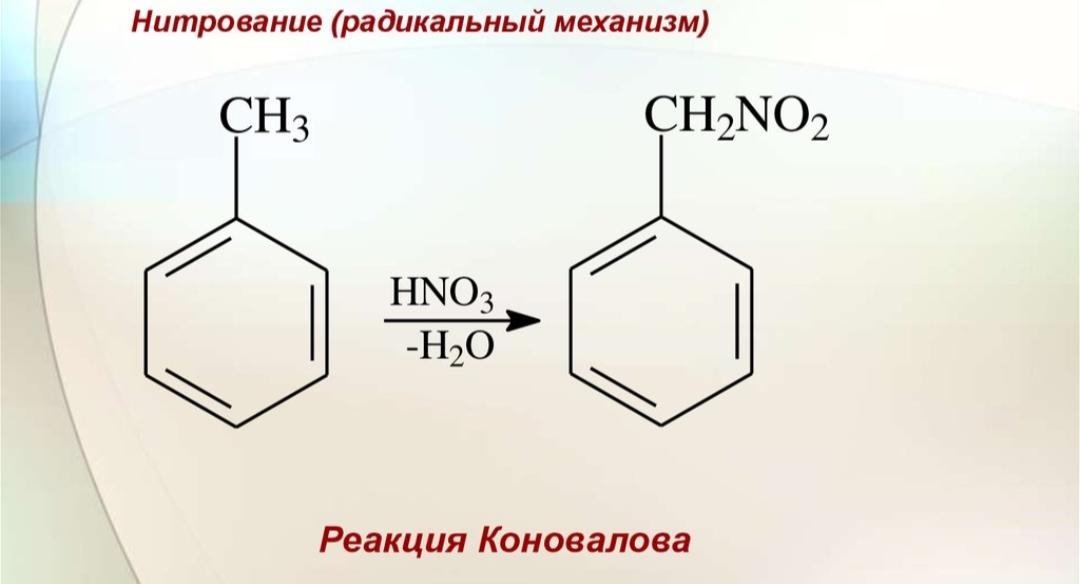
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
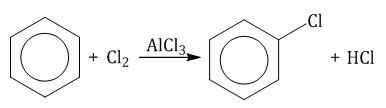
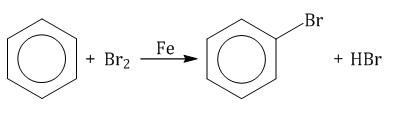
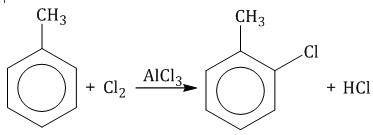
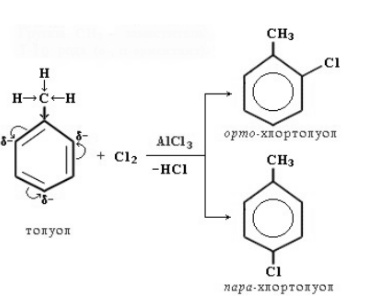
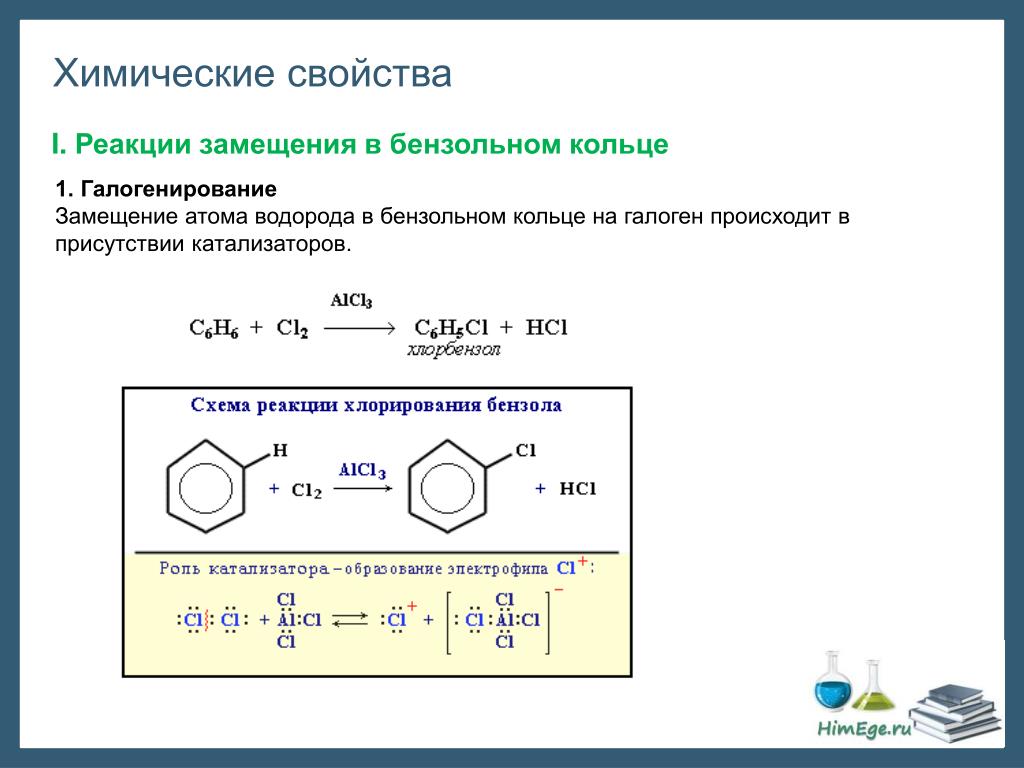
2. Реакции замещения 2.1. Галогенирование
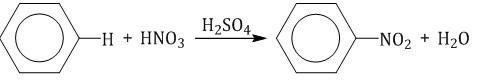
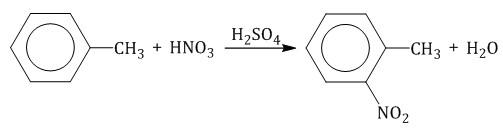
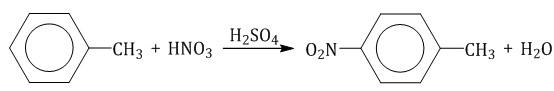
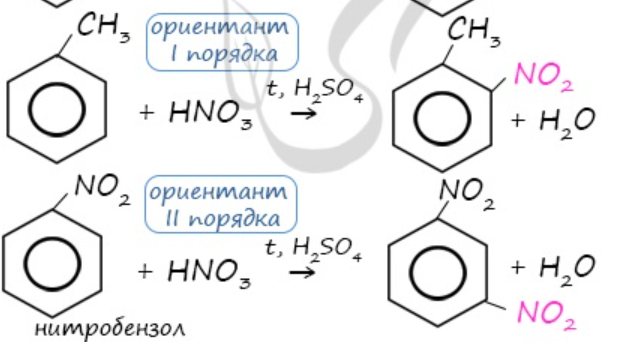
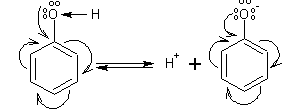
2.2. Нитрование
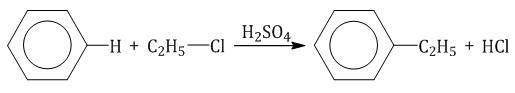
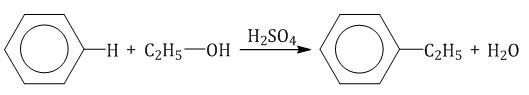
2.3. Алкилирование ароматических углеводородов
2.4. Сульфирование ароматических углеводородов
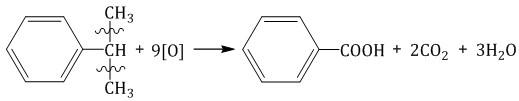
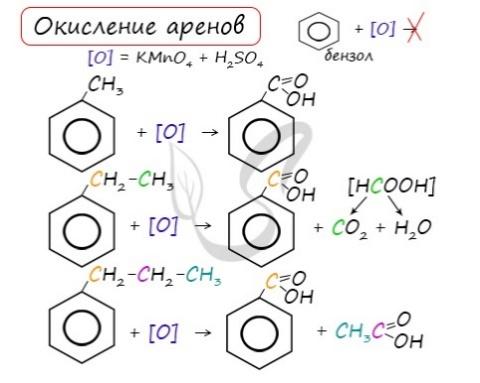
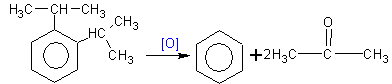
3. Окисление аренов 3.1. Полное окисление – горение 2C6H6 + 15O2 → 12CO2 + 6H2O + Q Уравнение сгорания аренов в общем виде: CnH2n–6 + (3n – 3)/2 O2 → nCO2 + (n – 3)H2O + Q 3.2. Окисление гомологов бензола Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании. При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом. Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты: Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия: Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
Получение аренов
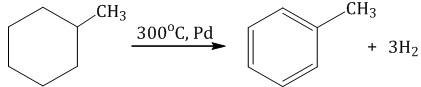
3. Дегидрирование циклоалканов
4. Декарбоксилирование солей бензойной кислоты Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
5. Алкилирование бензола и его гомологов
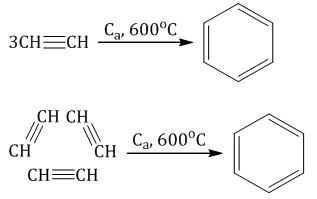
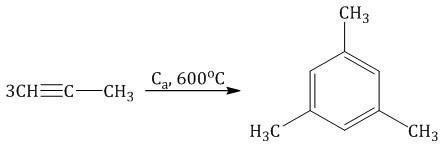
6. Тримеризация ацетилена При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
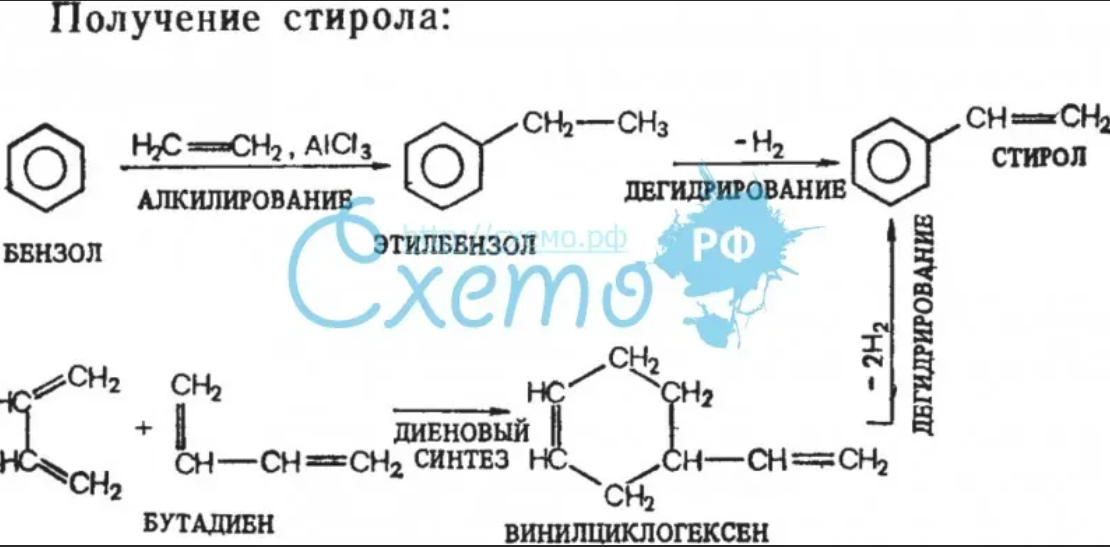
7. Получение стирола
|
50. Бензол. Строение и химические свойства.
присутствуют три двойные связи С=С, три одинарные связи С–C и шесть одинарных связей С–Н. Структурная формула бензола:
Каждый из шести атомов углерода в молекуле бензола находится в состоянии sp2-гибридизации.
Каждый атом углерода в молекуле бензола связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы равны 1200. в молекуле бензола одинаковой длины (0,140 нм), что соответствует промежуточному значению между одинарной и двойной (полуторная связь). |
|
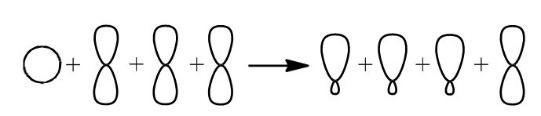
51. Строение ароматических углеводородов. Правило Хюккеля. Химические свойства.
Первую структурную формулу бензола предложил в 1865 г. немецкий химик Ф.А.Кекуле:
молекула
бензола устойчивый симметричный
шестичленный цикл из одинаковых
СН-групп, лежащих в одной плоскости и
связанных ароматической системой
связи.
|
|
52. Бензол и его ближайшие гомологи. Получение и химические свойства. Промышленное использование.
|
|
|
|
53. Влияние электронодонорных и электроноакцепторных заместителей на электрофильное замещение в ароматическом ряду.
|
|
54. Алкилирование и ацилирование ароматических углеводородов. Механизм реакций.
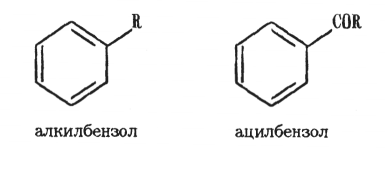
Строение. При алкилировании и ацилировании ароматических углеводородов получают соответственно их алкильные и ацильные производные:
Получение. Реакции алкилирования и ацилирования относятся к реакциям электрофильного замещения и называются реакциями Фри- деля—Крафтса. Алкилирование — введение алкильной группы в молекулу органического соединения (например, в бензольное кольцо). Реакцию алкилирования проводят при действии на вещество гало- геналкилов в присутствии катализатора — безводного AICI3. Роль катализатора заключается в образовании положительно заряженного карбкатиона, который электрофильно атакует бензольное кольцо:
Вместо галогеналкилов в качестве алкилирующих средств применяют также непредельные углеводороды и спирты. В этом случае в качестве катализатора используют минеральные кислоты. Роль последних состоит в превращении алкенов и спиртов в соответствующие карбкатионы:
Таким способом получают, например, этилбензол и изопропилбензол (кумол)
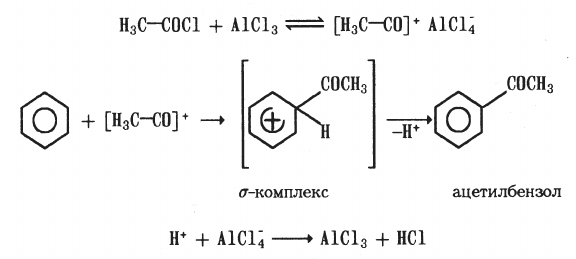
Ацилирование — введение в молекулу органического соединения ацильной группы. Для ацилирования бензола или его гомологов используют в качестве ацилирующих агентов ангидриды или галогенангидриды кислот и катализатор — безводный AICI3. Образующийся ион ацилия электрофильно взаимодействует с ароматическим углеводородом:
|
55. Стирол. Получение, применение в промышленности.
|
|
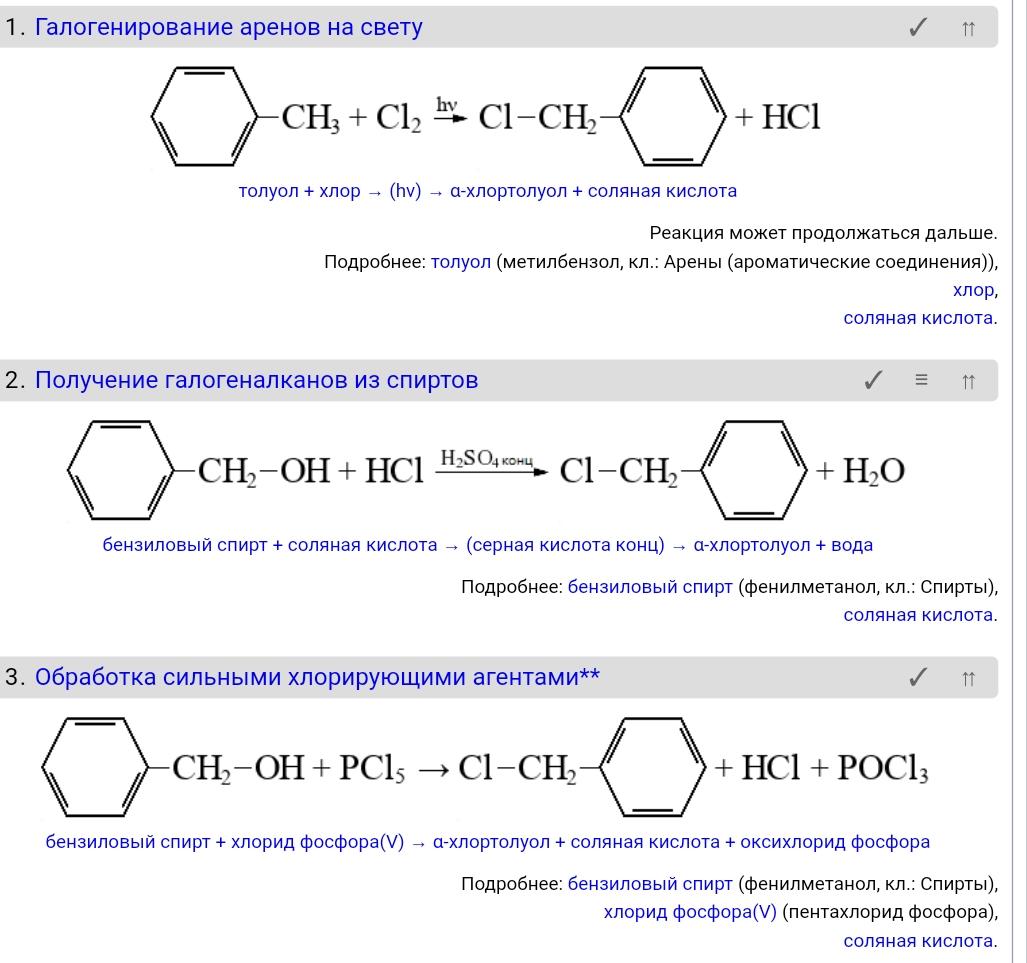
56. Галогенпроизводные бензола и его гомологов. Получение и химические свойства. Подвижность галогена.
Делятся на две группы: 1. Соединения, содержащие галоген в боковой цепи:
2. Соединения, содержащие галоген в ароматическом ядре:
|
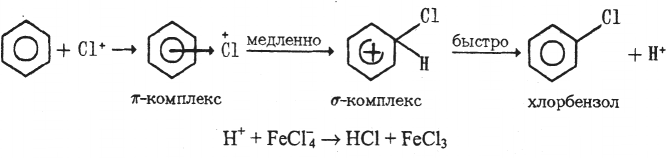
Способы получения ароматических галогенпроизводных С галогеном в ядре Галогенирование (электрофильное ароматическое замещение SE)
Иодпроизводные получить таким образом невозможно, так как реакция обратима.
Из солей диазония.
С галогеном в боковой цепи Прямое галогенирование Реакция протекает по радикальному механизму:
Хлорметилирование электрофильное замещение.
|
Если атом галогена находится у ненасыщенного углеродного атома или связан с атомом углерода бензольного ядра, подвижность галогена резко снижается:
В молекулах хлорбензола и винилхлорида наблюдается сопряжение между свободными электронами атома галогена и р - электронами двойной связи или бензольного кольца, что снижает подвижность галогенов.
|
|
57. Галогенирование гомологов бензола в ядро и в боковую цепь. Механизм реакций.
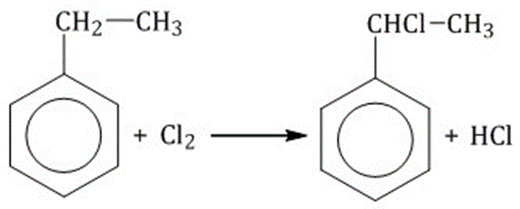
Галогенирование по α-атому углерода в боковой цепи Реакция идет при нагревании или облучении и всегда по α-углероду. При продолжении галогенирования второй атом галогена снова встанет в α-положение.
|
по механизму электрофильного замещения |
Если
реакцию проводить в присутствии
катализаторов (FeCl3, AICI3), то образуются
производные с галогеном в ароматическом
ядре. Роль катализатора заключается
в поляризации молекулы галогена с
образованием положительно заряженного
иона (галогенирующего агента), который
затем атакует бензольное ядро:
|
58. Реакции замещения галогенов в ароматическом кольце. Механизм, влияние других заместителей на подвижность галогена.
|
|
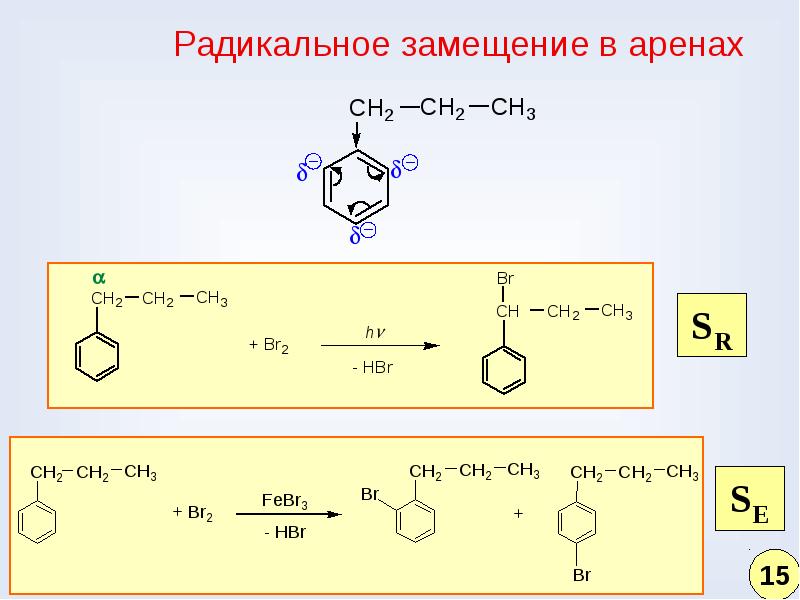
59. Реакции ароматических углеводородов, протекающие по радикальному механизму.
|
|
60. Галогенпроизводные ароматических углеводородов. Получение и свойства. Механизм нуклеофильного замещения галогена в кольце и боковой цепи.
61. Получение и химические свойства нитросоединеий ароматического ряда. Восстановление нитрогруппы и реакции замещения в кольце.
62. Механизм реакции нитрования бензола и его гомологов в ядро и боковую цепь. Нитрующие агенты.
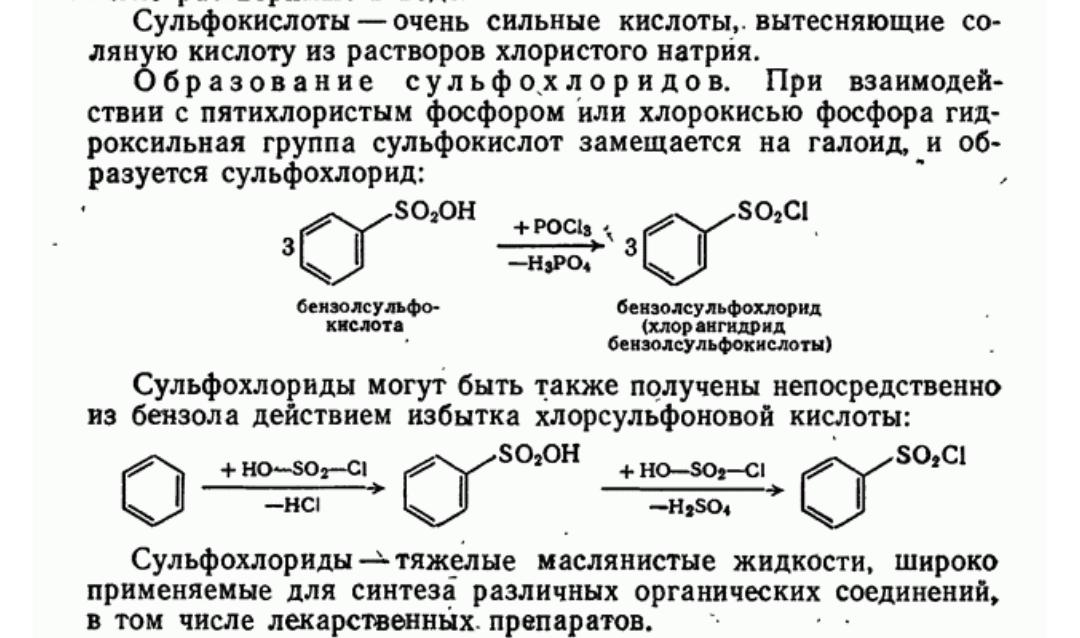
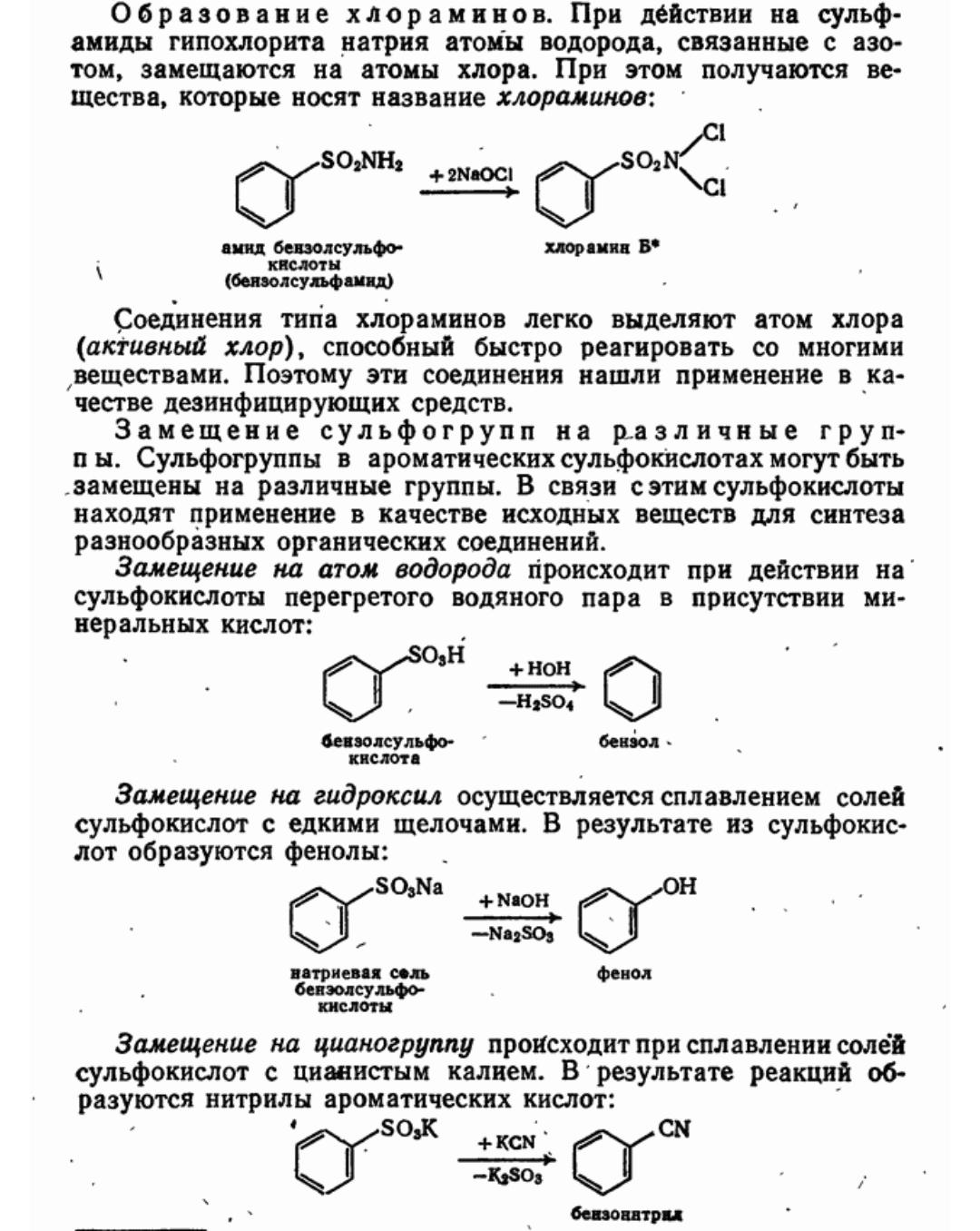
63. Ароматические сульфокислоты и их производные.

64. Получение, строение и химические свойства сульфокислот ароматического ряда.
|
|
|
|
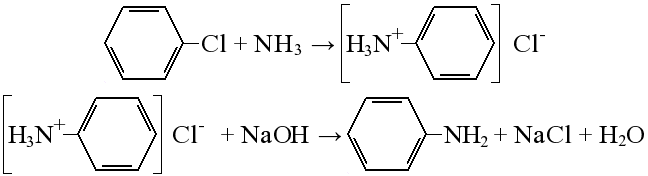
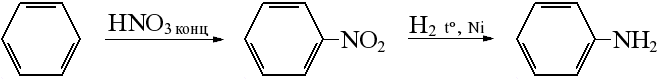
65. Ароматические амины. Получение, строение и химические свойства.
|
Основные свойства аминов - создание щелочной среды
Благодаря этому амины обладают основными свойствами и с кислотами образуют соли:
этиламин → бромид этиламмония Реакция возможна также с вторичными и третичными аминами:
диметиламин → гидросульфат диметиламмония
диметилэтиламин → хлорид диметилэтиламмония
N-алкилирование аминов
Алкилирование спиртами
Взамодействие с азотистой кислотой
|
Получение из спиртов: Спирты обрабатывают аммиаком при нагревании, образуются амины:
Получение из галогеналканов
хлорбензол → хлорид фениламмония → анилин
Гидрирование нитрилов :
Гидрирование нитросоединений
Алкилирование
других аминов
|
66. Ароматические амины. Получение, строение, химические свойства (реакции по азоту и в ароматическое ядро).
|
|
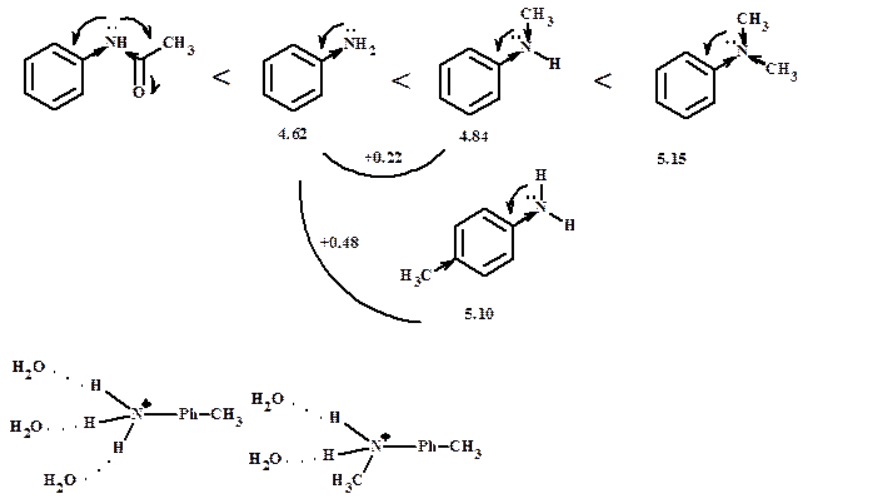
67. Зависимость между строением и основностью ароматических аминов.
|
|
68. Влияние заместителей в ядре и у атома азота на основность ароматических аминов.
А) Влияние заместителей в кольце
Доноры увеличивают основность, т.к.
-
повышают электронную плотность в
кольце, уменьшают сопряжение между
ароматической
системой и неподеленной парой
электронов,
увеличивается электронная плотность
на атоме азота, - увеличивается
устойчивость аммонийного катиона.
Акцепторы уменьшают основность, т.к. - уменьшают электронную плотность в бензольном кольце, увеличивают сопряжение между ароматической системой и неподеленной парой электронов, уменьшается электронная плотность на атоме азота, - уменьшается устойчивость аммонийного катиона.
- М-эффект сильнее передается в п-положение -I- эффект сильнее в о-положении, особенно для акцепторов (о-эффект заместителя) |
Б) Влияние заместителей при атоме азота на основность Аналогично алифатическому ряду - алкильные заместители увеличивают основность (+I); - при ацилировании основность резко снижается, т.к. неподеленная пара е- сопрягается и с ароматической системой, и π-связью карбоксильной группы; -алкилирование непосредственно по N дает меньшее увеличение основности, чем при введение алкильной группы по бензольному кольцу, т.к. изменяется геометрия аминогруппы, сопряжение усиливается, сольватация катиона меньше.
|
69.
Соли диазония. Получение, строение,
химические свойства. Роль солей меди в
реакциях с выделением азота.
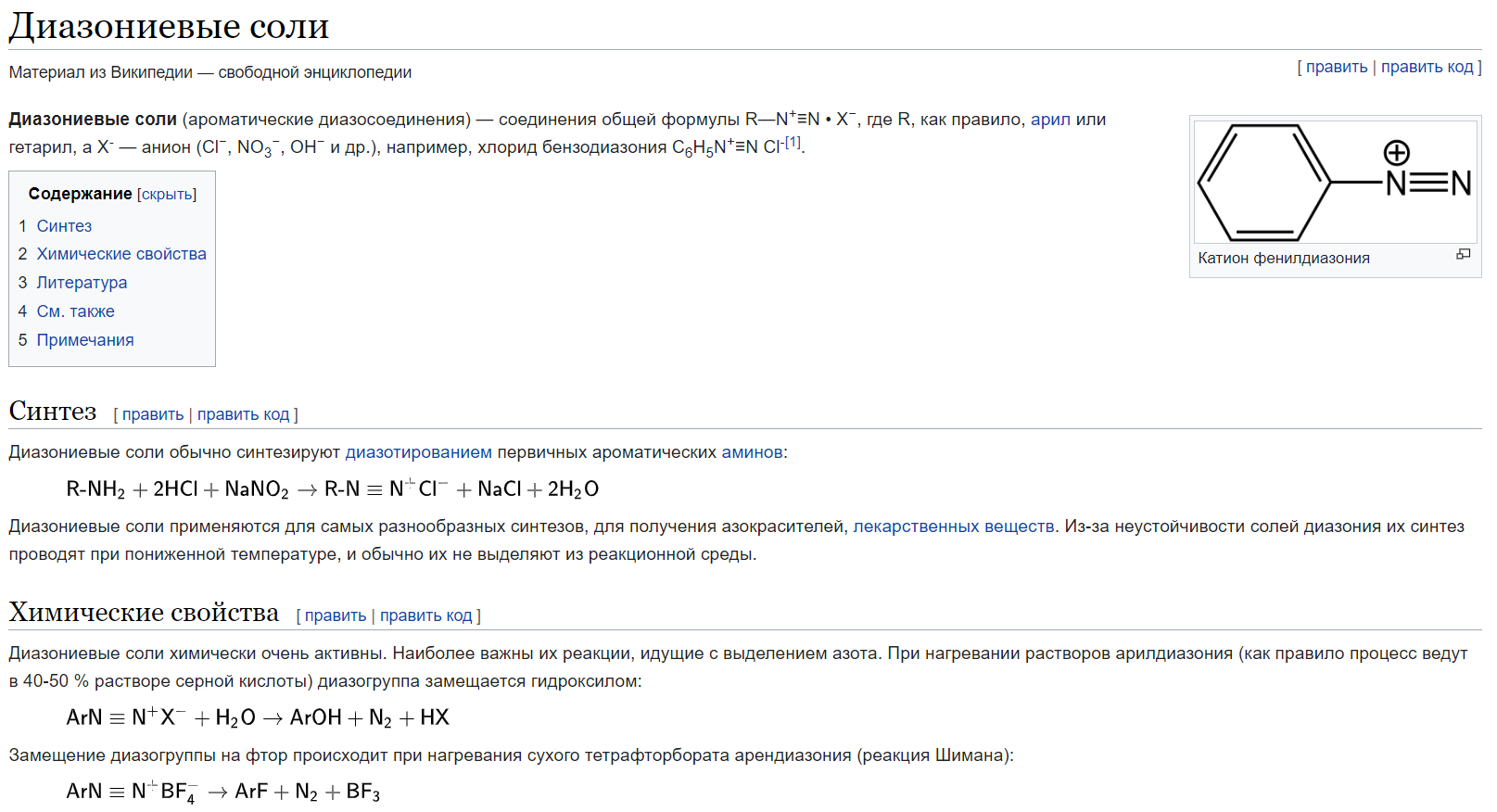

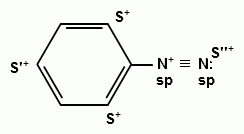
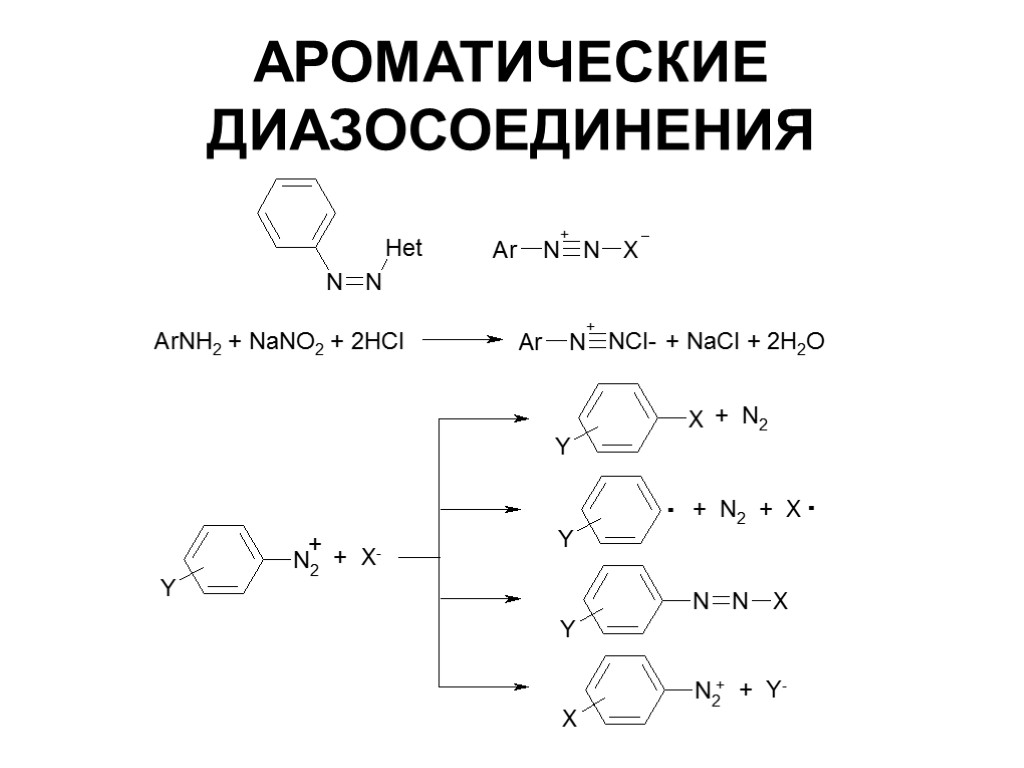
70. Ароматические диазосоединения. Получение, строение и химические свойства.
общую формулу ArN2X
Оба атома азота находятся в состоянии sp-гибридизации, при этом один из них имеет положительный заряд. |
с ковалентной ___________________________ В результате такого строения диазосоединения с ковалентной связью могут существовать в виде цис-(син-) и транс-(анти-) изомеров. Более стабильной является транс-форма.
|
|
с аминами реагируют |
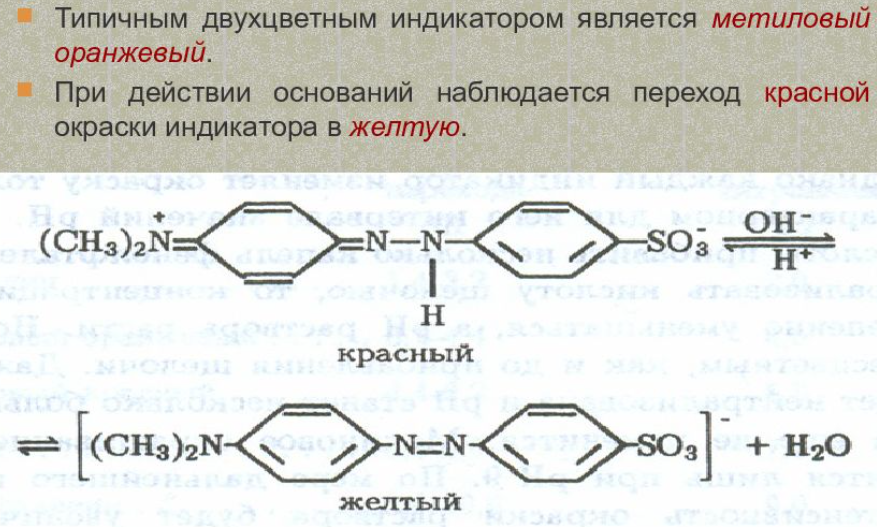
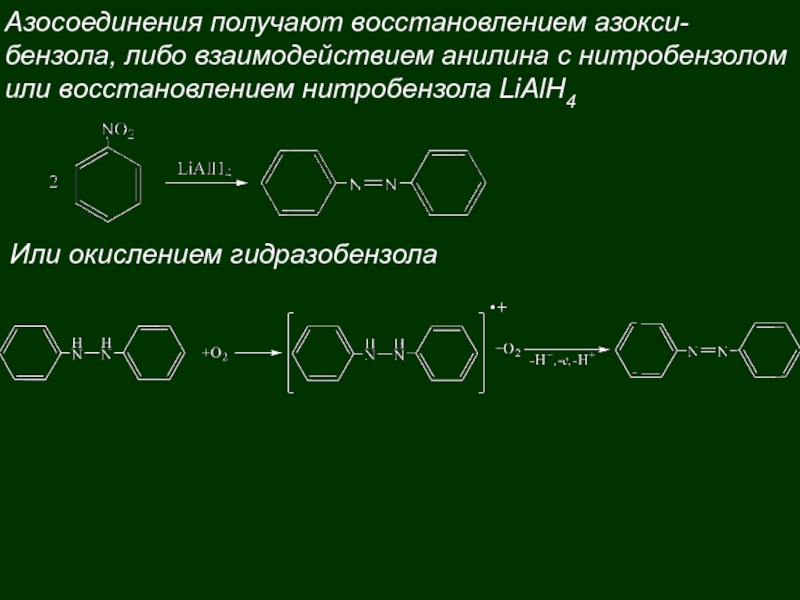
71. Азосоединеия. Азокрасители. Получение. Понятие о цветности. Индикаторные свойства метилоранжа.
|
|
|
|
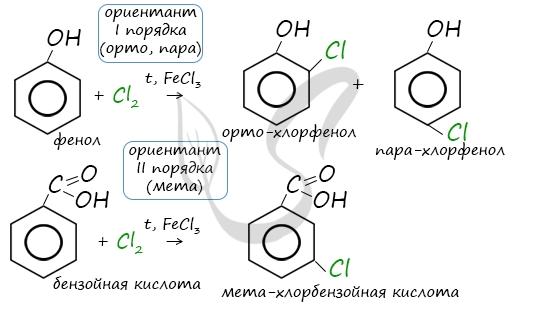
72. Одноатомные фенолы и нафтолы. Получение и химические свойства.
ПОЛУЧЕНИЕ
_________________________________________________
_____________________________________________________
|
Химические свойства определяются ОН-группой и бензольным кольцом. Фенолы обладают кислотными свойствами.
С6H5OH + NaOH → С6H5ONa + H2O С6H5OH + CO2 + H2O––>C6H5OH+NaHCO3
|
Нафтолы - это гидроксильные производные нафталина. Различают α-нафтол и β-нафтол в зависимости от положения ОН-групп в кольце. α-нафтол и β-нафтол – кристаллические вещества. β-нафтол имеет более высокую температуру плавления, чем α-нафтол. Оба нафтола трудно р-римы в H2O. Дают окраску с FeCl3, растворяются в растворах гидроксида натрия и калия. |
|
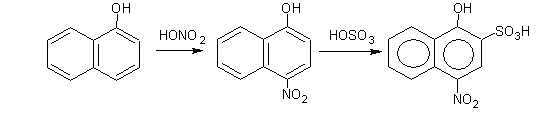
Основной тип реакций, характерный для нафтолов, реакции замещения, которые идут в соответствии с ранее рассмотренными правилами ориентации. а) галогенирование (взаимодействие с Сl2) б) нитрование ( взаимодействие с HONO2) в) сульфирование (взаимодействие с HOSO3H)
α-нафтол 4-нитронафтол 4-нитро-1-окси-2-нафтолинсульфокислота Нитрование, сульфирование, хлорирование идут в п-положение по отношению к ОН-группе в том же кольце, в котором находится ОН-группа. Следующий заместитель занимает о-положение. У β-нафтола замещение протекает в α-положении:
β-нафтол 1-бромнафтол 1,6-дибром-2- нафтол С хлоридом железа (III) в спирто-водном растворе α-нафтол даёт фиолетовое окрашивание, β-нафтол – жёлтое. Важным является получение эфиров нафтолов. Эфиры нафтола имеют приятный запах. Используются, например, метиловый эфир β-нафтола, в парфюмерии. На основе нафтолов синтезируют красители для тканей. |
|
73. Одноатомные фенолы и нафтолы. Получение, строение и химические свойства.

У нафтолов возможна изомерия двух типов:
изомерия положения гидроксильной группы в нафтеновом кольце: 1-нафтол (α-нафтол) или 2-нафтол (β-нафтол);
изомерия боковой цепи, то есть строения углеводородных радикалов и их числа.

74. Кислотно-основные свойства фенолов. Зависимость кислотных свойств от строения фенолов.
|
|
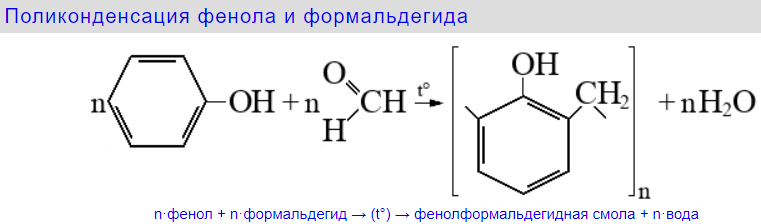
75. Использование фенолов для получения фенолформальдегидных смол, нейлона, капрона. Схема реакций этих процессов.
|
Нейлон готовят из довольно простых органических веществ – адиптиновой кислоты HOOC – (CH2)4 – COOH и гексаметилендиамина H2N – (CH2)6 – NH2, которые в свою очередь, получают из фенола |
|
|
76.
Многоатомные фенолы. Особенности (в
сравнении с одноатомными фенолами)
методов получения и химических свойств.
Пирокатехин может быть получен гидролизом о-дихлорбензола (водный раствор NaOH, 2000С, катализатор – соли меди)
или с использованием реакции щелочного плава из динатриевой соли о-бензолдисульфокислоты
Аналогично изомеризуется и п-бензолдисульфокислота. Движущей силой указанных превращений является, по-видимому, накопление при высоких температурах наиболее устойчивого из двухатомных фенолов – резорцина. Источником пирокатехина могут послужить и вещества природного происхождения. В некоторых растениях содержится протокатехиновая кислота, декарбоксилирование которой приводит к пирокатехину
Известен метод получения пирокатехина из салицилового альдегида. При окислении альдегида перекисью водорода в щелочном растворе происходит замещение альдегидной группы на гидроксил
Резорцин получается при щелочном плаве м-бензолдисульфокислоты
Гидрохинон
Пирогаллол.
Флюроглюцин
Гексаоксибензол.
|
Кислотность. У двухатомных фенолов кислотные свойства выражены сильнее, поэтому они способны образовать соли не только с щелочными металлами
Реакции по бензольному кольцу. В реакции электрофильного замещения двухатомные фенолы вступают много легче, чем фенол. В кольцо двухатомных фенолов удается ввести два и даже три новых заместителя даже в мягких условиях. При электрофильном замещении с участием резорцина гидроксилы действуют согласованно
Окисление. Двухатомные фенолы с гидроксилами в о- и п-положениях легко окисляются и поэтому являются сильными восстановителями. Продуктами окисления пирокатехина и гидрохинона являются соответствующие хиноны
Резорцин также способен окисляться, однако по структурным соображениям не может образовать хинон. Особенности многоатомных фенолов. Как уже отмечалось, почти каждый из многоатомных фенолов, участвуя в химических реакциях, проявляет особенности. Так, резорцин – единственный из фенолов, способный восстанавливаться водородом в момент выделения. Установлено, что восстанавливается при этом енольная форма резорцина
Точно также гидрохинон – единственный из фенолов, участвующий в реакции Дильса-Альдера как диен (Куксон, 1955 г.)
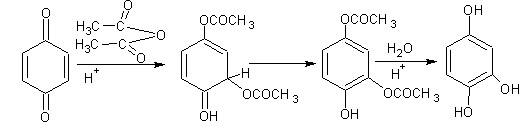
Не менее своеобразно окисляется шестиатомный фенол. При окислении кислородом воздуха он вначале превращается в тетраоксихинон. В дальнейшем хинон образует диоксихинон - родизоновую кислоту. Продуктом исчерпывающего окисления последней азотной кислотой является трихиноил (гексакетоциклогексан)
Хиноны Хиноны относятся к сопряженным циклическим дикетонам. У них с фенолами тесные взаимоотношения: фенолы и хиноны легко превращаются друг в друга. Простейший и наиболее распространенный хинон был получен Воскресенским (1838 г.) окислением хинной кислоты (1,3,4,5-тетраоксигексагидробензойная кислота) двуокисью марганца в серной кислоте
Свое название хинон получил от названия хинной кислоты. Хиноны подразделяются на 1,2- и 1,4-хиноны или о- и п-хиноны. Как уже отмечалось, 1,3-хиноны не могут существовать по структурным соображениям. Интересно, хиноны различимы по цвету кристаллов: п-хиноны в большинстве случаев бывают желтыми, а о-хиноны – оранжевыми или красными. Основные методы получения хинонов уже рассматривались – это окисление двухатомных фенолов и окисление анилина хромовой кислотой. Хиноны обладают высокой реакционной способностью. Направления их превращений предсказуемы: они реагируют как кетоны и одновременно по карбонильной группе и двойным связям. Для них характерны реакции 1,4- и 1,6-присоединения
Хинон как кетон вступает в реакцию с гидроксиламином с образованием моно- и диоксима
Хиноны вступают в многочисленные реакции присоединения. Присоединение брома происходит по 3,4-положению п-хинона. Образующийся при этом дибромид легко отщепляет молекулу бромистого водорода и дает замещенный хинон
Аналогично протекает присоединение диенов. В реакции Дильса-Альдера хиноны выступают как диенофилы
Однако хиноны и сами могут реагировать по 1,3-положению подобно диенам с сопряженными двойными связями. Примером такой реакции является присоединение к хинонам галогенводородных кислот
Аналогично присоединяется к хинону и уксусный ангидрид. Примером реакции 1,6-присоединения является присоединение водорода с образованием двухатомных фенолов
|
77. Способы получения и химические свойства ароматических альдегидов.
Ароматические альдегиды можно получать следующими способами: 1. Формилирование ароматических соединений (синтез Гаттермана-Коха) Действие на ароматические углеводороды смесью монооксида углерода с хлористым водородом в присутствии катализаторов (AlCl3, Cu2Cl2) приводит к образованию ароматических альдегидов:
Механизм
реакции:
3. Гидролиз геминальных дигалогенопроизводных ароматического ряда Бензальдегид можно получить превращением толуола в хлористый бензилиден с его последующим гидролизом. Гидролиз проводят в присутствии гидроксида кальция и железного катализатора при температуре 95-1000С:
Бензилиден 4. Окисление ароматических углеводородов Получение ароматических альдегидов, особенно бензальдегида, окислением ароматических углеводородов кислородом воздуха является промышленным способом:
5. Окисление ароматических спиртов
бензиловый спирт бензальдегид 6. Восстановление хлорангидридов ароматических карбоновых кислот Для восстановления хлорангидридов применяют водород в присутствии палладиевого катализатора:
бензоилхлорид бензальдегид
|
78. Химические свойства ароматических альдегидов.
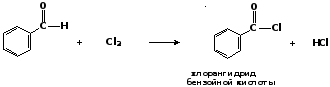
Бензальдегид при действии хлора реагирует иначе – образуется хлорангидрид бензойной кислоты:
4. Реакции окисления Ароматические альдегиды и кетоны легче вступают в реакции окисления, чем алифатические. 4.1. Окисление альдегидов 1) Автоокисление Одна из особенностей ароматических альдегидов – их способность самопроизвольно окисляться кислородом воздуха до кислот (автоокисление). Этот процесс ускоряется на свету и в присутствии катализаторов – солей тяжелых металлов.
Если с бензольным кольцом ароматического альдегида связан электроно-донорный заместитель, то альдегидную группу можно окислить до карбоксильной группы аммиачным раствором гидроксида серебра:
4.2. Окисление кетонов Жирно-ароматические кетоны окисляются иначе и легче, чем алифатические. При окислении оксидом селена (SeO2) жирно-ароматические кетоны дают альдегидокетоны или α-дикетоны:
При действии более сильных окислителей образуются ароматические кислоты:
5. Реакции восстановления 5.1. Восстановление альдегидов Ароматические альдегиды могут быть легко восстановлены в соответствующие спирты и углеводороды:
Для восстановления альдегидов, содержащих в кольце заместители, склонные к реакциям восстановления, обычно подбирают восстановитель, обладающий высокой селективностью, например NaBH4:
м-нитробензальдегид 5.2. Восстановление кетонов Восстановление ароматических кетонов в различных условиях приводит к образованию разных продуктов. 1) Каталитическое восстановление жирно-ароматических кетонов Каталитическое восстановление кетонов, в которых функциональная группа непосредственно связана с бензольным кольцом, приводит к образованию ароматических спиртов, а затем углеводородов:
ацетофенон α-фенилэтиловый спирт этилбензол 2) Восстановление чисто ароматических кетонов При обработке чисто ароматических кетонов щелочными металлами в апротонных растворителях образуются пинаконы, которые способны при действии кислот перегруппировываться в пинаколины:
Необходимо отметить, что чисто ароматические кетоны, особенно содержащие электронодонорные группы, не всегда легко восстанавливаются до соответствующих одноатомных спиртов. Обычно эта реакция протекает при восстановлении дибораном в момент его образования: 3 NaBH4 + 4 BF3 → 3 NaBF4 + 2 [B2H6]
Ароматические альдегиды в присутствии 50%-ного водного и спиртового раствора КОН или NaOH образуют соответствующие спирт и соль кислоты:
бензальдегид бензиловый спирт натриевая соль бензойной кисдлты Аналогичную реакцию дают неенолизирующиеся альдегиды алифатического ряда, т.е. не имеющие подвижных атомов водорода в α-положении (например, формальдегид H-CHO и альдегиды R3C-CHO). 2. Смешанная реакция Канниццаро При нагревании ароматического альдегида с избытком формальдегида в присутствии концентрированного раствора NaOH ароматический альдегид полностью восстанавливается в соответствующий спирт, в то время как формальдегид окисляется в муравьиную кислоту:
2. Реакции электрофильного замещения Карбонильная группа является электроноакцепторным заместителем, дезактивирует ароматическое кольцо в реакциях электрофильного замещения и направляет электрофильный агент в м-положение. 1. Реакции нитрования Нитрование бензальдегида осуществляется смесью безводного нитрата калия и концентрированной серной кислоты при температуре 00С:
Нитрование ацетофенона легко осуществляется нитрующей смесью при температуре 00С:
м-нитроацетофенон 2. Реакции галогенирования Ароматические альдегиды и кетоны при галогенировании в присутствии апротонных кислот Льюиса дают обычно смесь продуктов мета- и орто-замещения. Но можно проводить реакцию таким образом, чтобы замещение проходило только по мета-положению. Для этого реакцию проводят с избытком катализатора AlCl3 и галогенированию подвергается комплекс карбонильного соединения с хлоридом алюминия:
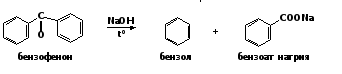
м-бромацетофенон 3. Специфические реакции ароматических кетонов 1. Нагревание с гидроксидом натрия При нагревании с твердой щелочью бензофенон расщепляется с образованием бензола и бензоата натрия:
2. Расщепление амидом натрия Чисто ароматические кетоны расщепляются амидом натрия с образованием амидов кислот:
3. Образование металлкетилов При обработке чисто ароматических кетонов натрием или калием в инертном растворителе образуются окрашенные производные с парамагнитными свойствами, называемые металлкетилами:
|
79. Реакции конденсации ароматических альдегидов. Механизм реакции Перкина и Кляйзена.
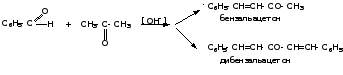
2. Реакции конденсации 2.1. Реакции конденсации ароматических альдегидов 1) Конденсация Клайзена-Шмидта Ароматические альдегиды легко вступают в реакции конденсации с алифатическими альдегидами и кетонами, жирно-ароматическими кетонами и эфирами карбоновых кислот алифатического ряда в присутствии водных растворов щелочей с образованием α,β-ненасыщенных карбонильных соединений. В этих реакциях, протекающих по типу альдольно-кротоновой конденсации, ароматические альдегиды ведут себя как карбонильные компоненты: - реакция с алифатическими альдегидами:
- реакция с алифатическими кетонами:
- реакция с жирно-ароматическими кетонами:
- реакция с эфирами карбоновых кислот алифатического ряда
2) Конденсация Перкина (конденсация с ангидридами карбоновых кислот) Характерной реакцией ароматических альдегидов является их конденсация с ангидридами карбоновых кислот в присутствии ацетатов или карбонатов щелочных металлов. В этом случае ароматические альдегиды выступают как активные карбонильные компоненты, а ангидриды играют роль метиленовой компоненты. Продуктами конденсации Перкина являются коричные кислоты:
3) Бензоиновая конденсация В условиях цианогидринного синтеза ароматические альдегиды в отличие от альдегидов алифатического ряда подвергаются бензоиновой конденсации (Н.Н.Зинин). Если обработка алифатических альдегидов водно-спиртовыми растворами цианидов щелочных металлов приводит к образованию нитрилов α-гидроксикарбоновых кислот:
4) Конденсация альдегидов с фенолами Большое значение в синтезе красителей трифенилметанового ряда имеют реакции бензальдегида с фенолами за счет подвижных атомов водорода в пара-положении фенольного ядра:
2.2. Реакции конденсации ароматических кетонов 1) Конденсация Клайзена-Шмидта Жирно-ароматические кетоны способны к различным реакциям конденсации за счет α-водородных атомов по отношению к карбонильное группе:
Реакция конденсации с участием двух молекул ацетофенона протекает в более жестких условиях: при температуре 4500С и с участием катализатора:
|
80. Ароматические кетоны. Получение и химические свойства.
2. Получение ароматических кетонов 1. Ацилирование по Фриделю-Крафтсу Ароматические кетоны обычно получают действием хлорангидридов или ангидридов карбоновых кислот на ароматические углеводороды в присутствии катализатора AlCl3:
ацетилхлорид ацетофенон
Механизм реакции
2. Окисление вторичных ароматических спиртов
метилфенилметанол ацетофенон
дифенилметанол бензофенон 3. Перегруппировка Фриса Ароматические кетоны могут быть получены перегруппировкой сложных эфиров фенола:
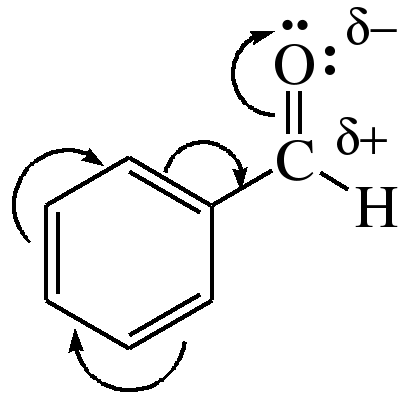
Физические свойства и строение Ароматические альдегиды – нерастворимые в воде жидкости с запахом горького миндаля. Чем дальше от ароматического ядра расположена альдегидная группа, тем более резким становится запах. Ароматические кетоны – жидкости или твердые вещества, нерастворимые в воде. Многие кетоны имеют приятный цветочный запах (например, ацетофенон имеет запах черемухи). Строение ароматических карбонильных соединения Карбонильная группа, как и все заместители П рода, влияет на распределение электронной плотности бензольного кольца за счет –I и –M-эффектов (π,π-сопряжение), которые действуют в одном направлении и приводят к понижению электронной плотности в кольце, особенно в орто- и пара-положениях бензольного кольца:
Поэтому электрофильный реагент вступает преимущественно в мета-положение ароматического кольца, где дефицит электронной плотности наименьшей. При этом карбонильная группа оказывает на связанное с ней бензольное кольцо значительно меньшее влияние, чем нитро- и карбоксильная группа. Поэтому галогенирование, нитрование и сульфирование ароматических альдегидов и кетонов проводят в более мягких условиях, чем нитробензола и бензойной кислоты. Вследствие наличия π,π-сопряжения бензольного кольца и карбонильной группы эффективный положительный заряд (δ+) на углеродном атоме карбонильной группы понижен, особенно в случае диарилкетонов. Поэтому реакционная способность ароматических карбонильных соединений в реакциях с нуклеофильными реагентами понижена по сравнению с алифатическими. 2) Восстановление чисто ароматических кетонов При обработке чисто ароматических кетонов щелочными металлами в апротонных растворителях образуются пинаконы, которые способны при действии кислот перегруппировываться в пинаколины:
Необходимо отметить, что чисто ароматические кетоны, особенно содержащие электронодонорные группы, не всегда легко восстанавливаются до соответствующих одноатомных спиртов. Обычно эта реакция протекает при восстановлении дибораном в момент его образования: 3 NaBH4 + 4 BF3 → 3 NaBF4 + 2 [B2H6]
1. Нагревание с гидроксидом натрия При нагревании с твердой щелочью бензофенон расщепляется с образованием бензола и бензоата натрия:
2. Расщепление амидом натрия Чисто ароматические кетоны расщепляются амидом натрия с образованием амидов кислот:
3. Образование металлкетилов При обработке чисто ароматических кетонов натрием или калием в инертном растворителе образуются окрашенные производные с парамагнитными свойствами, называемые металлкетилами:
|
81.
Одноосновные ароматические кислоты.
Получение и химические свойства.

Получение. Одноосновные ароматические кислоты, например бензойную, можно получать следующими способами:
1. Окислением спиртов и альдегидов, омылением нитрилов и т.д. Эти способы использовались и для получения кислот алифатического ряда.
2. Окислением гомологов бензола, например толуола:

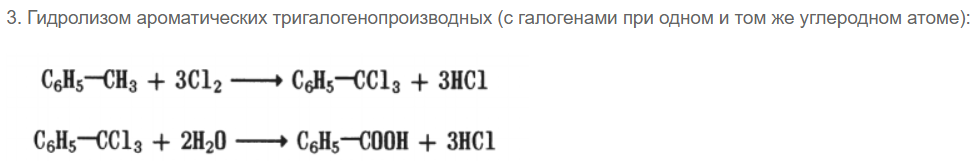


82.
Гидрокси- и аминозамещенные ароматические
кислоты и их производные.

83.
Дикарбоновые ароматические кислоты.
Получение и химические свойства.
Применение для получения полимеров.

 2.
Реакции декарбоксилирования
2.
Реакции декарбоксилирования
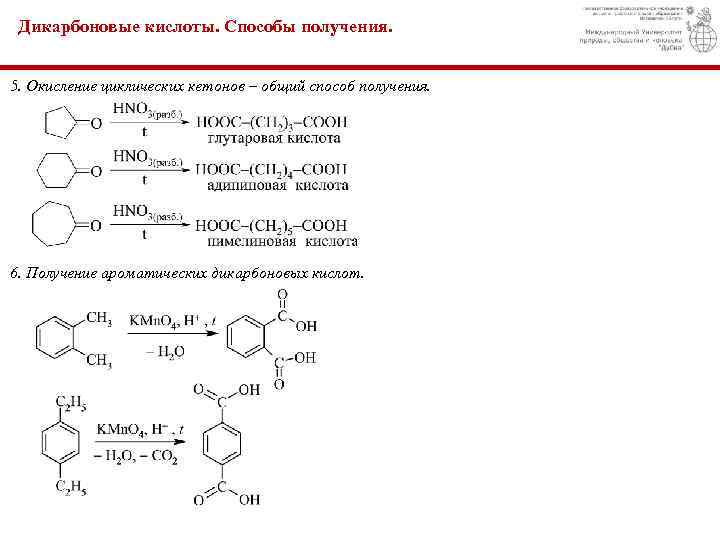
При нагревании фталевой кислоты до 200-2200С происходит декарбоксилирование с образованием бензойной кислоты:
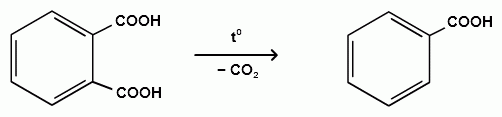
3. Реакции электрофильного замещения
Реакции электрофильного замещения в дезактивированное кольцо идут с большим трудом:
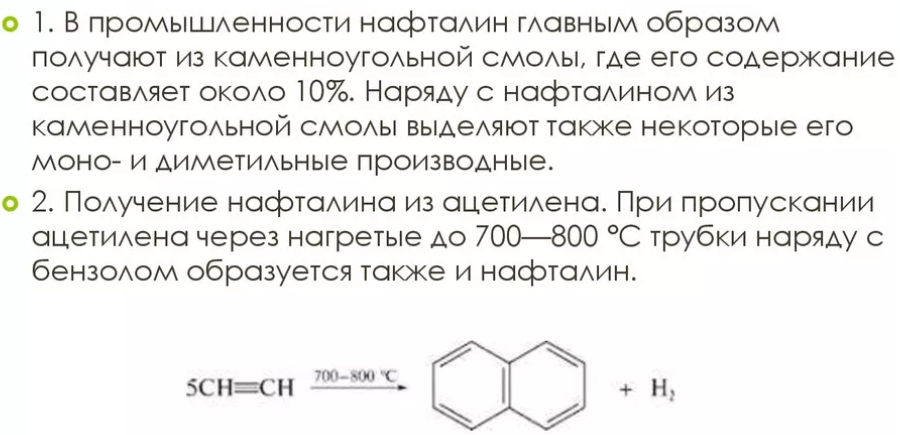
84. Нафталин и его производные. Синтез a- и b-производных нафталина.
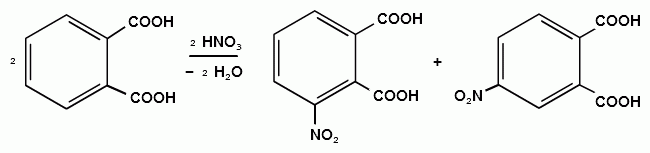
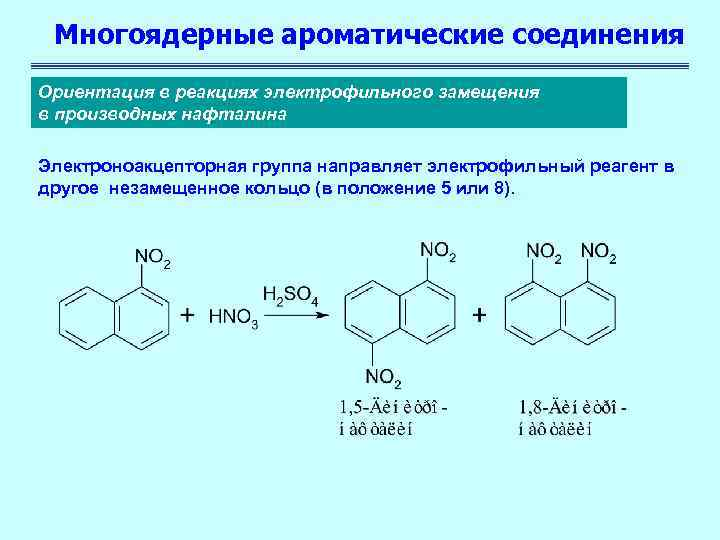
a-положение проявляет более высокую реакционную способность. Нитрование, галогенирование и низкотемпературное сульфирование ведут к a-производным.
Доступ к b-положению достигается главным образом посредством высокотемпературного сульфирования.
85. Химические свойства нафталина. Понятие о «диеновой» и ароматической реакционной способности.
1. При нитровании нафталина азотной кислотой в смеси с H2SО4 при 50-60°С образуется почти исключительно α-нитронафталин:

2. Хлорирование и бромирование нафталина протекает очень легко и не требует катализатора:

3. Наиболее важной является реакция сульфирования, на направление замещения оказывает влияние температура:

4. Ацилирование по Фриделю-Крафтсу в зависимости от растворителя приводит к α- или β-изомеру:

5. Реакции присоединения к нафталину протекают легче, чем в случае бензола. Восстановление нафталина осуществляется обычными восстановителями:

Каталитическое гидрирование приводит к образованию смеси тетралина и декалина.
6. Окисление нафталина кислородом воздуха в присутствии ViO3 приводит к разрушению одного кольца:

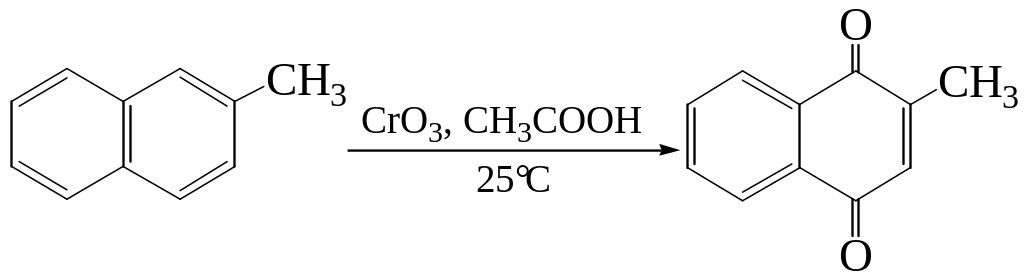

86. Пятичленные гетероциклические соединениия с одним гетероатомом. Строение, взаимные переходы. Примеры реакций электрофильного замещения (галогенирование, сульфирование, нитрование).
К пятичленным гетероциклам с одним гетероатомом относят пиррол, фуран, тиофен.
Фуран
- пятичленный гетероцикл с одним атомом
кислорода:
Тиофен
обладает выраженными ароматическими
свойствами. В реакциях электрофильного
замещения (галогенирование, нитрование
и др.) тиофен значительно активнее
бензола.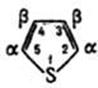
биотин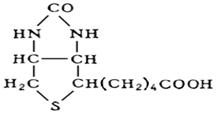
Пиррол
- пятичленный гетероцикл с одним атомом
азота.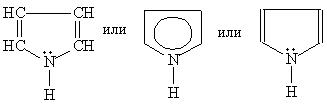
4. Взаимные превращения фурана, тиофена и пиррола.

1. Нитрование. Используют «мягкий» нитрующий агент – ацетилнитрит (смесь уксусного ангидрида с азотной кислотой) в пиридине, при этом образуются α-нитропроизводные:

где Z = О, NH, S
2. Сульфирование.Фуран и пиррол осмоляются при действии минеральных кислот (проявляют ацидофобные свойства), т.е. в кислой среде протон связывает неподеленную пару электронов кислорода или азота, образуется оксониевый или аммониевый ион, обладающий свойствами диена с сопряженными двойными связями, который легко полимеризуется и осмоляется:
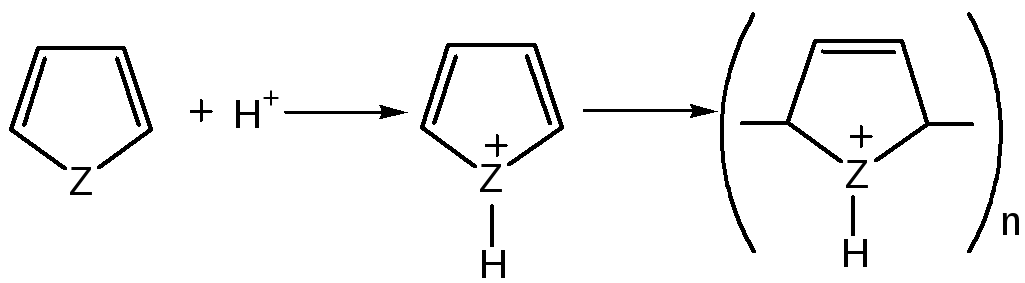
где Z = О, NH
Поэтому сульфируют фуран и пиррол с помощью пиридинсульфотриоксида – комплекс пиридина с оксидом серы (VI) C6H5NSO3:

где Z = О, NH
3. Основность ацидофобных гетероциклов (ацидофобность от лат. acidum – кислота, гр. phobos – боязнь).

Тиофен неацидофобен, т.к. у него практически отсутствуют основные свойства.
87. Строение пятичленных гетероциклических соединениий. Правило Хюккеля. Отношение к кислотам.
Молекула
пиррола плоская, что свидетельствует
о гибридизации как атомов углерода, так
и гетероатома азота. Причем три
гибридизованные орбитали атома азота,
принимающие участие в образованииσ-связей,
лежат в плоскости кольца.Гетероциклы
фуран и тиофен представляют собой
плоские молекулы.

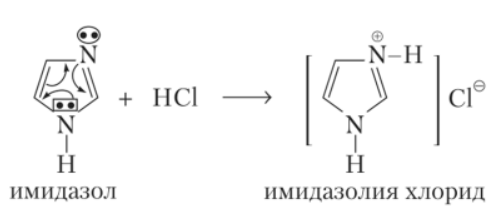

88. Кислотно-основные свойства пятичленных гетероциклов с одним гетероатомом.
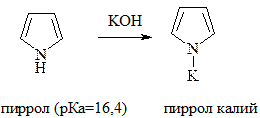


89. Получение, строение и химические свойства фурана (ацидофобность, диеновая и ароматическая реакционная способность).

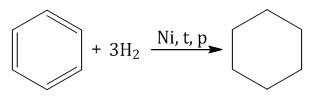


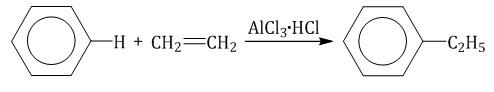






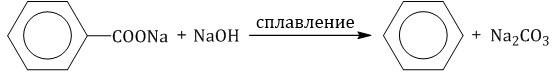






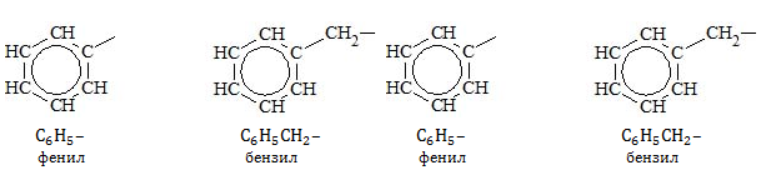
























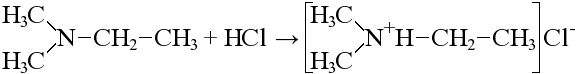
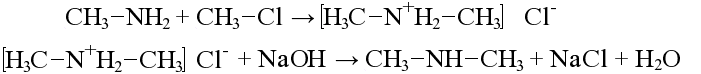








 с
ионной
с
ионной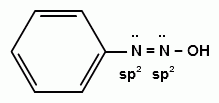
































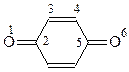





 толуол
п-толуиловый
альдегид
толуол
п-толуиловый
альдегид 2.
Формилирование по Вильсмейеру
2.
Формилирование по Вильсмейеру
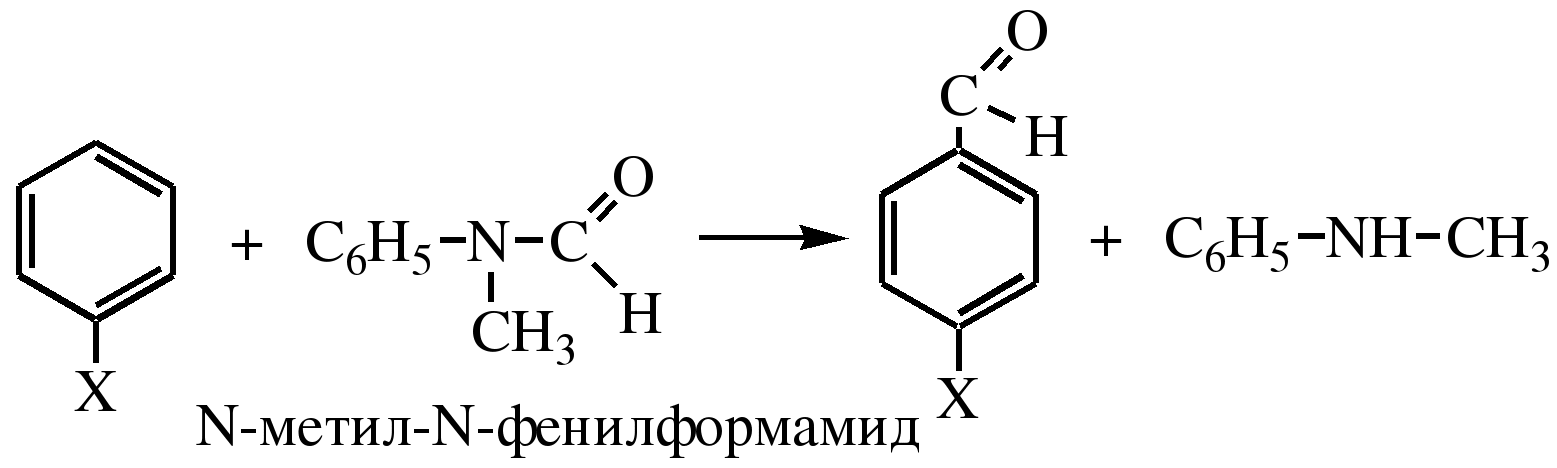 где
Х – электронодонорный заместитель,
например –N(CH3)2
где
Х – электронодонорный заместитель,
например –N(CH3)2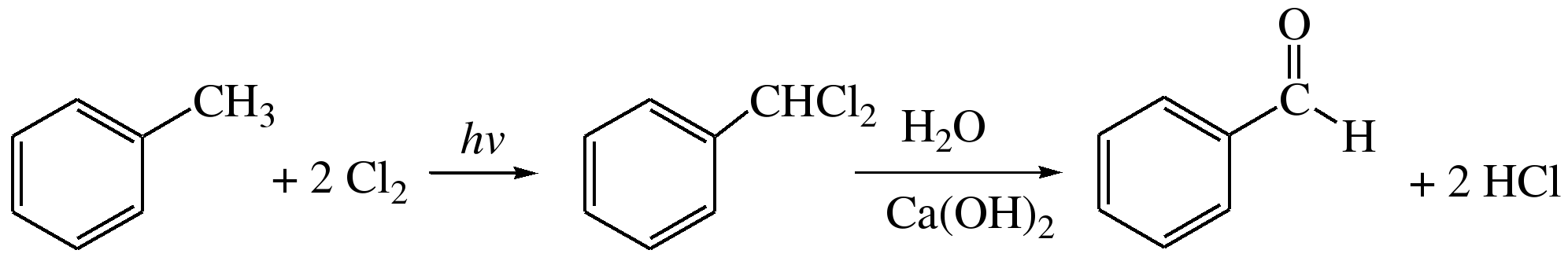 толуол
хлористый бензальдегид
толуол
хлористый бензальдегид
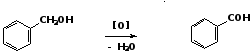




 этилфенилкетон
α-дикетон
этилфенилкетон
α-дикетон

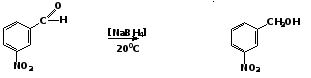




 м-нитробензальдегид
м-нитробензальдегид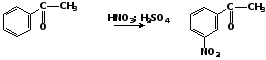



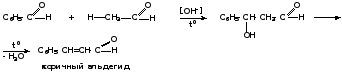

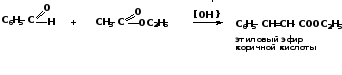
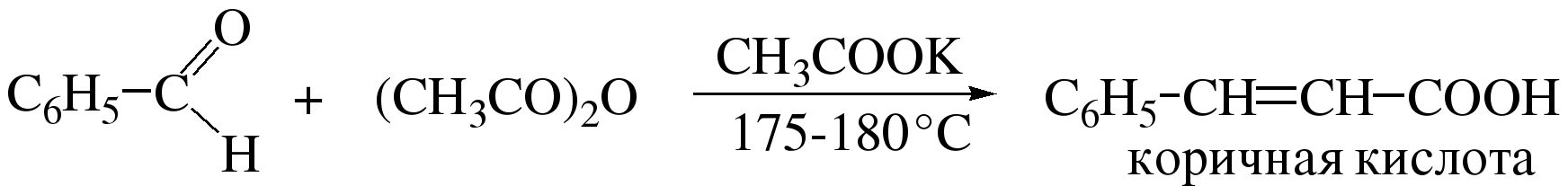
 Бензальдегид
в этих же условиях подвергается
димеризации с образованием
α-гидроксикетона – бензоина, который
легко окисляется в дикетон – бензил:
Бензальдегид
в этих же условиях подвергается
димеризации с образованием
α-гидроксикетона – бензоина, который
легко окисляется в дикетон – бензил: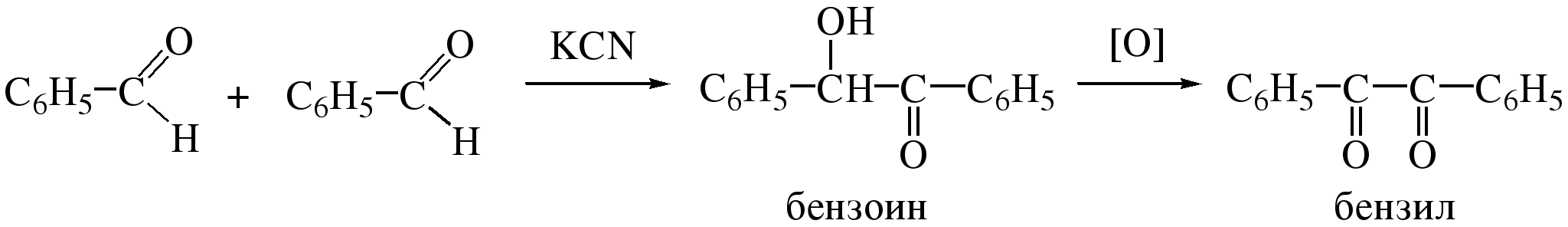

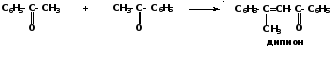
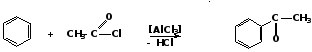
 бензоилхлорил
бензофенон
бензоилхлорил
бензофенон