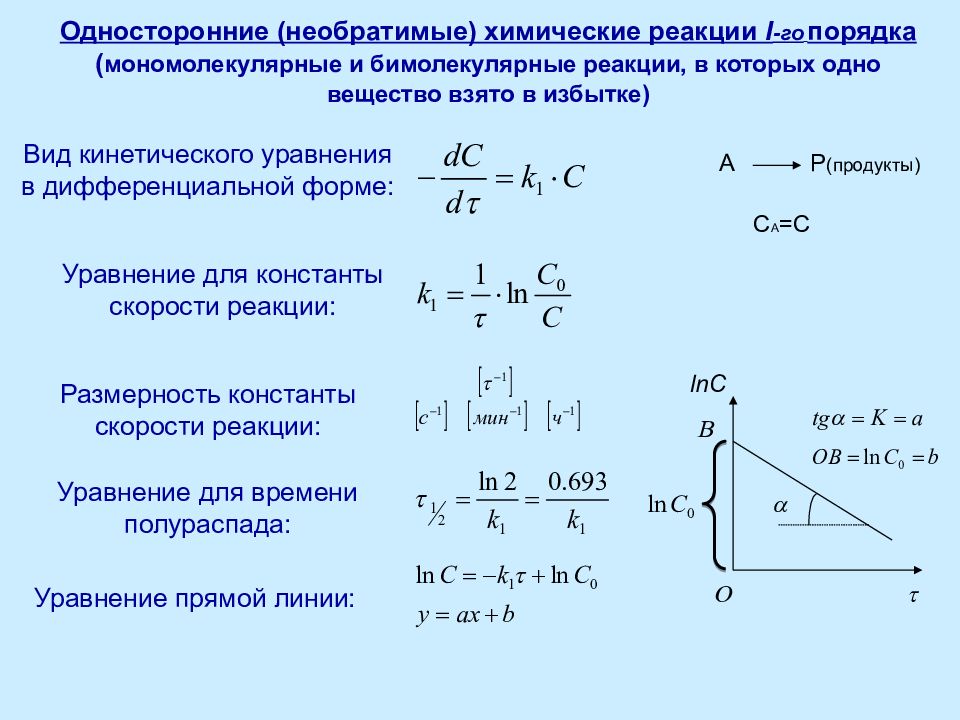
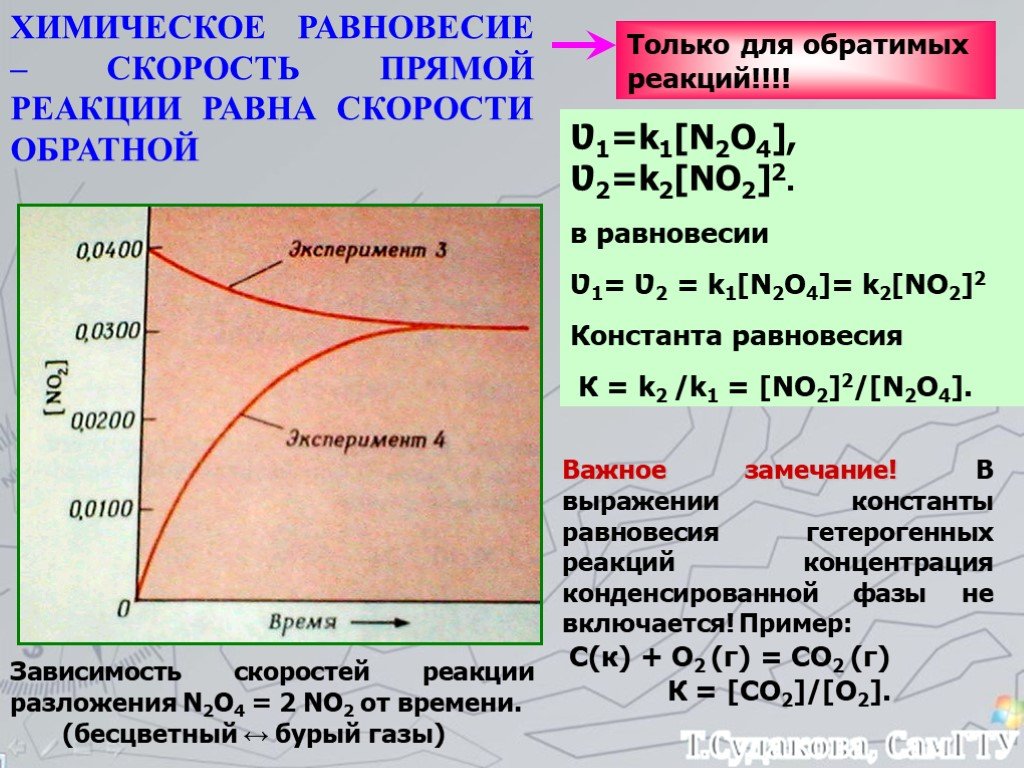
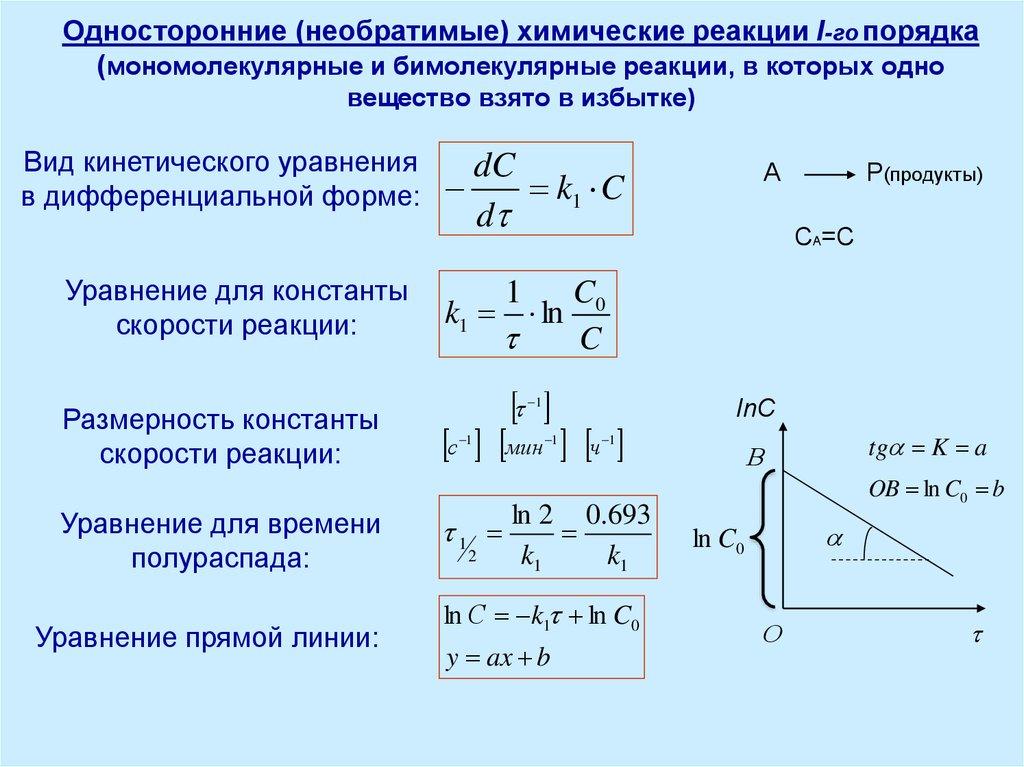
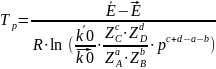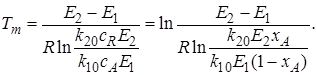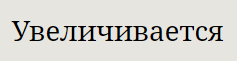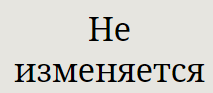!ЭКЗАМЕН ОХТ
.docx
1. Как изменяется равновесная температура при увеличении давления для экзотермической обратимой реакции, идущей с уменьшением объёма газообразных реагентов |
При увеличении давления равновесная температура увеличивается |
2. Как изменяется равновесная температура при увеличении давления для экзотермической обратимой реакции, идущей с увеличением объёма газообразных реагентов |
уменьшается |
3. Как изменяется равновесная температура при увеличении давления для экзотермической обратимой реакции, идущей без изменения объёма газообразных реагентов |
не влияет |
4. Как изменяется равновесная температура при увеличении давления для эндотермической обратимой реакции, идущей с уменьшением объёма газообразных реагентов |
При увеличении давления равновесная температура увеличивается.
|
5. Как изменяется равновесная температура при увеличении давления для эндотермической обратимой реакции, идущей с увеличением объёма газообразных реагентов |
При увеличении давления равновесная температура увеличивается( Tp увел. при P увел
|
6. Как изменяется равновесная температура при увеличении давления для эндотермической обратимой реакции, идущей без изменения объёма |
ДАВЛЕНИЕ НЕ ВЛИЯЕТ |
7. Как изменяется равновесная температура по мере протекания экзотермической обратимой реакции? |
уменьшается |
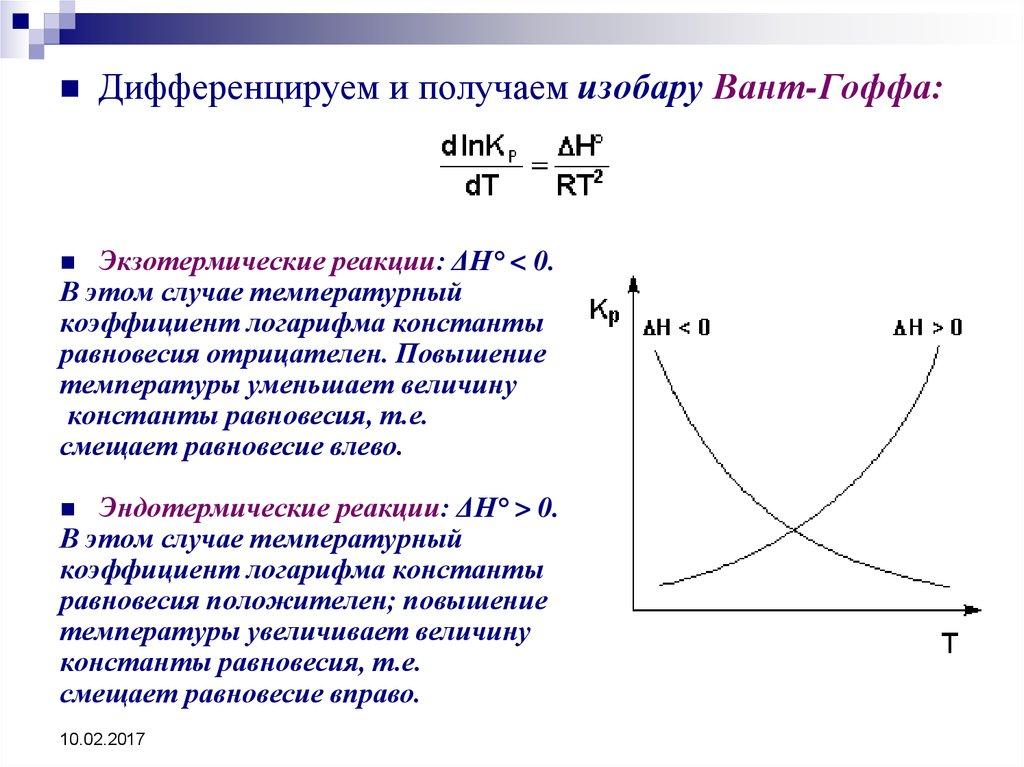
8. Как изменяется термодинамическая константа равновесия при увеличении температуры для экзотермической реакции? |
уменьшается |
9. Как изменяется термодинамическая константа равновесия при увеличении температуры для эндотермической реакции? |
увеличивается |
10. Как рассчитать величину равновесной температуры? |
Для расчёта равновесной температуры (Тр) надо приравнять скорость к нулю. U=0. И выражение для расчёта равновесной температуры имеет вид:
|
11. От каких управляющих параметров зависит термодинамическая константа равновесия Какие управляющие параметры позволяют изменить значение термодинамической константы равновесия. |
температура |
12. Уравнение закона Гесса Тепловой эффект химической реакции зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса, т.е. от числа и характера промежуточных стадий Определение теплового эффекта реакции по закону Гесса
|
Согласно
закону Гесса, тепловые эффекты всех
этих реакций связаны следующим
соотношением:
тепловой эффект химической реакции зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса, т. е. от числа и характера промежуточных стадий. |
13. Уравнение изобары Вант-Гоффа |
|
14. Используя известные термодинамические характеристики реакции рассчитать величину термодинамической константы равновесия для заданной температуры |
Термодинамическая константа равновесия (K) для реакции может быть рассчитана с использованием уравнения Гиббса-Гельмгольца: K = exp(-ΔG/RT) K - термодинамическая константа равновесия ΔG - изменение свободной энергии реакции R - универсальная газовая постоянная (8.314 Дж/моль·K) T - абсолютная температура в Кельвинах Известные термодинамические характеристики (например, изменение свободной энергии реакции) необходимо предоставить для конкретной реакции, чтобы получить точное значение термодинамической константы равновесия для заданной температуры. |
15. Рассчитать равновесный состав реакционной смеси при известных значениях температуры, давления и исходного состава реакционной смеси |
Для расчета равновесного состава реакционной смеси при известных значениях температуры, давления и исходного состава реакционной смеси можно использовать уравнение состояния и принцип Ле-Шателье. Воспользуемся
уравнением Вант-Гоффа для идеального
газа:
Для расчета состава реакционной смеси можно использовать также уравнение реакции с учетом стехеометрических коэффициентов и константы равновесия. |
16. Определение «Энергия активации». |
Энергия активации - это минимальный избыток энергии, при котором возможно протекание химической реакции |
17. Определение «Лимитирующая стадия процесса» |
стадия протекающая с минимальной скоростью.стадия процесса,обладающая меньшей скоростью |
18. Определение «Катализатор». |
Вещество изменяющее скорость реакции за счет образования промежуточных соединений с реагентами и восстанавливающее свой состав по окончании элементарного каталитического акта. группа веществ,изменяющая скорость хим.реакции,посредством вступления в промежуточные соединения с реагентами и восстанавливающее свой состав по окончании элементарного каталитического акта |
19. Определение «Скорость химической реакции». |
Изменение концентрации реагирующих веществ в единицу времени в единице реакционного пространства.изменение молярной концентрации одного из участвующих в реакции веществ в единицу времени |
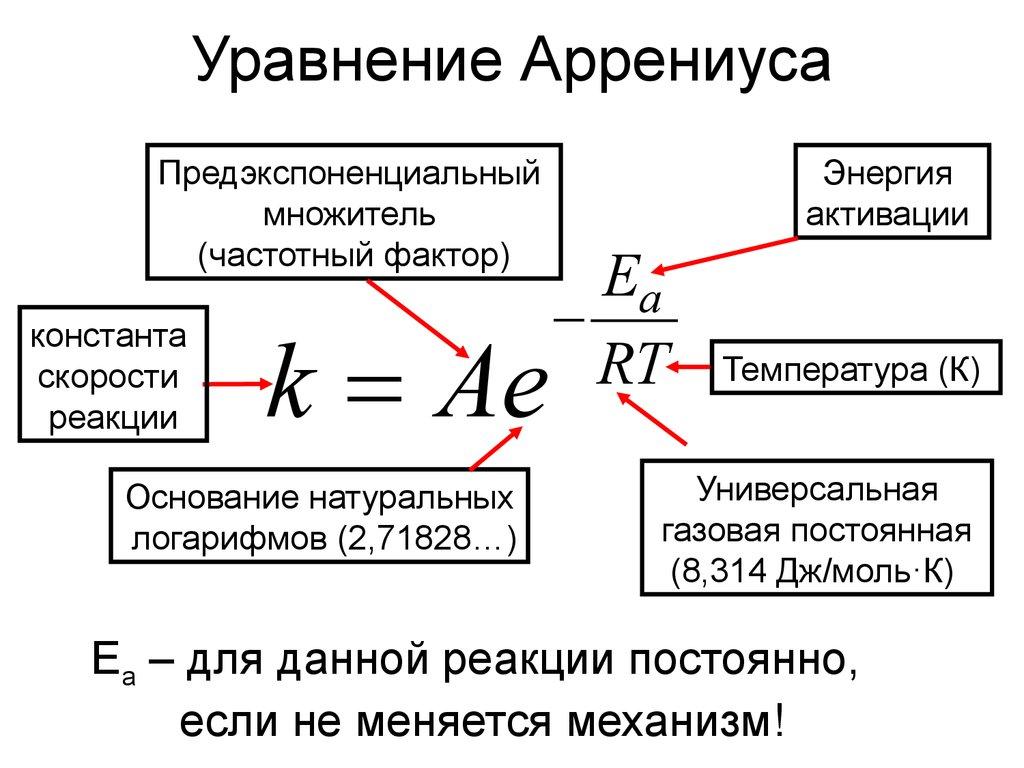
20. Физический смысл предэкспоненциального множителя в уравнении Аррениуса |
Максимально возможное значение константы скорости |
21. Уравнение Аррениуса |
|
22. Уравнение первого закона Фика.
|
|
23. Как зависит скорость процесса от температуры в кинетической области?
|
скорость реакции увеличивается. |
24. Как зависит скорость процесса от температуры в переходной области? |
Переходная область – это II область. Скорость увеличивается с увеличением температуры (закон Аррениуса НЕ соблюдается).. |
25. Как зависит скорость процесса от температуры в диффузионной области? |
Диффузионная область – это III область. Скорость практически не зависит от температуры. |
26. Как влияет размер обрабатываемого твёрдого материала на скорость гетерогенного процесса в кинетической области? |
Чем меньше размер частиц, тем выше скорость реакции |
27. Как влияет размер обрабатываемого твёрдого материала на скорость гетерогенного процесса во внешнедиффузионной области? |
Чем меньше размер частиц, тем выше скорость реакции
|
28. Как влияет размер обрабатываемого твёрдого материала на скорость гетерогенного процесса во внутридиффузионной области? |
Чем меньше размер частиц, тем выше скорость реакции. |
29. Области протекания процесса в системе «газ-твёрдое»
|
|
30. Области протекания процесса в системе «газ-жидкость» |
|
31. Области протекания процесса в системе «жидкость-твёрдое»
|
|
32. Области протекания гетерогенно-каталитического процесса
|
|
33. По известной зависимости скорости химико-технологического процесса от температуры определить область протекания химико-технологического процесс
|
Для определения области протекания химико-технологического процесса от температуры следует построить график зависимости скорости процесса от температуры. Затем, анализируя данный график, можно определить диапазон температур, при которых процесс будет протекать с заданной скоростью. |
34. По характеру изменения скорости химико-технологического процесса от размера гранул катализатора определить область протекания химико-технологического процесса
|
Для определения области протекания химико-технологического процесса от размера гранул катализатора необходимо исследовать зависимость скорости процесса от размера гранул. Путем построения соответствующего графика можно определить диапазон размеров гранул катализатора, при которых процесс будет протекать с необходимой скоростью. |
35. По характеру изменения скорости химико-технологического процесса от расхода реакционной определить область протекания химико-технологического процесса
|
необходимо исследовать зависимость скорости процесса от расхода реакционной массы. С помощью построения графика зависимости скорости процесса от расхода реакционной массы можно определить диапазон расходов, при которых процесс будет протекать с требуемой скоростью. |
36. Для известного процесса предложить технологические приёмы, обеспечивающие приближение к кинетической области для процессов, протекающих в диффузионной области
|
|
37. Как изменяется оптимальная температура по мере протекания обратимой экзотермической обратимой реакции?
|
|
38. Определение «Оптимальная температура процесса»
|
Температура при которой скорость реакции максимальная. температура, при которой скорость принимает максимальное значение (быстрее-лучше) |
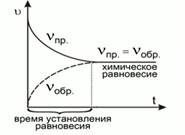
39. Как изменяется скорость обратимой реакции по мере её протекания?
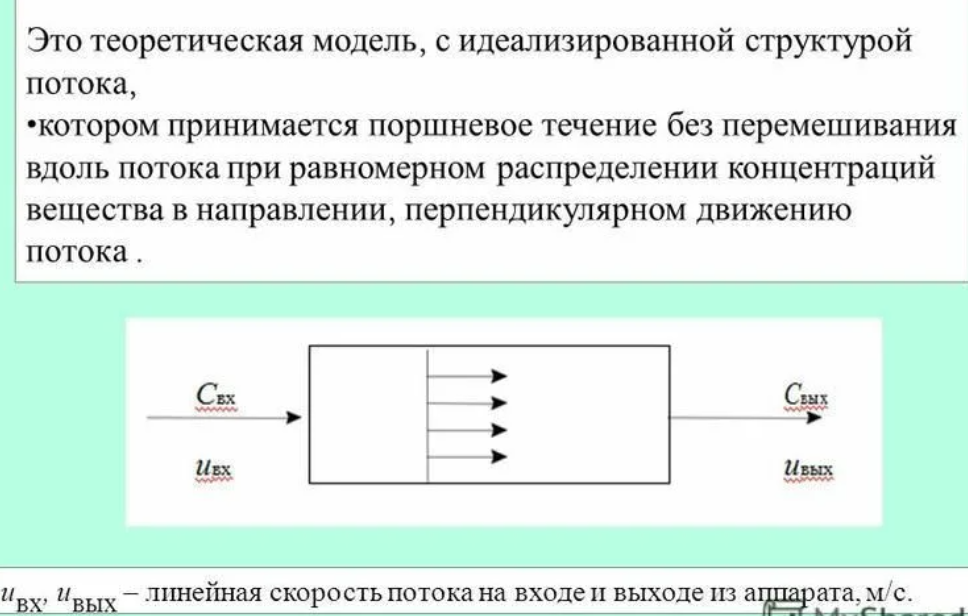
|
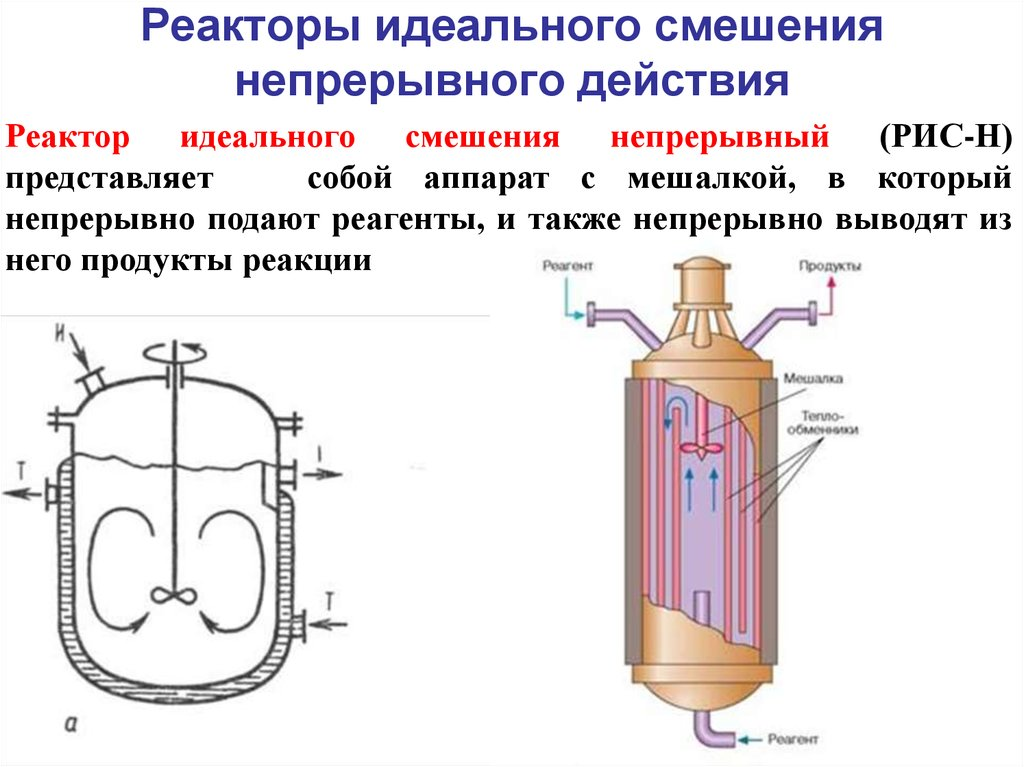
Обратимыми называются химические реакции, которые осуществляются во взаимно противоположных направлениях при одних и тех же условиях. Скорость
химической реакции увеличивается с
увеличением концентрации исходных
веществ и соответственно уменьшается
с уменьшением концентрации исходных
веществ. Получается, что, по мере
прохождения реакций, скорость прямой
реакции будет уменьшаться, т. к. исходные
вещества будут расходоваться. А
скорость обратной реакции будет
возрастать, потому что концентрация
вещества АВ исходного для обратной
реакции будет постепенно увеличиваться.
До каких пор скорость прямой реакции
будет уменьшаться, а обратной
увеличиваться? Это будет до того
момента, когда скорости прямой и
обратной реакции станут равными.
Наступит
химическое равновесие. |
40. Как изменяется оптимальная температура по мере протекания обратимой экзотермической обратимой реакции 41. Как изменяется оптимальная температура при увеличении давления для экзотермической обратимой реакции, идущей с уменьшением объёма газообразных реагентов Реакция с уменьшением объема газообразных реагентов, то есть c+d<a+b, c+d-a-b<0. Здесь с увеличением давления падает, следовательно, при постоянстве состава и маршрута протекания реакции значение под логарифмом уменьшается, то есть сам логарифм убывает, получаем, что оптимальная температура возрастает. Таким образом, при проведении обратимой экзотермической реакции, идущей с уменьшением газообразных реагентов, при повышении давления необходимо увеличивать и температуру в реакционной зоне. |
УМЕНЬШАЕТСЯ |
42. Как изменяется оптимальная температура при увеличении давления для экзотермической обратимой реакции, идущей с увеличением объёма газообразных реагентов |
При увеличении давления увеличивается концентрация, увеличивается скорость |
43. Как изменяется оптимальная температура при увеличении давления для экзотермической обратимой реакции, идущей без изменения объёма газообразных реагентов |
Не влияет |
44. Определение «Дифференциальная селективность». |
Отношение скорости целевой реакции к сумме скоростей всех реакций (целевых и побочных).изменение молярной концентрации одного из участвующих в реакции веществ в единицу времени |
45. Как изменяется скорость необратимой бимолекулярной реакции второго порядка при увеличении начальной мольной доли ключевого компонента |
|
46. Как изменяется скорость необратимой мономолекулярной реакции первого порядка при увеличении начальной мольной доли исходного регента |
|
47. Как изменяется скорость обратимой реакции по мере её протекания |
|
48. Как изменяется скорость необратимой реакции по мере её протекания
|
возрастает |
49. Уравнение скорости необратимой реакции |
|
50. Как рассчитать величину оптимальной температуры процесса? |
|
51. Определение «Дифференциальная селективность».
|
отношение скорости целевой реакции к сумме скоростей 1 и 2 реакции |
52. По известным экспериментальным данным определить энергию активации, предэкспоненциальный множитель и порядок реакции |
|
53. По результатам анализа кинетических характеристик предложить перечень управляющих параметров процесса, обеспечивающих достижение заданных показателей эффективности его протекания |
|
54. Микрокинетические управляющие параметры химико-технологического процесса |
|
56. Влияние температуры на равновесие эндотермической обратимой реакции |
Увеличение
температуры приводит к смещению
равновесия в сторону образовавшихся
продуктов, уменьшение - в сторону
исходных продуктов |
57.
Влияние температуры на равновесие
экзотермической обратимой реакции |
58.
Влияние давления на равновесие
обратимой реакции, идущей с увеличением
объёма газообразных реагентов
|
59.
Влияние
давления на равновесие обратимой
реакции, идущей с уменьшением объёма
газообразных реагентов |
60.
Влияние давления на равновесие
обратимой реакции, идущей без изменения
объёма газообразных реагентов |
61. Для известного химико-технологического процесса рассчитать предельную температуру, при которой может быть достигнута требуемая производительность по продукту при известном давлении, расходе реакционной смеси и исходном составе. |
Предельная температура (Tпр) - это температура, при которой достигается максимальная скорость реакции и максимальная производительность по продукту. Для расчета предельной температуры можно использовать различные методы, включая математическое моделирование и экспериментальные данные. Одним из подходов к расчету предельной температуры является использование термодинамических расчетов, таких как расчет равновесной константы K и изменение энтальпии реакции ΔH. Расчет равновесной константы K: Если процесс является адиабатическим, то для реакции A + B → C + D можно использовать уравнение равновесия: K = ([C]^c * [D]^d) / ([A]^a * [B]^b), где [C], [D], [A] и [B] - молярные концентрации продуктов и реагентов соответственно, a, b, c, d - коэффициенты стехиометрического уравнения реакции. Далее, можно использовать эквивалентную формулу Гиббса-Гельмгольца: ΔG° = -RTlnK, где ΔG° - изменение свободной энергии Гиббса при стандартных условиях, R - универсальная газовая постоянная, T - температура в К. Зная значение ΔG°, можно рассчитать предельную температуру при которой ΔG = 0: ΔG = ΔH - Tпр * ΔS = 0, где ΔS - изменение энтропии реакции. Отсюда следует, что Tпр = ΔH / ΔS. Расчет предельной температуры по реакционной кинетике: Для этого можно использовать уравнение Аррениуса: k = A * exp(-Ea/RT), где k - скорость реакции, A - пропорциональная константа, Ea - энергия активации, R - универсальная газовая постоянная, T - температура в К. Определение предельной температуры требуется решение уравнения: kпр = A * exp(-Ea/RTпр), где kпр - предельная скорость реакции. |
62. Параметры управления химико-технологическим процессом, определяющие величину скорости в кинетической области
|
Если наименьшую величину имеет скорость первой реакции или третьей стадии (этапа),то процесс протекает в диффузионной области, и управляющими являются макрокинетические параметры: линейная скорость подачи реагентов, степень перемешивания реагентов, размер гранулы катализатора и т.д. Если наименьшую величину имеет скорость второго этапа, то процесс протекает в кинетической области, и управляющими являются микрокинетические параметры: температура, давление, концентрация компонентов реакции смеси. Стадия процесса, обладающая меньшей скоростью, называется лимитирующей. При рассмотрении состояния равновесия, мы выяснили, как влияют микрокинетические параметры на скорость необратимой реакции. Установили, что температура влияет согласно уравнению Аррениуса, давление по степенному закону в соответствии с суммарной молекулярностью реагентов, установили, что с увеличением степени превращения ключевого компонента скорость уменьшается до 0 при полном превращении ключевого компонента. |
63. Влияние температуры на скорость обратимой экзотермической реакции. Повышение температуры идет через максимум |
64. Влияние температуры на скорость необратимой экзотермической реакции Увеличивается |
65. Влияние температуры на скорость необратимой эндотермической реакции Увеличивается |
66. Влияние температуры на скорость обратимой эндотермической реакции. Возрастает |
67. Влияние давления на скорость обратимой реакции, идущей с увеличением объёма газообразных реагентов - проходит через максимум |
68. Влияние давления на скорость обратимой реакции, идущей с уменьшением объёма газообразных реагентов (увеличивается) |
69. Влияние температуры на величину дифференциальной селективности при проведении параллельных реакций
|
70. Влияние мольной доли ключевого компонента на величину дифференциальной селективности при проведении параллельных реакций
|
71. Влияние давления на скорость обратимой реакции, идущей без изменения объёма газообразных реагентов |
(УВЕЛИЧИВАЕТСЯ) |
72. Рассчитать наблюдаемую скорость химико-технологического процесса по известному кинетическому уравнению при фиксированном значении управляющих параметров |
|
73. Предложить и расчетным путём подтвердить рациональный диапазон изменения температуры, в котором обеспечивается необходимое увеличение скорости процесса |
|
74. Параметры управления химико-технологическим процессом, определяющие величину скорости в диффузионной области |
Температура: Повышение температуры может увеличить скорость диффузии, поскольку молекулы имеют большую энергию, что позволяет им двигаться быстрее и преодолевать барьеры энергии, что способствует более быстрой диффузии вещества.
|
75. Какое значение имеет порядок реакции по компоненту в диффузионной области? |
|
76. Как перевести процесс из внешнедиффузионной области в кинетическую?
|
|
77. Как перевести процесс из внутридиффузионной области в кинетическую? |
|
78. Для известного гетерогенного процесса в системе «газ-твёрдое» рассчитать значение скорости процесса, протекающего в диффузионной области |
|
79. Предложить и расчетным путём подтвердить рациональный диапазон изменения расхода газа и размера обрабатывамых твёрдых частиц, в котором обеспечивается необходимое увеличение скорости процесса |
|
80. Закон сохранения массы вещества Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ |
81. Закон сохранения энергии Приход теплоты в данном аппарате должен быть равен расходу теплоты в том же аппарате |
82. Определение «Практический расходный коэффициент». |
кол-во сырья или энергоносителей необходимых для производства единицы кол-ва продукта |
83. Как рассчитать тепловой эффект реакции? |
|
84. Как рассчитать удельный тепловой эффект реакции по компоненту? |
|
85. Определение «Интенсивность работы реактора»-отношение производительности реактора к какому-либо геометрическому параметру, характеризующего реактор |
86. Определение «Интегральная селективность». отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству исходного реагента, пошедшего на все реакции (и целевую, и побочные). ИЛИ отношение производительности по ключевому компоненту в целевой реакции к сумме производительности по ключевому реагенту во всех реакциях. |
87. Определение «Выход продукта». отношение реально полученного количества продукта к максимально возможному его количеству, которое могло бы быть получено при данных условиях осуществления реакции. |
88. Определение «Теоретический расходный коэффициент».кол-во исходных реагентов или энергоносителей,необходимых для производства единицы кол-ва продукта |
89. Определение «Степень превращения вещества»- это отношение количества вещества вступившего в реакцию к его начальному количеству |
90. Как изменяется температура в реакторе при проведении экзотермической обратимой реакции в адиабатическом температурном режиме? увеличивается |
91. Как изменяется температура в реакторе при проведении эндотермической обратимой реакции в адиабатическом температурном режиме уменьшается |
92. Как изменяется температура в реакторе при проведении эндотермической обратимой реакции в политермическом температурном режиме уменьшается |
93. Как изменяется температура в реакторе при проведении эндотермической обратимой реакции в изотермическом температурном режиме Не изменяется |
94. Как изменяется температура в реакторе при проведении экзотермической обратимой реакции в политермическом температурном режиме Увеличивается |
95. Как изменяется температура в реакторе при проведении экзотермической обратимой реакции в изотермическом температурном режиме Скорость уменьшается |
96. Написать уравнение для расчёта мольной доли компонента, если известна начальная мольная доля компонента и степень превращения ключевого компонента xi = ni / n W=1+((c+d-a-b)/a)*ZNA*XEA ZEA=ZNA*(1-XEA)/W ZEC=(ZNC+(c/a)*ZNA*XEA)/W |
97. Как рассчитать практический расходный коэффициент по сырью, если известен теоретический расходный коэффициент по ключевому компоненту, мольная доля ключевого компонента в сырье и его степень превращения |
Практический расходный коэффициент = (Теоретический расходный коэффициент) / (Мольная доля ключевого компонента в сырье * Степень превращения ключевого компонента) Например, если теоретический расходный коэффициент равен 2 моль/час, мольная доля ключевого компонента в сырье составляет 0,5 и степень превращения ключевого компонента равна 0,8, то практический расходный коэффициент будет равен = 2 / (0,5 * 0,8) = 5 моль/час |
98. Как рассчитать производительность по ключевому компоненту, если известно начальное количество ключевого компонента и его степень превращения |
Производительность = (Начальное количество ключевого компонента) * (Степень превращения ключевого компонента) Например, если начальное количество ключевого компонента равно 10 моль, а его степень превращения составляет 0,6, то производительность по ключевому компоненту Производительность = 10 * 0,6 = 6 моль |
99. При известных значениях величин материальных и энергетических потоков определить необходимость изменения температурного режима работы реактора для обеспечения требуемого температурного диапазона его функционирования |
Если значения потоков выходят за пределы заданного диапазона, то необходимо принять меры по изменению температурного режима работы реактора. Это может включать изменение подачи тепла или холода, изменение теплообменных поверхностей, использование регулирующих клапанов и других методов контроля температуры |
100. Определение «Нестационарное состояние» положительным или отрицательным накоплением в-ва или энергии с течением времени |
101. Определение «Стационарное состояние» отсутствием положит или отриц накопления в-ва т энергии в течении времени, те по любому компоненту производная =0 |
102. Основные положения идеализированной модели идеального вытеснения |
|
103. Основные положения идеализированной модели полного смешения |
|
104. Уравнение материального баланса реактора идеального вытеснения |
|
105. Уравнение материального баланса реактора полного смешения |
|
106. Уравнение теплового баланса реактора идеального вытеснения в изотермическом температурном режиме |
|
107. Уравнение теплового баланса реактора полного смешения в изотермическом температурном режиме |
|
108. Уравнение теплового баланса реактора идеального вытеснения в адиабатическом температурном режиме |
|
109. Уравнение теплового баланса реактора полного смешения в адиабатическом температурном режиме |
|
110. Уравнение теплового баланса реактора идеального вытеснения в политермическом температурном режиме |
|
111. Уравнение теплового баланса реактора полного смешения в политермическом температурном режиме |
|
112. Для известного химико-технологического процесса рассчитать необходимый объём идеализированного реактора |
|
113. Для известного химико-технологического процесса установить рациональный температурный режим работы реактора |
|
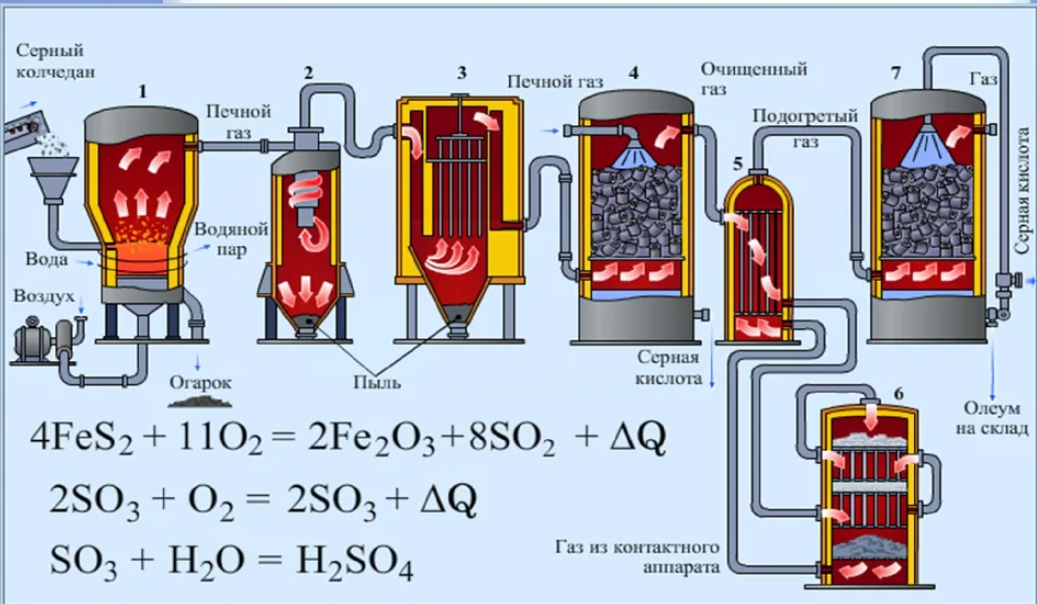
114. Стадии производства серной кислоты контактным способом |
|
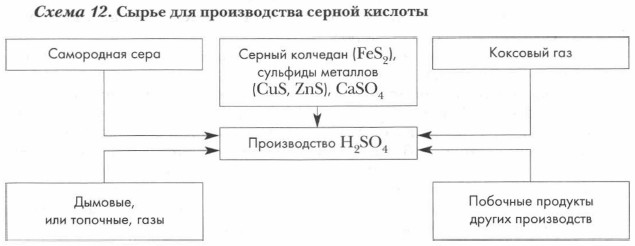
115. Сырьё для производства серной кислоты |
|
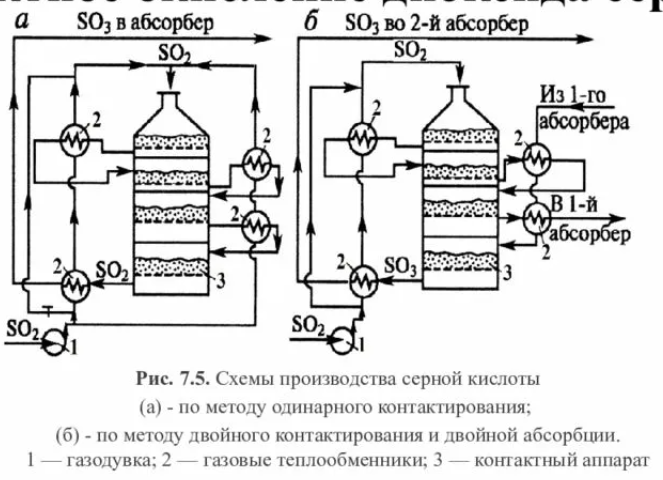
116.
Технологические параметры контактного
окисления диоксида серы |
|
117. Катализаторы окисления диоксида серы |
|
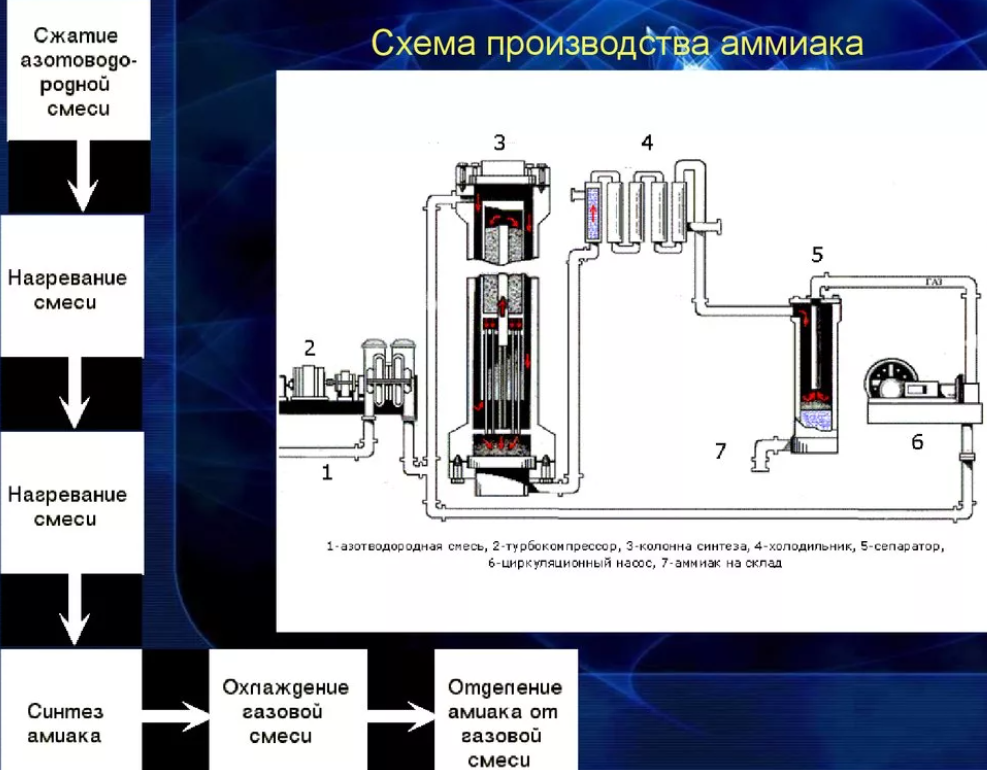
118. Сырьё для производства аммиака |
|
119. Стадии производства аммиака |
|
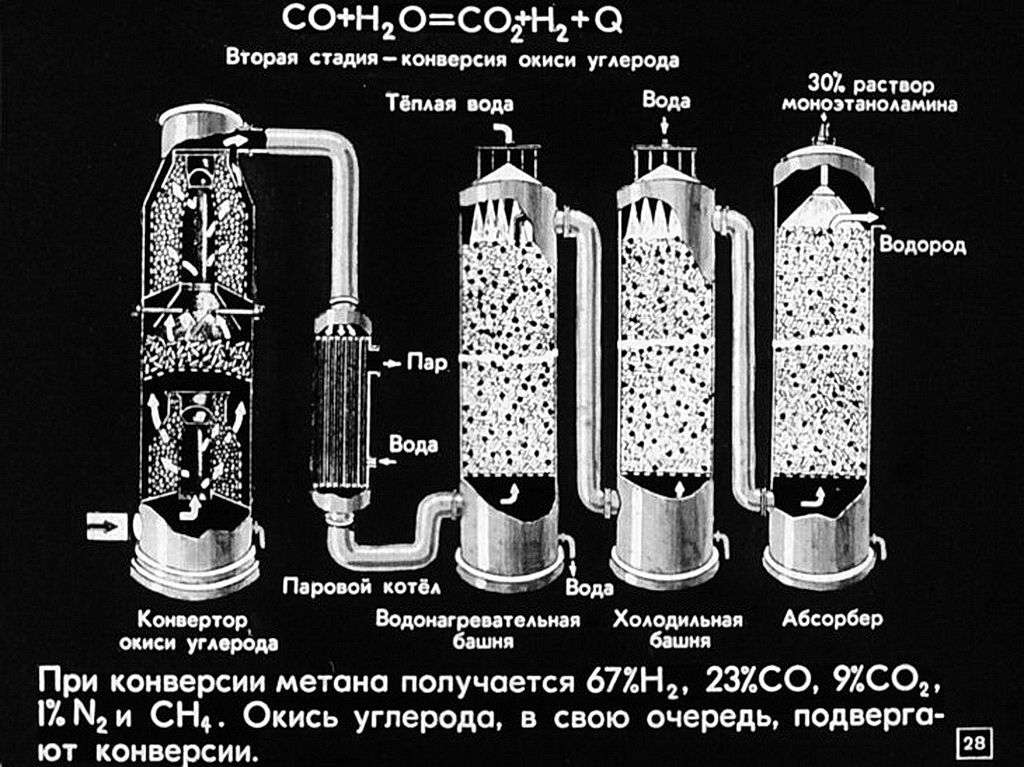
120. Технологические параметры конверсии природного газа в производстве аммиака |
|
121. Технологические параметры конверсии СО |
|
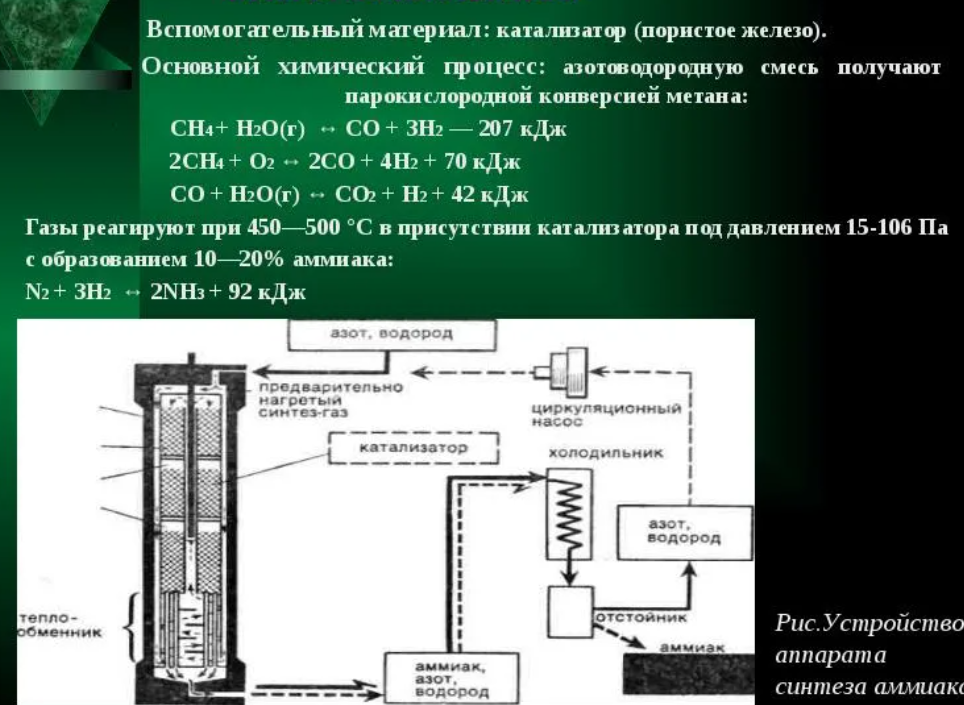
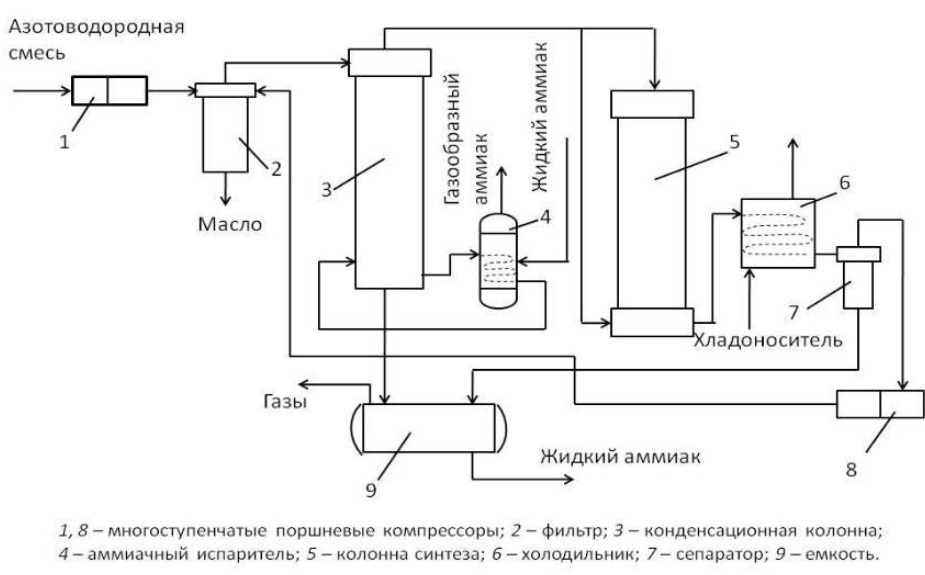
122. Технологические параметры синтеза аммиака |
|
123. Катализаторы синтеза аммиака |
|
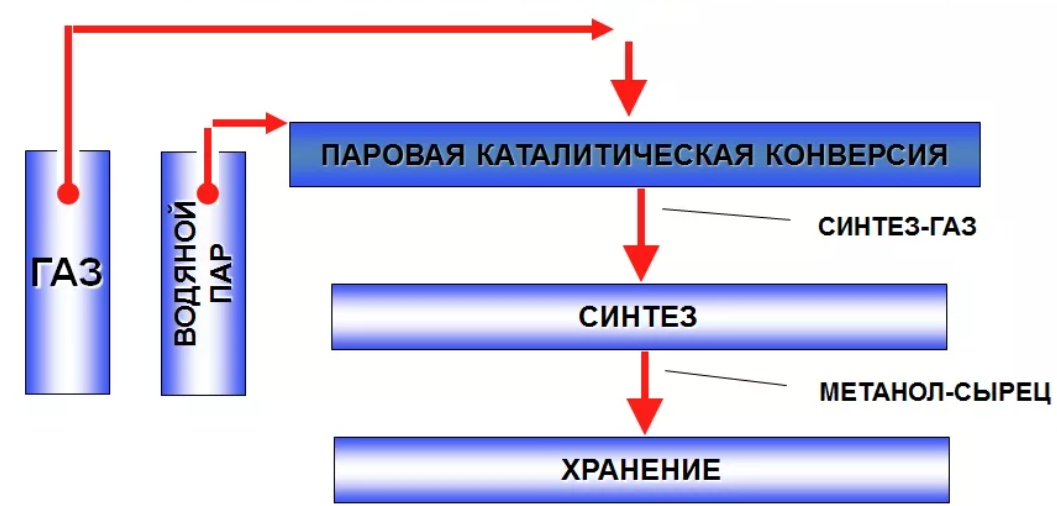
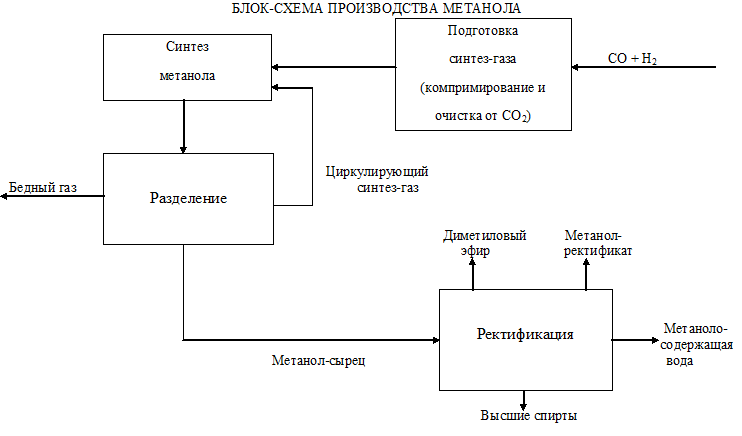
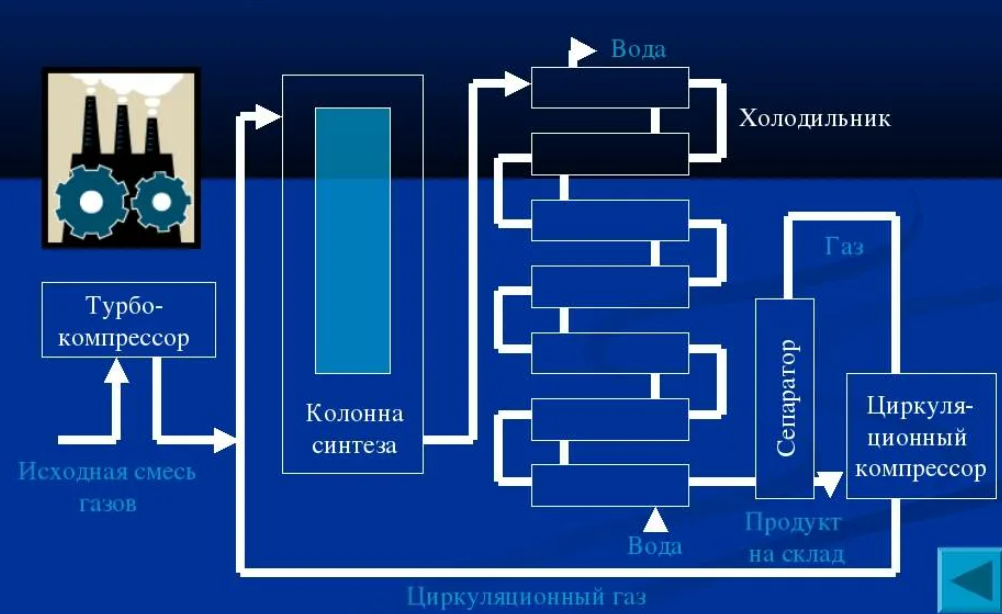
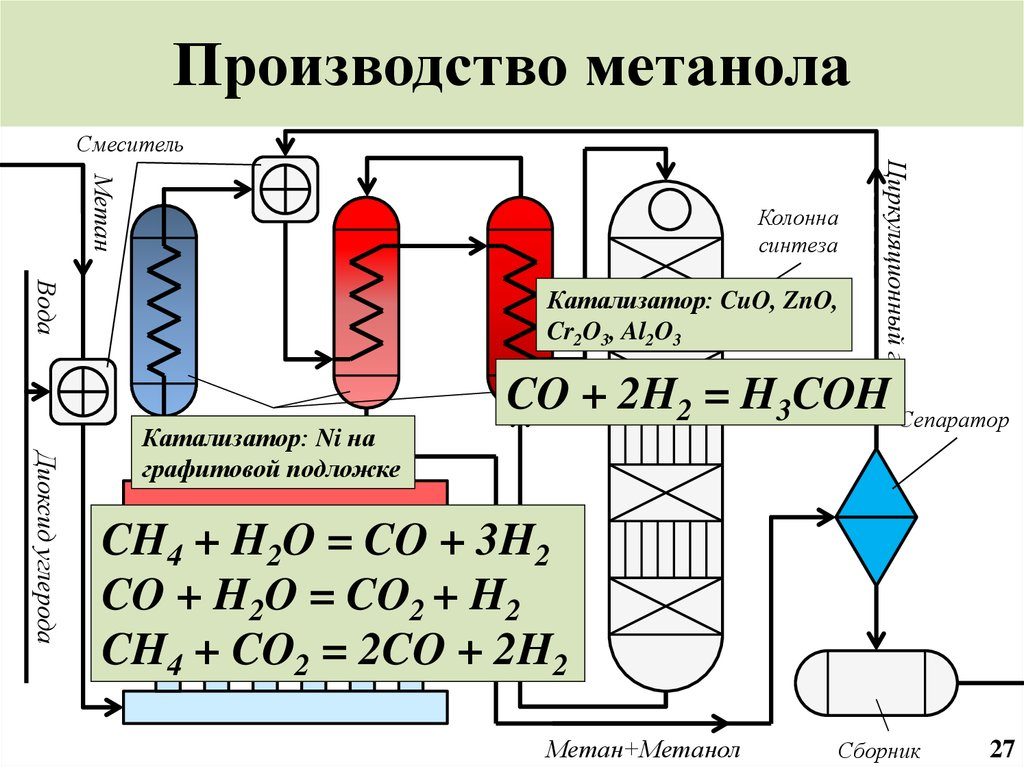
124. Сырьё для производства метанола |
|
125. Стадии производства метанола |
|
126. Технологические параметры конверсии природного газа в производстве метанола |
|
127. Технологические параметры синтеза метанола |
|
128. Катализаторы синтеза метанола |
|
129. При известных показателях функционирования рассчитать приведённую себестоимость продукции |
Чтобы рассчитать приведенную себестоимость продукции, необходимо иметь информацию о затратах на производство, включая затраты на сырье, энергию, трудовые затраты и другие операционные расходы. Приведенная себестоимость позволяет определить стоимость единицы продукции, исключая влияние факторов, которые могут изменяться от периода к периоду, например, инфляции или колебания цен на рынке. Формула для рассчета приведенной себестоимости может быть различной в зависимости от конкретного химико-технологического процесса и условий его функционирования. Если у вас есть конкретные показатели функционирования, я смогу помочь вам с рассчетом. |
130. Для известного химико-технологического процесса показать преимущество секционирования рабочей зоны с промежуточным теплообменом |
Секционирование рабочей зоны с промежуточным теплообменом в химико-технологическом процессе имеет ряд преимуществ. Оно позволяет контролировать температуру и другие параметры работы каждой секции независимо от других секций. Это может быть особенно полезно, когда требуется различные условия для разных этапов процесса. Промежуточный теплообмен между секциями позволяет эффективно использовать тепло, например, отходящее тепло из одной секции может быть использовано для подогрева входящих потоков в другой секции. Это может помочь снизить затраты на энергию и повысить эффективность процесса. |
131. Для известного химико-технологического процесса показать преимущество секционирования рабочей зоны с промежуточным вводом байпаса |
Секционирование рабочей зоны с промежуточным вводом байпаса также имеет свои преимущества в химико-технологическом процессе. Байпас представляет собой побочный поток, который обходит определенную секцию процесса. Это может быть полезно, когда требуется пропустить определенный этап процесса или изменить его условия. Например, если требуется временно исключить реакцию в определенной секции, ввод байпаса позволит обходить эту секцию, не прерывая остальной процесс. Также промежуточный ввод байпаса может быть использован для адаптации процесса к изменяющимся условиям или для проведения дополнительных операций на стадии промежуточного обработки. |
132. Для известного химико-технологического процесса показать преимущество применения циклической схемы производства |
Применение циклической схемы производства в химико-технологическом процессе имеет свои преимущества. Эта схема предусматривает повторение последовательности операций в течение определенного периода времени. Преимущество заключается в оптимальном использовании оборудования и ресурсов. Когда операции повторяются в цикле, возможно сократить время простоя оборудования и улучшить общую эффективность процесса. Важно, чтобы циклическая схема была правильно спланирована и согласована с требованиями процесса, дабы избежать ненужных затрат на операции или потери качества продукции. |