
Получение:
В лаборатории:
Cu+4HNO3 = Cu(NO3)2+2NO2+2H2O (t) 2Pb(NO3)2 = 2PbO + 4NO2+O2.
В промышленности:
2NO+O2 = 2NO2 (обратимая)
Химические свойства
2NO2+H2O = HNO3+HNO2, при этом происходит диспропорционирование на азотную и азотистую кислоты.
При температуре выше 0 °С реакция протекает по другому:
3NO2+H2O = 2HNO3+NO. 4NO2+2H2O+О2 = 4HNO3. С+2NO2 = CO2+2NO; S+2NO2 = SO2+2NO.
N2O5:
 бесцветные,
очень летучие кристаллы. Крайне
неустойчив.
бесцветные,
очень летучие кристаллы. Крайне
неустойчив.
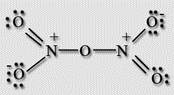
Оксид азота (V) – ангидрид азотной кислоты, построен из ионов NO2+ и NO3-.
Получение:
2HNO3+P2O5 = N2O5+2HPO3 (-10С) 2NO2+O3 = N2O5+O2.
Химические свойства:
2N2O5 = 4NO2+O2. N2O5+H2O = 2HNO3.
Является сильным окислителем:
N2O5+I2 = I2O5+N2.
Аммиак и гидразин: получение, химическая связь и строение молекул, кислотно–основные и окислительно-восстановительные свойства.
NH3:
Бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что пршшиводит к его хорошей растворимости в воде.
Получение:
Промышленность (Процесс Габера):
N2+3H2 ↔ 2NH3
Лаборатория: действие сильных щелочей на соли аммония:
NH4Cl+NaOH = NH3↑+NaCl+H2O. NH4NO3+NaOH = NH3↑+NaNO3+H2O.
Химические свойства:
1. Реакции присоединения:
а) С водой: (реакция обратимая)
NH3+H2O = NH3*H2O или NH4OH
б) С кислотами:
NH3+HCl = NH4Cl NH3+H2SO4 = NH4HSO4 2 NH3+H2SO4 = (NH4)2SO4
в) С кислыми солями аммония (превращает в средние)
NH3+NH4H2PO4 = (NH4)2HPO4 NH3+NH4HSO4 = (NH4)2SO4
2. С кислородом:
4NH3+3О2 = 2N2+6H2O 4NH3+5О2 = 4NO+6H2O
3. C хлором:
NH3+3Cl2 = 2N2↑+6HCl
4. С оксидом меди (II):
3CuO+2 NH3 = 3Cu+N2↑+3H2O
5. C металлами:
2NH3+2Al = 2AlN+3H2
6. С углекислым газом
2NH3+CO2 = H2O+CO(NH2)2
7. Реакция разложения:
2NH3 = N2+3H2
Гидрази́н (диамид):
H2N—NH2 — бесцветная, сильно гигроскопическая жидкость с неприятным запахом. Ядовитый.
Получение:
1. Окисление аммиака NH3 или мочевины CO(NH2)2 гипохлоритом натрия NaClO:
NH3+NaClO = NH2Cl+NaOH NH2Cl+NH3 = N2H4·HCl, (160С, 2,5−3,0 МПа)
2. Синтез гидразина окислением мочевины гипохлоритом по механизму аналогичен синтезу аминов из амидов по Гофману:
H2NCONH2+NaOCl+2NaOH = N2H4+H2O+NaCl+Na2CO3 (t, p)
3. Гидразин характеризуется восстановительными свойствами:
N2H4+O2 = N2+2H2O 2N2H4+4KMnO4+6Hэ.2SO4 = 5N2+4MnSO4+K2SO4+16H2O
4. Только очень сильные восстановители способны восстановить его до N(-3):
N2H4+Mg+4HCl = MgCl2+2NH4Cl
Реакции термического разложения солей аммония: нитриты, нитрата, бихромата, сульфата, хлорида.
NH4NO3 = N2O+2H2O (250°) 2NH4NO3 = 2N2+O2+2H2O (400°) NH4NO2 = N2+2H2O (t) (NH4)2Cr2O7 = N2+Cr2O3+4H2O (180 ° ) NH4Cl = NH3+HCl (t) (NH4)2SO4 = 2NH3+H2SO4 (t)
Гидроксиламин, азотистоводородная кислота и ее соли: химическая связь и строение молекул, получение и свойства.
Гидроксиламин (NH2OH):
Кристаллическое ядовитое вещество, проявляющее преимущественно восстановительные свойства.
Получение:
Электрохимически восстанавливают раствор азотной кислоты, на катоде суммарно происходит реакция: HNO3+ 6H++6е= NH2OH+2H2O
Химические свойства:
ОВР:
NH2OH+2KMnO4+9H2SO4 = 5N2+2MnSO4+K2SO4+18H2O 2NH2OH+I2+2KOH = N2+2KI+4H2O
1. Промежуточная степень окисления атома азота объясняет диспропорционирование этого соединения при нагревании и способность восстанавливаться до иона NH4+
3NH2OH = N2+NH3+3H2O(t) 4KI+2NH2OH+3H2SO4 = 2I2+(NH4)2SO4+K2SO4+2H2O NH2OH+HCl = [NH3OH]Cl
2. Азотистый водород (в растворе-азотистоводородная кислота) может быть получена следующим образом:
N2H4+HNO2 = HN3+H2O
3. Соль этой кислоты-азид натрия-получают так:
2NaNH2+N2O = NaN3+H2O (200°)
4. Как окислитель HN3 в растворе имеет черты сходства с азоткой, например:
Cu+3HN3 = Cu(N3)2+N2+NH3
5. Азиды щелочных и щелочноземельных металлов плавятся не разлагаясь и хорошо растворимы в воде, азиды тяжелых металлов при нагревании и даже от удара взрываются.
Взаимодействие металлов с азотной кислотой.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:
![]()
![]()
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3:
![]()
Разбавленная HNO3:
![]()
б) с металлами, стоящими в ряду напряжений левее водорода:
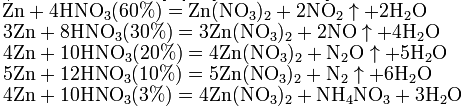
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
![]()
![]()
Царская водка и ее окислительные свойства на примере реакций с золотом, платиной, сульфидом ртути.
Смесь 3 объемов концентрированной соляной и 1 объема азотной кислоты называют «царской водкой». Это название отражает тот факт,что указанная смесь растворяет «царя металлов»- золото:
Au+4HCl+HNO3 = H[AuCl4]+NO+2H2O 3Pt+4HNO3+18HCl = 3H2[PtCl6]+4NO+8H2O 3HgS+8HNO3(к)+6HCl(к) = 3HgCl2+3H2SO4+8NO↑+4H2O
Реакции термического разложения нитратов различных металлов.

Фосфор (VA):
Общая характеристика и химические свойства фосфора его получение в промышленности. Белый фосфор - мягкое, реакционноспособное, очень токсичное вещество, хранят под слоем воды, так как на воздухе он самовоспламеняется. Белый фосфор представлен молекулами P4, имеющими форму тетраэдра и распадающимися при температурах выше 800 на молекулы состава P2. Неочищенный белый фосфор обычно называют «жёлтый фосфор» При длительном нагревании свыше 250 белый фосфор переходит в красный фосфор, который вполне устойчив на воздухе, не ядовит и воспламеняется только при нагревании свыше 400.
Красный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Черный фосфор, являющийся наиболее устойчивой модификацией, получается из белого фосфора при высоком давлении. Черный фосфор жирен на ощупь, похож на графит, полупроводник, не ядовит.
Получение:
Белый фосфор получают путем прокаливания фосфорной руды с коксом и кварцевым песком в электропечи
2Ca3(PO4)2+10C+6SiO2 = P4+6CaSiO3+10CO (1500 ° С)
Химические свойства:
1. Вал. возможности по методу ВС 3 и 5, С.О. от -3 до +5, у атома фосфора в отличие от атома азота имеется возможность Д-А механизма за счет свободных d-орбиталей.
P4+3O2(нед.) = P4O6 P4+5O2(изб.) = P4O10 P4+6Hal2(недост) = 4PHal3 P4+10Hal2(изб) = 4PHal5 P4+10S = P4S10 P4+6Zn =2Zn3P2 (спекание) 12K+P4 = 4K3P
2. Обезвреживание:
P4+10CuSO4+16H2O = 10Cu+4H3PO4+10H2SO4
3. Фосфор безразличен к водным растворам минеральных кислот. Медленно реагирует с кислотами-окислителями:
3P4+20HNO3(к)+8H2O = 12H3PO4+20NO P4+20HNO3(к) = 4HPO3+20NO2+8H2O P4+10H2SO4(к) = 4HPO4+10SO2+4H2O
4. В теплом растворе щелочи P4 диспропорционирует
P4+3NaOH+3H2O = PH3+3NaH2PO2
Оксиды
фосфора: получение, строение молекул и
свойства.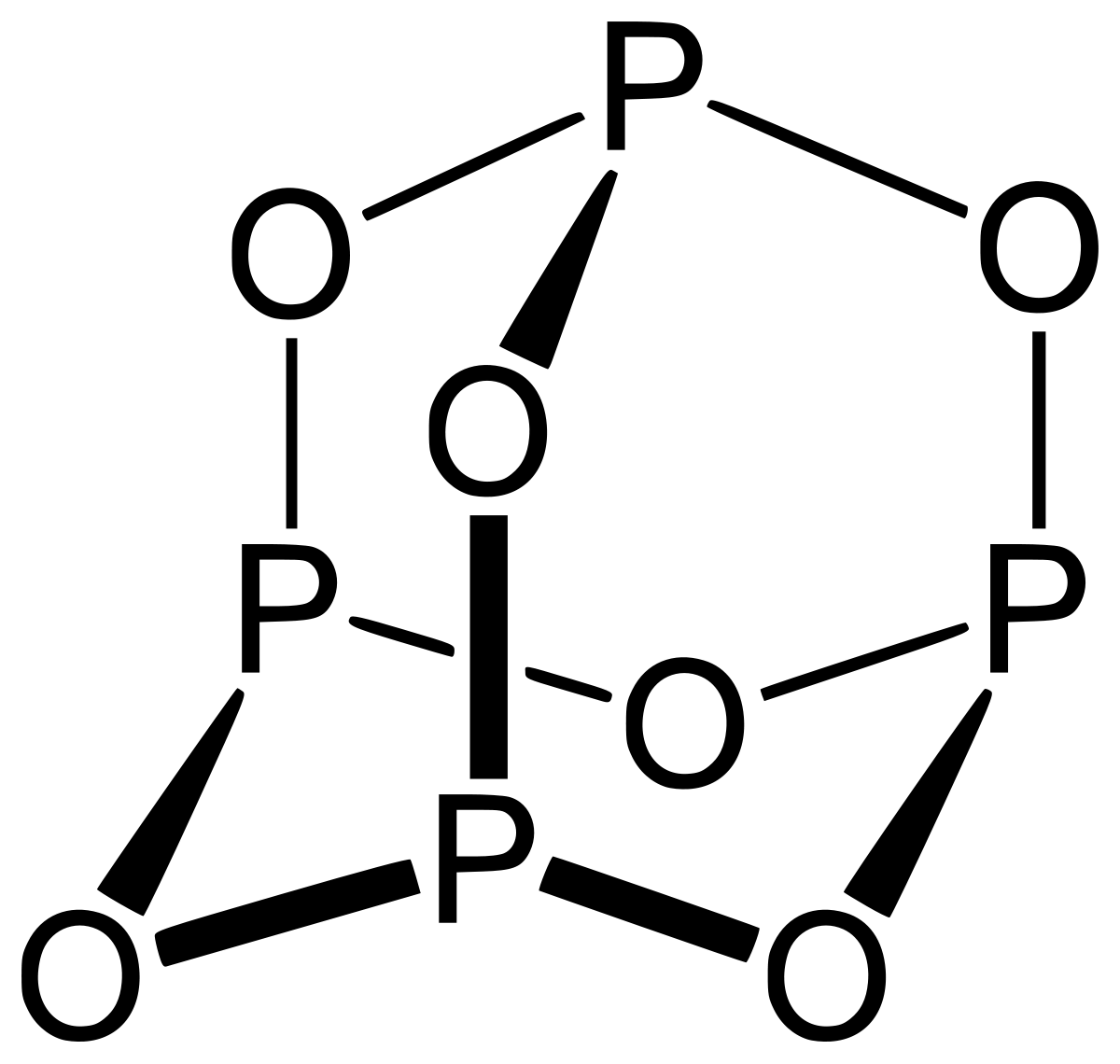
Получение P4O6:
контролируемое окисление P4 в атмосфере, содержащей
5%
O2 и 25% N2.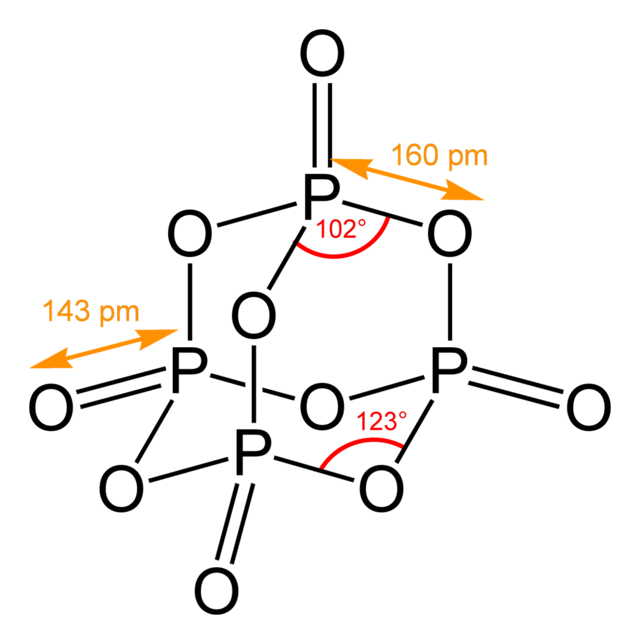
![]()
P4O6+6H2O
= 4H3PO3 (холод)
P4O6+2O2 = P4O10
4H3PO3 = 3H3PO4+PH3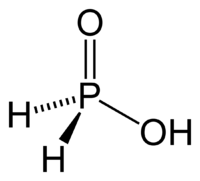
Получение P4O10:
![]() (в
изб)
(в
изб)
nP4O10+4nHNO3= 4(HPO3)n+2nN2O5
с холодной водой:
2P4O10+2nH2O = 4(H3PO3)n P4O10+6H2O = 4H3PO4 (t) P4O10+6Et2O = 4PO(OEt)3
Фосфорноватистая и фосфористая кислоты: получение, строение молекул, кислотно-основные и окислительно-восстановительные свойства. Фосфиты и гипофосфиты.
Фосфорноватистая кислота может быть получена
P4+3Ba(OH)2+6H2O = PH3+3Ba(H2PO2)2 Ba(H2PO2)2+H2SO4 = BaSO4+2H3PO2
H3PO2-одноосновная, достаточно сильная
Соли фосфорноватистой кислоты называются гипофосфитами являются хорошими восстанов Эние для химической металлизации диэлектриков:
H3PO2+4AgNO3+2H2O = H3PO4+4Ag+4HNO3 2CuSO4+NaH2PO2+2H2O = 2Cu+NaH2PO4+2H2SO4
Фосфористая
кислота
H2(PHO3)
двухосновная в водных растворах, а
формально трёхосновная кислота средней
силы:
P4O6+6H2O = 4H3PO3 (холод) 7P4O6+30H2O = 2PH3+2P4+18H3PO4 (t) H3PO3+Cl2+H2O = 2HCl+H3PO4 Na2HPO3+2AgNO3+H2O = Na2HPO4+2Ag+2HNO3
Фосфиты являются неплохими восстановителями, в ОВР окисляются до соединений фосфора 5:
H3PO3+Cl2+H2O = 2HCl+H3PO4 Na2HPO3+2AgNO3+H2O = Na2HPO4+2Ag+2HNO3
Кислоты фосфора (+5) и качественные реакции на них. Получение фосфорной кислоты в промышленности.
P4O10+2H2O = 4HPO3 (мета) 2HPO3+H2O = H4P2O7 (пиро) H4P2O7+H2O = 2H3PO4 (орто)
Растворы мета- и пирофосфорной кислот достаточно трудно отличить,до сих пор для определения этих кислот используется буквально старинный рецепт, мета-сворачивает яичный белок,пиро-нет.
Н3РО4+3AgNO3 = Ag3PO4+3HNO3
Качественной реакцией на ион РО43− является образование ярко-жёлтого осадка молибденофосфата аммония:
H3PO4+12(NH4)2MoO4+21HNO3 = (NH4)3PMo12O40·6H2O+21NH4NO3+6Н2О
Получение: в промышленности
4Р+5О2 = Р4О10 Р4О10+6Н2О = 4Н3РО4
Мышьяк, сурьма, висмут (VA):
Общая характеристика и химические свойства мышьяка, сурьмы и висмута.
Мышьяк и сурьма имеют ряд аллотропных модификаций. В подгруппе сверху вниз более стабильными становятся соед. с.о. +3. В целом для этих эл-ов хар-ны с.о. от -3 до+5. Встречаются в основном в виде сульфидов.
Получение:
Сульфид(As4S4/Sb2S3/Bi2S3)+O2 = Оксид(As2O3,Sb2O4,Bi2O3)+C = Э
Химические свойства:
1. Реакции простых веществ с серной к-той:
4As+6H2SO4(к)=As4O6+6SO2+6H2O 2Sb+6H2SO4(к)=Sb2(SO4)3+3SO2+6H2O(Bi)
2. Bi пассив-ся в HNO3(конц).
3. Взаимодействие простых веществ с HNO3:
As+5HNO3(к) = H3AsO4+5NO2 + H2O 2Sb+10HNO3(к) = Sb2O5+10NO2+5H2O As+HNO3(р)+H2O = H3AsO3+NO 4Sb+4HNO3(р) = Sb4O6+4NO+2H2O Bi+4HNO3(р) = Bi(NO3)3+NO+2H2O
4. Sb и Bi могут реагировать с HCl(конц) в присутствии окислителя:
2Sb+12HCl+3H2O2 = 2H3[SbCl6]+6H2O.
5. При комнатной температуре As, Sb и Bi реагируют только с галогенами, образуя тригалогениды(ЭГ3), а в случае сурьмы и пентагалогениды(ЭГ5).
Сульфиды мышьяка, сурьмы и висмута: их отношение к кислотам и к раствору сульфида аммония. Тиокислоты и их соли.
Сульфиды: (Э2S3 и Э2S5)
2As+3S = As2S3 2Na3AsO4+6HCl+5H2S = As2S5↓+6NaCl+8H2O (HCl -для сильно кислой среды)
Bi2S3 – сульфид, остальные соединения – тиоангидриды. Имеют очень маленькие значения ПР, нерастворимы в мин. кислотах. Эти соед. можно перевести в растворимое состояние либо действием кислот-окислителей, например:
Sb2S3+28HNO3(к) = Sb2O5+28NO2+3H2SO4+11H2O Bi2S3+24HNO3(к) = Bi2(SO4)3+ 24NO2 +12H2O
Либо в щ. растворах:
Sb2S3+6KOH = K3SbS3+K3SbO3+3H2O Sb2S5+8KOH = K3SbS4+K3SbO4+K2S+4H2O Sb2S5+16KOH = 2K3SbO4+5K2S+8H2O
Сульфиды As, Sb и Bi проявляют некоторую аналогию свойств с оксидами тех же элементов. Подобно тому, как оксиды As и Sb при взаимод. со щелочами дают соли кислот Н3ЭО3 или Н3ЭО4, сернистые их производные обр. с растворимыми сульфидами Ме соли соответствующих тиокислот (аналог для сульфида сурьмы)
3(NH4)2S+As2S3 = 2(NH4)3AsS3 и 3(NH4)2S+As2S5 = 2(NH4)3AsS4
Bi2S3 с растворимыми сернистыми солями практически не реагирует. Сульфид этот, следовательно, ведёт себя аналогично почти нерастворимому в щелочах оксиду (Bi2O3).
Галогениды мышьяка, сурьмы и висмута: их получение и гидролиз. Тиокислоты и тиосоли.
![]()
![]()
Галогениды:
Галогениды As, Sb и Bi легко образуются при прямом взаимодействии элементов. Галогениды типа ЭГ3 известны для всех рассм-ых эл-в и Hal, галогениды типа ЭГ5 более или менее устойчивы лишь производные фтора и SbCl5.
Галогениды ЭГ3 и ЭГ5 сильно гидролизованы в водных растворах; AsCl3 и SbCl5 – практически нацело:
AsCl3+2H2O = HAsO2+3HCl 2SbCl5+5H2O = Sb2O5+10HCl
Галогениды Sb(III) и соли Bi(III) подвергаются гидролизу с образованием малорастворимых оксосолей:
SbCl3+H2O = SbOCl↓(хлористый антимонил)+2HCl Bi(NO3)3+H2O = BiONO3↓(нитрат висмутила) +2HNO3
BiI3 растворим в избытке йодида, при этом образуется непрочный комплекс, разрушаемый даже разбавлением раствора:
BiI3+KI(изб) = K[BiI4]
Ион Bi3+ способен в растворе восстанавливаться до металла:
3K2[Sn(OH)4]+2Bi(NO3)3+6KOH = 3K2[Sn(OH)6]+2Bi↓+6KNO3
Пероксид водорода:
Получение кислорода и пероксида водорода в промышленности и в лаборатории.
Промышленные способы получения молекулярного кислорода: перегонка жидкого воздуха, электролиз воды (точнее щелочного раствора).
Возможные лабораторные способы получения O2:
2KClO3 = 2KCl+3O2 (t, MnO2) 2H2O2 = 2H2O+O2 (кат) 2KMnO4 = K2MnO4+MnO2+O2 (t)
Получения пероксида водорода:
Лаборатория:
BaO2+H2SO4 = BASO4↓+H2O2
Промышленность:
2H2SO4 = H2S2O8+H2 (эл. ток) H2S2O8+2H2O = 2H2SO4+H2O2
Реакции пероксида водорода в роли окислителя и восстановителя.
Окислительные свойства у H2O2 выражены сильнее, чем восстановительные:
3H2O2+I2 = 2HIO3+3H2O Na2SO3+H2O2 = Na2SO4+H2O Mn(OH)2+H2O2 = MnO2+2H2O
В качестве окислителя используется концентрированный раствор H2O2, разбавленный же раствор выступает в качестве восстановителя, особенно в присутствии серьезных окислителей, например:
2K2FeO4+3H2O2+5H2SO4 = Fe2(SO4)3+2K2SO4+3O2+8H2O 2KMnO4+5H2O2+3H2SO4 = 2MnSO4+K2SO4+5O2+8H2O 2AgNO3+H2O2 = 2Ag+O2+2HNO3
А, селен и теллур (IVA):`
Общая характеристика и химические свойства серы, селена и теллура.
Сера находится в земной коре в самородном виде, в виде сульфидов металлов (FeS2, ZnS, PbS, Cu2S), сульфатов металлов (Na2SO4*10H2O, CaSO4*2H2O).
Вал. возможности атома серы по методу ВС составляют 2, 4, 6; с.о. в соединениях -2, +2, +4,+6. Соединения серы с.о. +2 крайне неустойчивы, а соед. С.О. +4 проявляют преимущественно восстановительные св-ва.
Химические свойства:
1. При небольшом нагреве, сера – достаточно хим. активное в-во:
S+O2 = SO2 (t) S+3F2 = SF6 2S+C = CS2
2. При незначительном нагреве порошки серы и металлов спекаются, образуя сульфиды (ZnS, Al2S3, K2S).
S+Ме = МеS S+6HNO3(к) = H2SO4+6NO2+2H2O (t) S+2H2SO4(к) = 3SO2+2H2O (t) 3S+6KOH = 2K2S+K2SO3+3H2O (t)
3. При переходе от S к Se и Te увеличивается склонность к проявлению нулевой степени окисления.
4. Se при нагревании, а Te при комн. темп. реагируют с водой:
Э+2Н2О = ЭО2+2Н2
5. При сгорании Se и Te образуются оксиды ЭО2.
6. Н2Se и H2Te получают обработкой селенидов и теллуридов растворами минеральных кислот:
MgЭ+H2SO4 = MgSO4+H2Э
Получение и свойства сероводорода. Растворимость и гидролиз сульфидов. Отношение сульфидов к кислотам.
Получение Н2S:
Действие минеральных кислот на сульфиды:
CaS+2HCl = H2S+CaC12
Химические свойства:
1. Окисление в условиях избытка кислорода:
2H2S+3O2 = 2SO2+2H2O;
2. Окисление в условиях недостатка кислорода:
2H2S+O2 = 2S+2H2O;
3. Сероводород в окислительно – восстановительных процессах проявляет восстановительные свойства, окисляясь, как правило, до S:
5H2S+2KMnO4+3H2SO4 = 5S+2MnSO4+K2SO4+8H2O
5. Кислые сульфиды очень растворимы в воде. Нейтральные сульфиды щелочноземельных металлов как таковые в воде не растворяются. Но при действии воды происходит гидролитическое расщепление:
2CaS+2HOH = Ca(HS)2+Ca(OH)2
6. Поэтому растворы сульфидов имеют характерный запах сероводорода. Сульфиды Fe(III) , Al(III), Cr(III) и др. катионов М3+:
2AlCl3+3K2S+6H2O = 2Al(OH)3↓+3H2S↑+6KCl
7. Сульфиды в окислительно – восстановительных процессах проявляют восстановительные свойства, окисляясь, как правило, до S:
3K2S+K2Cr2O7+4H2SO4 = 3S+Cr2(SO4)3+4K2SO4+7H2O
8. В обычных условиях только HNO3(конц) способна окислить сульфиды до иона SO42-(до S+6):
FeS+6HNO3(к) = Fe(NO3)3+H2SO4+2H2O+3NO
Кислородсодержащие кислоты серы, селена и теллура: получение, кислотно-основные и окислительно-восстановительные свойства.
H2SeO4 (селеновая к-та) и H6TeO6 (H2TeO4, теллуровая к-та) получаются при окислении соединений + 4 сильными окислителями:
H2SeO3+H2O2(к) = H2SeO4+H2O
5TeO2+2KMnO4+6HNO3+12Н2О = 5H6TeO6+2KNO3+2Mn(NO3)2
Селеновая кислота по силе практически равна серной, теллуровая – очень слабая к-та. Соли селеновой к-ты похожи на сульфаты, соли теллуровой – существенно от них отличаются.
И селеновая и теллуровая кислоты являются весьма сильными окислителями. H2SeO4 кинетически более сильный окислитель, чем серная:
H2SeO4+6HI = 3I2+Se/(SeO2)+4H2O 2Au+6H2SeO4 = Au2(SeO4)3+3H2SeO3/(SeO2)+3H2O
Обезвоживанием селеновой и теллуровой кислот можно получить соединения ЭО3. SeO3 похож на SO3, легко растворяется в воде, а TeO3 малорастворим в воде.
В ряду кислот H2SO3-H2SeO3-H2TeO3 отмечается усиление окислительной активности (падение восстановительной способности), падение силы кислот.
Взаимодействие металлов с серной кислотой.
Взаимодействие серной кислоты с металлами проходит различно в зависимости от ее концентрации. Разбавленная серная кислота окисляет своим ионом водорода. Из-за этого она взаимодействует только с теми металлами, которые стоят в ряду напряжений до водорода, например:
Zn+H2SO4 = ZnSO4+H2.
Но свинец не растворяется в разбавленной кислоте, поскольку образующаяся соль PbSO4 нерастворима.
При взаимодействии с малоактивными металлами, например, с медью, кислота восстанавливается до SO2:
Cu+2H2SO4 = CuSO4+SO2+2H2O.
При взаимодействии с более активными металлами продуктами восстановления могут быть как SO2, так и свободная сера и сероводород. Так, при взаимодействии с цинком могут протекать реакции:
Zn+2H2SO4 = ZnSO4+SO2+2H2O 3Zn+4H2SO4 = 3ZnSO4+S+4H2O 4Zn+5H2SO4 = 4ZnSO4+H2S+4H2O.
Получение серной кислоты и сероводорода в промышленности.
Стадии производства серной кислоты:
1. Обжиг сульфидов:
4FeS2+11O2 = 2Fe2O3+8SO2 (t)
2. Каталитическое окисление SO2 (контактный метод):
2SO2+O2 = 2SO3 (V2O5, t)
Или окисление диоксидом азота (нитрозный метод):
SO2+NO2 = SO3+NO
3. Поглощение SO3
SO3+H2O = H2SO4
В промышленности сероводород получают как побочный продукт при очистке нефти, природного и промышленного газов.
Взаимодействие неметаллов с концентрированными серной и азотной кислотами.
Концентрированные серная и азотная кислоты являются сильными окислителями. В азотной кислоте окислителем служит азот в степени окисления +5, в серной кислоте – сера в степени окисления +6.
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
S+6HNO3(к) = H2SO4+6NO2(г)+2H2O 3P+5HNO3(к)+2H2O = 3H3PO4+5NO(г)
Концентрированная серная кислота очень активно взаимодействует с неметаллами.
С+2Н2SO4(к) = СО2+2SO2+2Н2О S+2 Н2SO4(к) = 3SO2+2Н2О
Концентрированная серная кислота окисляет бромид — и иодид-ионы до свободных брома и иода:
2КВг+2Н2SO4(к) = К2SО4+SO2+Вr2+2Н2О 2КI+2Н2SО4(к) = К2SO4+SO2+I2+2 Н2О
Концентрированная серная кислота не может окислить хлорид-ионы до свободного хлора, что дает возможность получать НСl по реакции двойного обмена:
NаСl+Н2SO4(к) = NаНSO4+НСl
Получение водорода в промышленности:
Промышленное получение водорода
C+H2O = CO+H2 (t) CH4+H2O = CO+3H2 (t,кат) 2CH4+O2 = 2CO+4H2 (t,кат) 2H2O = 2H2+O2 (электролиз)
Галогены (VIIA):
Общая характеристика и химические свойства галогенов.
В природе галогены встречаются в виде соединений с металлами:
Хлориды, бромиды и йодиды в больших количествах присутствуют в воде морей и океанов. при комн температуре F2 и Cl2 – газы, Br2 – жидкость , I2 – кристал вещество.
Химические свойства:
Вал. возможность атомов: -у фтора – 1, у остальных – 1,3,5,7. -с.о. у фтора только -1, у остальных -1, +1, +3, +5, +7.
Фтор - самый реакционноспособный элемент т. к. у него самая высокая электроотрицательность, маленький размер атома, отсутствуют d-орбитали. при t комн. фтор реагирует со всеми простыми веществами, кроме O2, N2, He, Ne и Ar.
1. В атмосфере фтора воспламеняется большинство порошкообразных металлов и неме, например:
Ag+F2 = AgF2 2Fe+F2 = 2FeF3 P4+10F2 = 4PF5
2. Реагирует фтор со сложными вещ-ми, простым и кварцевым стеклом:
SiO2+2F2 = SiF4+O2
3. Если остальные галогены растворить в воде и слабо взаимодействовать с ней, то фтор энергично реагирует с водой
2F2+H2O =OF2+2HF 2F2+2H2O = 4HF+O2
Как уже отмечалось, остальные галогены растворяются в воде, их растворимость понижается в ряду Cl2-Br2-I2.
4. В этом же ряду ослабевает взаимод Hal2 с молекулами воды по ур-ю:
Hal2(р-р)+H2O = H(+)+Hal(-)+HOHal (обратимая)
5. При растворении Hal2 в р-рах щелочей равновесие смещается вправо:
Hal2+2NaOH = NaOHal+H2O
6. В горячей воде молекулы HOHal, получающиеся за счет взаимодействия Hal2 с холодной водой, диспропорционируют, и суммарный процесс описывает уравнение: Ффф
3Hal2+3H2O = HHalO3+5HHal (t, обратимая) 3Hal2+6KOH = KHalO3+5KHal+3H2O (t)
Реакционная способность галогенов резко ослабевает от F к I. В реальной практике предпочитают использовать именно бром в качестве окислителя, т.к. Br2 – ж, а Cl2- г при н.у.
Получение хлора, брома и хлората калия в промышленности.
2KCl+2H2O = 2KOH+H2+Cl2 (электролиз) 2NaBr +Cl2 = Br2+2KCl Cl2+2KOH = KClO+KCl+H2O 3KClO = KClO3+2KCl
Водородные соединения галогенов: получение и свойства.
HF(г) и HCl(г) получают действуя на крист-ие фториды и хлориды конц серной:
CaF2кр+H2SO4(к) = CaSO4+2HF NaCl кр+H2SO4(к) = NaHSO4+HCl
Получение HBr(г) и HI(г) в подобных условиях невозможно из-за окисления получающихся галогеноводородов концентрированной серной, наиболее распространенные способы получения бромоводорода, йодоводорода – гидролиз галогенангидридов, например:
PBr3+3H2O = H3PO4+3HBr I2+H2S = S+2HI BaI2+H2SO4 = BaSO4+2HI
HF - газ, наименее приближенный к идеальному; HF - жидкость похож на воду (имеет электропроводность близкую к электропр. воды)
в ряду HF – HCl - HBr – HI снижается термодинамич. устойчивость соединений, резко уменьшается термическая устойчивость, возрастает восс-ая активность и увелич. сила кислот в водном р-ре
Ассоциация молекул фтороводорода. Дифторид калия.
В водном растворе HF, называется плавиковой кислотой, отмечается сильная межмолекулярная ассоциация, приводящая к тому, что основная форма существования частиц в растворе – димеры (HF)2. При нейтрализации плавиковой к-ы щелочью обр-ся гидрофториды:
2HF+KOH = KHF2+H2O, и лишь при избытке щелочи достигается полная нейтрализация
Бифторид калия представляет собой неорганическое соединение с формулой KHF 2.
2HF+KOH = KHF2+H 2 O 2HF+KHF 2 = KH2F 3
Окислительное действие хлора и брома в щелочной среде.
При взаимодействии хлора с холодными растворами щелочей образуются соответствующие соли этих кислот:
С12+2NaOН = NaС1+NaClО+Н2О
Полученные растворы называются жавелевой водой, которая, как и хлорная вода, обладает сильными окислительными свойствами благодаря наличию иона ClO и применяется для отбеливания тканей и бумаги. С горячими растворами щелочей хлор образует соответствующие соли соляной и хлорноватой кислот:
3С12+6NаОН = 5NаСl+NаС1O3+3Н2О, NаС1O3 - бертолетова соль.
При растворении брома в растворе щелочи на холоду образуются соли кислот:
Вr2+2NаОН = NaBr+NаВrО+Н2О
С горячими растворами:
3Вr2+6NаОН = 5NaBr+NаВrО3+3Н2О
Оксиды хлора и иода: получение и свойства.
Cl2O:
Получение:
Удобным лабораторным методом получения Cl2O явл р-я:
2HgO+2Cl2 = HgO*HgCl2+Cl2O
Химические свойства:
При н.у Cl2O-красновато-желтый газ, полярная уголковая молекула:
Cl2O+H2O = 2HOCl
ClO2:
Получение:
Больший интерес представляет ClO2, можно получить:
3KClO3+3H2SO4 = 3KHSO4+2ClO2+HClO4+H2O 2NaClO3+SO2+H2SO4 = 2ClO2+2NaHSO4 (промышленный) 2KClO3+H2C2O4+H2SO4 = K2SO4+2CO2+2ClO2+2H2O
Химические свойства:
1. ClO2 – бурый газ, молекула полярна и парамагнитна, имеет уголковое строение, формально является ангидридом двух кислот:
2ClO2+2NaOH = NaClO2+NaClO3+H2O
2. Реагирует с водой:
6ClO2+2H2O = HCl+5HClO3
3. А также:
5P4+20ClO2 = 4P4O10+4PCl5
Cl2O6:
Получение:
Cl2O6 – красноватая жидкость, образуется в реакции:
2ClO2+2O3 = Cl2O6+2O2
Химические свойства:
Также может рассматриваться как смешанный ангидрид, поскольку в р-ре идет след процесс:
Cl2O6+2NaOH = NaClO3+NaClO4+H2O
Cl2O7:
Наиболее стабильным кислородным соед хлора явл Cl2O7 – ангидрид хлорной кистоты, бесцветная маслянистая жидкость.
Получение:
Получается при обезвоживании хлорной к-ты P4O10. Молекула представляет собой два тетраэдра:
12HClO4+P4O10 = 4H3PO4+6Cl2O7
Cl2O8:
Получение:
Пероксидное соед. Cl2O8 можно получить:
2AgClO4+I2 = Cl2O8+2AgI
Соед. нестабильно, сильный окислитель
Все оксиды хлора могут взрываться!
I2O5:
Получение:
I2O5 –бесцветные кристаллы, получаются при термич разложении:
2HIO3 = I2O5+H2O (250С)
Химические свойства:
I2O5 термически устойчив до 300 градусов. проявл окисл-е св-ва, исполь-ся для обнаружения CO:
I2O5+5CO = 5CO2+I2
I2O4 и I4O9 предст-т собой солеподобные соед-я:
I2O4 = (IO)IO3 - йодат йодила I4O9 = I(IO3)3 - йодат йода (3)
Сопоставление кислотно-основных и окислительно-восстановительных свойств кислородсодержащих кислот галогенов.
1. HOCl, HOBr, HOI - малостабильные соединения, известны только в водных р-рах, слабые электролиты, хорошие ок-ли в кислых средах:
2HOCl = 2HCl+O2 (hv) 2HOCl = Cl2O+H2O (CuCl2,безвод) 3HOCl = HClO3+2HCl (t)
HOCl-HOBr-HOI окислительная активность и сила кислот ослабевает
2. Из кислот HHalO2 известна лишь хлористая HClO2 (хлорит), устойчива в водных р-рах:
BaO2+2ClO2 = Ba(ClO2)2+O2 Ba(ClO2)2+H2SO4 = BaSO4+2HClO2
3. Кислоты HHalО3 (галогенноватые) известны все, варианты получения:
2NaClO3+H2SO4 = Na2SO4+2HClO3 Br2+5Cl2+6H2O = 2HBrO3+10HCl I2+5H2O2 = 2HIO3+4H2O 3Hal2+6КОН= 5КHal+КHalО3+3Н2О (t) 3MeOHal= 2МеHal+МеHalО3 (t)
4. Все кислоты HHalО3 - активные окислители:
2НIO3+5H2C2O4 = I2+10CO2+6H2O HIO3+5HI = 3I2+3H2O
В ряду HClO3-HBrO3-HIO3 падение силы кислот и ослабление окисл активности
5. Кислоты высшей с.о. (+7) - HClO4 - назалогенные кислоты:
Cl2O7+H2O = 2HClO4 (на холоду) КClO4+H2SO4 = KHSO4+HClO4 NaBrO3+F2 +2NaOH = NaBrO4+2NaF+H2O I2+7MnO2+7H2SO4 = 2HIO4+7MnSO4+6H2O
Получение и гидролиз галогенангидридов.
При гидролизе галогенангидридов образуются две кислоты — кислородсодержащая и галогеноводородная; р-ция в большинстве случаев идет необратимо:
PCl3+3H2O = H3PO3+HCl BF3+3H2O = H3BO3+3HF
Фториды ксенона:
Фториды ксенона: получение, строение молекул и химические свойства.
Фториды ксенона:
Получение:
Xe+PtF6 = Xe[PtF6] Xe+F2 = (XeF2;XeF4;XeF6) в зависимости от соотношений t и p XeF6+BF3 = XeF6*BF3 XeF2+2SbF5 = Xe[SbF6]2 XeF6+CsF = Cs[XeF7]
Химические свойства:
1. Гидролиз:
2XeF2+2H2O = O2+2Xe+4HF XeF4+2H2O = O2+Xe+4HF XeF6+H2O = XeOF4+2HF XeOF4+H2O = XeO2F2+2HF XeO2F2+H2O = XeO3+2HF
2. Реакции присоединения:
XeF2+2SbF5 = Xe[SbF6]2 XeF6+CsF = Cs[XeF7]
3. Реакции диспропорционирования:
3XeF4 = 2XeF6 + Xe (H2O) 3XeF6 = XeF2+2XeF8 (t)
Получающийся при полном гидролизе XeF6 кристаллический XeO3 чрезвычайно легко и мощно взрывается.
Ксенаты:
Получение:
XeO3+KOH = KHXeO4 XeO3+3Ba(OH)2 = Ba3XeO6+3H2O
Перксенаты:
2KHXeO4+2KOH = K4XeO6+Xe+O2+2H2O
Медь, серебро и золото (IB):
Общая характеристика и химические свойства меди, серебра, золота.
Природные источники и получение:
Медные соединения преимущественно представлены сульфидами : Cu2S-халькозин, CuFeS2-халькопирит, также представляет интерес для переработки Cu2(OH)2CO3-малахит.
2Cu2S+3O2 = 2Cu2O+2SO2 Cu2O+Cu2S = 6Cu+SO2
Серебро также встречается в виде сульфидов, например, Ag2S-аргентит.
4Ag+O2+8NaCN+2H2O = 4Na[Ag(CN)2]+4NaOH 2Na[Ag(CN)2]+Zn = Na2[Zn(CN)4]+2Ag
Золото в основном представлено в природе в самородном виде. Au получают амальгамированием или цианидным способом(метод П.Р.Багратиона):
4Au+8KCN+O2+2H2O = 4K[Au(CN)2]+4KOH 2K[Au(CN)2+Zn = K2[Zn(CN)4]+2Au
Химические свойства:
В атомах элементов Сu, Ag, Au происходит «провал» s-электрона, приводящий к полному заполнению электронами d-орбиталей. Благодаря наличию одного s-электрона во внешнем слое для этих элементов характерна степень окисления +1. Кроме того возможны с.о. +2, +3 для меди,+2 для серебра, +3, +5 для золота. Эти металлы обладают наивысшей тепло- и электропроводностью, ковки и пластичны.
1. Не реагируют с водой и не вытесняют водород из растворов минеральных кислот, т.к. электродные потенциалы этих металлов имеют положительные значения. Пассивны при комнатной температуре, наибольшей активностью отличается медь.
Cu+4HNO3(к) = Cu(NO3)2+2NO2+2H2O 3Cu+8HNO3(р) = 3Cu(NO3)2+2NO+4H2O Cu+2H2SO4(к) = CuSO4+SO2 +2H2O Ag+2HNO3(к) = AgNO3+NO2+H2O 2Ag+2H2SO4(к) = Ag2SO4+SO2+2H2O (t) 3Ag+4HNO3(р) = 3AgNO3+NO+2H2O
Au же нерастворимо в них, лучшим кислотным растворителем для Au является царская водка:
Au+HNO3+4HCl = H[AuCl4]+NO+2H2O или 2Au+2HCl+3Cl2 = 2H[AuCl4] 2Au+6H2SeO4(к) = Au2(SeO4)3+3H2SeO3+3H2O 2Ag(Cu)+H2S(г) = Ag2S(Cu2S)+H2
Соединения:
Черный CuO:
2Cu+O2 = 2CuO (t) 2Cu(NO3)2 = 2CuO+4 NO2+O2 (t) Cu2(OH)2CO3= 2CuO+CO2+H2O (t)
Красный Cu2O:
4CuSO4+8NaOH+N2H4 = N2+2Cu2O+4Na2SO4+6H2O
Оба оксида проявляют основные свойства, у CuO отмечается слабая амфотерность:
CuO+2NaOH = Na2CuO2+H2O (сплавление) Cu2O+4NH3+H2O = 2[Cu(NH3)2]OH CuO+4NH3+H2O = 2[Cu(NH3)4](OH)2
При приливании растворов щелочей к солям меди +2 осаждается Сu(OH)2:
Сu(OH)2+2NaOH = Na2Cu2O+2H2O Cu(OH)2 = CuO+H2O (t)
Au(OH)3 – золотисто-желтый:
AuCl3+3KOH = Au(OH)3+3KCl Au(OH)3 =50-100С= AuO(OH)+H2O 2AuO(OH) =150C= Au2O3+H2O Au(OH)3+KOH = K[Au(OH)4] Au(OH)3+4HCl = H[AuCl4] + 3H2O Au2O3 = Au+Au2O+O2 (150C)
Cu+CuCl2+2HCl = 2H[CuCl2] CuCl+NaCl(изб) = Na[CuCl2] CuCl2+2NH3(изб) = [Cu(NH3)2]Cl 2CuSO4+KI = 2K2SO4+2CuI+I2 CuSO4+4KCN(изб) =K2[Cu(CN)4]+K2SO4 2CuSO4+4KCN = 2CuCN+2K2SO4+(CN)2
Соли Cu(+2) сильно гидролизованы:
2CuSO4+2K2CO3+H2O = Cu2(OH)2CO3+2K2SO4+CO2
Соли Ag(+1) практически не гидролизованы, растворимые соли серебра единичны.
AgF-AgCl-AgBr-AgI растворимость уменьшается
AgCl+NaCl(изб) = Na[AgCl2] AgCl+2NH3(изб) = [Ag(NH3)2]Cl AgBr+2NH3(изб) = [Ag(NH3)2]Br
AgI уже не растворяется в водном растворе аммиака
AgHal+2Na2S2O3(изб) = Na3[Ag(S2O3)2]+NaHal 2AgF2 = 2AgF+2 (t) 4AgF2+2H2O = 4AgF+4HF+O2
H[AuCl4] – золотохлористоводородная к-та:
2H[AuCl4]+3SnCl2 = 3SnCl4+2Au+2HCl 2Au+KrF2=HF(ж) = 2AuF5+5Kr 2Au+5KrF2+2KF = 2K[AuF6]+5 Kr (HF(ж))
Цинк, кадмий, ртуть (IIB):
Общая характеристика и химические свойства элементов подгруппы цинка.
В соединениях в основном проявляют степень окисления +2, электроны характеризуются d10-конфигурацией. Исключение проявляют производные иона Hg22+, который формально проявляет степень окисления +1. Для комплексных соединений более характерно КЧ4, однако для кадмия характерно образование соединений с КЧ6.
Получение:
Цинк добывают из сульфидных руд:
2ZnS+3O2 = 2ZnO+3SO2 2ZnO+C = 2Zn+CO2
Кадмий получают из побочных продуктов переработки цинковых, свинцово-цинковых и медно-цинковых руд. Эти продукты (содержащие 0,2-7% кадмия) обрабатывают разбавленной серной кислотой, которая растворяет оксиды кадмия и цинка. Из раствора осаждают кадмий цинковой пылью. Губчатый осадок (смесь кадмия и цинка) растворяют в разбавленной серной кислоте и выделяют кадмий электролизом этого раствора. Электролитический кадмий переплавляют под слоем едкого натра и отливают в палочки; чистота металла - не менее 99,98%.
Ртуть добывают относительно прямым способом:
HgS+O2 = Hg+SO2.
Цинк и кадмий довольно похожи, а ртуть несколько отличается.
1. Цинк и кадмий при нагревании взаимодействуют с кислородом, серой, фосфором и галогенами; ртуть не взаимодействует с фосфором. Ни один из металлов не реагирует с водородом, углеродом и азотом.
2. Сплавы ртути с другими металлами – амальгамы, являются мягкими восстановителями:
2NaHg+2H2O = 2Hg+2NaOH+H2
3. Цинк – более сильный восстановитель, чем кадмий:
Zn0+Cd2+ = Zn2++Cd0
4. С разбавленными кислотами:
Zn+H2SO4(разб) = ZnSO4+H2
5. С кислотами-окислителями:
Zn+4HNO3(конц,гор) = Zn(NO3)2+2NO2+2H2O 4Zn+10HNO3(разб,гор) = 4Zn(NO3)2+N2O+5H2O
6. Ртуть не взаимодействует с разбавленными кислотами, но с концентрированными:
Hg+4HNO3(конц) = Hg(NO3)2+2NO2+2H2O Hg+2H2SO4(конц,гор) = HgSO4+SO2+2 H2O
7. Разбавленная азотная образует динитрат ртути:
6Hg+8HNO3 = 3Hg2(NO3)2+2NO+4H2O
8. Цинк – единственный представитель группы, который растворяется в водн. р-рах щелочей с образованием комплексов:
Zn+2OH-+2H2O = [Zn(OH)4]2-+H2 Zn+4NH3*H2O=[Zn(NH3)4](OH)2+2H2O+H2.
Соли цинка, кадмия и ртути, их гидролиз. Амидные соединения ртути. Соединeния Hg2+: получение и свойства.
Сульфиды цинка, кадмия и ртути малорастворимы. Сфалерит ZnS – главный источник цинка. Легко растворяется в кислотах с выделением сероводорода:
ZnS+H2SO4 = ZnSO4+H2S
Сульфид кадмия более устойчив, выпадает в осадок даже в кислой среде, устойчив к действию растворов щелочей и большинства кислот. Сульфид кадмия получают:
CdSO4+BaS = CdS+BaSO4 (камподон – смесь сульфата бария и сульфида кадмия)
Сульфид ртути растворяется только в царской водке:
3HgS+8HNO3+6HCl = 3HgCl2+3H2SO4+8NO+4H2O
Химические свойства:
1. Галогениды – известны все галогениды элементов этой подгруппы, а также 4 галогенида диртути.
2HgCl2+[SnCl3]-+Cl- = Hg2Cl2+[SnCl6]2-
2. Для цинка и кадмия наиболее характерны тетраэдрические комплексы.
Zn(OH)2+4NH3*H2O = [Zn(NH3)4](OH)2+4H2O,
3. Для кадмия и октаэдрические:
Cd(OH)2+6NH3*H2O = [Cd(NH3)6](OH)2+6H2O.
4. Соли ртути в водной среде осаждаются в виде основных солей:
Hg(NO3)+H2O = Hg(OH)(NO3)+HNO3
5. При поджигании Hg(SCN)2 –«фараоновы змеи»
2Hg(SCN)2 = 2HgS+C3N2+CS2+N2
6. Реактив Несслера – крайне чувствительный реагент на аммиак:
2K2[HgI4]+3KOH+NH3 = Hg2NI*H2O+7KI+2H2O – иодидная соль основания Миллона ([Hg2N(OH)*(H2O)2).
7. Ртуть образовывает прямые связи с азотом:
HgCl2+2NH3 = (HgNH2)Cl+NH4Cl неплавкий белый преципитат
При избытке NH4+:
HgCl2+2NH3 = [Hg(NH3)2)Cl 2]. плавкий белый преципитат
Соединения Hg2+:
Получение:
1. Взаимодействием хлорида ртути(II) и металлической ртути при высокой температуре
HgCl2+Hg = Hg2Cl2
2. Взаимодействием хлорида ртути(II) с цианидом ртути(II):
HgCl2+Hg(CN)2 = Hg2Cl2+C2N2
Химические свойства:
1. Катион диртути в водном растворе диспропорционирует:
Hg22+ = Hg+Hg2+ Hg22++2OH- = HgO+Hg+H2O Hg22++S2- = HgS+Hg
2. Большинство солей нерастворимы. ОВР с сильными окислителями и восстановителями
Hg2(NO3)2+4 HNO3 = 2Hg(NO3)2+2NO+2H2O Hg2Cl2+SnCl2+Cl = 2Hg+H2[SnCl6]
3. Гидролиз солей:
ZnSO4+2H2O = Zn(OH)2+H2SO4 Cd(CN)2+2H2O = Cd(OH)2+HCN
4. От солей цинка к солям ртути гидролиз ослабевает, соли ртути очень слабо диссоциированы.
Т.к. Hg(OH)2 не существует, то при гидролизе:
2Hg(NO3)2+H2O = Hg2O(NO3)2+2HNO3
5. Только для ртути известны амидные соединения, содержащие связь Hg—N устойчивые в водной среде (другие металлы образуют подобные соединения лишь в неводных растворах).
Для Hg(II):
HgCl2+2NH4OH = [HgNH2]Cl2↓+NH4Cl+2H2
Для Hg (I):
Hg2Cl2+2NH3 = [HgNH2]Cl↓+NH4Cl+Hg↓
Хром, молибден, вольфрам (VIB):
Общая характеристика и химические свойства хрома, молибдена и вольфрама.
Cr, Mo и W - серебристо-белые тугоплавкие металлы, при комн. температуре пассивны из за поверхностной пленки. С.О. атомов в соединениях:+2,+3,+4,+5,+6; четко прослеживается тенденция изменения свойств соединений по группе: при переходе от Сr к W увел-ся стабильность соед-й высшей с.о.
В минеральных кислотах медленно растворяется лишь Cr, а Мо и W-нет:
Cr+ 2HCl = CrCl2+H2 Cr+H2SO4 = CrSO4+H2.
Mo и W можно перевести в р-р только лишь при использовании серьёзных окислителей:
Mo+HNO3(конц) = H2MoO4+2NO W+6HF+2HNO3 = WF6+2NO+4H2O Cr/Mo/W+O2 = Cr2O3/MoO3/WO3 (t)
Соединения хрома ( II и III ): получение и свойства.
Соединения Cr(II):
![]()
![]()
![]()
Сr(II) восст-ет воду (медленно):
2CrCl2+2H2O = 2Cr(OH)Cl2+H2.
Характеризуя химические свойства Cr(III) можно отметить большое сходство этих соединений с аналогичными соединениями Al(III):
Cr2O3+6HCl = 2CrCl3+3H2O Cr2O3+3H2O+6NaOH(изб) = 2Na3[Cr(OH)6] 2Cr(OH)3+3H2SO4 = Cr2(SO4)3+3H2O
Получение Cr(III):
2Cr(NO3)3 = Cr2O3+6NO2+3/2O2 (t) 2Cr(OH)3 = Cr2O3+3H2O (t)
Реакции хромата (дихромата) калия с восстановителями в кислой, нейтральной и щелочной средах.
4K2Cr2O7+3H2S+6KOH = 3K2SO4+8KCrO2+6H2O 8K2CrO4+3H2S+14KOH = 8K3CrO3+10H2O+3K2SO4 K2Cr2O7+3H2S+4H2SO4 = K2SO4+Cr2(SO4)3+3S+7H2O 3H2S+K2Cr2O7+H2O = 2Cr(OH)3+3S+2KOH (Последние 2 реакции для K2CrO4 так же)
Хромовый ангидрид, хроматы и дихроматы: получение и химические свойства. Хромовая смесь.
Хромовый ангидрид CrO3:
K2Cr2O7+2H2SO4 = 2CrO3+2KHSO4+H2O
Оксид хрома (VI) - сильный окислитель, одно из самых токсичных соединений хрома.
CrO3+H2O = H2CrO4
CrO3, реагируя со щелочами, образует желтые хроматы CrO4(2-):
CrO3+2KOH = K2CrO4+H2O
Хроматы:
Получение:
CrO3+ZnO = ZnCrO4 2KCrO2+3H2O2+2KOH = 2K2CrO4+4H2O
Химические свойства:
Хромат-ион при подкислении переходит в дихромат-ион:
2CrO4(2-)+2H(+) = 2HCrO4(-)=Cr2O7(-)+H2O.
Хроматы устойчивы в нейтральной и щелочной среде, а дихроматы — в кислой.
Дихроматы:
Получение:
![]()
![]()
Химические свойства:
1. Дихроматы, как и хроматы, в кислой среде являются сильными окислителями:
K2Cr2O7+14HCl = 2KCl+2CrCl3+3Cl2+7H2O
2. Во время сильного нагревания:
2K2Cr2O7 = 4KCrO2+ 3O2 (t)
Хромовая смесь:
Хромовая смесь — смесь концентрированной серной кислоты и дихромата калия; при действии серной кислоты на бихромат образуется хромовый ангидрид CrO3. Хромовая смесь является одним из сильнейших окислителей.
K2Cr2O7+H2SO4 = K2SO4+2CrO3+H2O
Марганец, технеций и рений (VIIB):
Общая характеристика и химические свойства марганца, технеция и рения.
Получение:
MnO2+2C = 2СO+Mn 2KReO4+7H2 = 2KOH+2Re+6H2O
Tc может быть получен ядерным методом
Химические свойства:
При переходе от Mn к Re увеличивается устойчивость соединений с высшей С.О. и усиливается тенденция к образованию кислотных оксидов и кислот.
1. Mn сохраняет устойчивость благодаря защитной пленке Mn2O3.
Э+О2=MnO, Mn2O3, Mn3O4, Tc2O7, Re2O7 (t)
2. С водой эти Ме почти не реагируют.
Mn+2H+ = Mn2++H2 2Tc(Re)+7HNO3(конц.) = 3HTcO4/HReO4+7NO+2H2O Ме+Hal = MnF3, MnF4, MnCl2, MnBr2, ReCl5, ReF6 (t)
Легко образуют карбонилы Э2(СО)10
Соединения марганца ( II ): получение и свойства. Диоксид марганца, манганаты и перманганаты. Марганцовая кислота и ее ангидрид.
Соединения Mn(II):
Получение:
2MnO2+2H2SO4(70%) = 2MnSO4+O2+2H2O Mn+2HCl = MnCl2+H2
Химические свойства:
1. Гидроксид – сильное основание
MnCl2+2NaOH = Mn(OH)2+2NaCl Mn(OH)2+2CH3COOH = Mn(CH3COO)2+2H2O Mn(OH)2+2KOH (конц) = K2[Mn(OH)4]
2. Mn(II) окисляется в щелочной среде или при нагревании:
3MnSO4= Mn3O4+3SO2+O2 Mn(NO3)2= MnO2+2NO2 4Mn(OH)2+O2= 4MnO(OH)+2H2O
3. Сходство Mn2+ ↔ Mg2+:
Mn(OH)2(тв)+ 2NH4Cl(aq) = MnCl2+2NH3·H2O MnCl2+2NaHCO3= MnCO3+ 2NaCl+H2O+CO2 MnSO4+(NH4)2HPO4+NH3·H2O = NH4MnPO4·H2O↓+(NH4)2SO4
Диоксид марганца MnO2:
1. Демонстрирует амфотерность:
2 МnО2+4НNО3(конц) = 2Мn(NО3)2+2 Н2О+O2 (при кипячении) МnО2+4НСl = МnСl2+Сl2↑+2Н2О МnО2+2FеSO4+2Н2SO4 = МnSO4+Fе2(SO4)3+2Н2О MnO2+2H2SO4(конц) = Mn(SO4)2+2H2O MnO2+CaO = CaMnO3 MnO2+2KOH = K2MnO3+H2O
2. Соединения Mn+6(манганаты) получаются окислением соединений марганца более низких с.о. в щелочной среде:
MnO2+KNO3+2KOH = K2MnO4+KNO2+H2O MnSO4+2Br2+8KOH = K2MnO4+K2SO4+4H2O+4KBr
3. В растворе манганаты диспропорционируют:
3K2MnO4+2H2O = MnO2+2KMnO4+4KOH
4. Достаточно легко окисляются:
2K2MnO4+Cl2 = 2KMnO4+2KCl
Перманганат калия:
Получение:
MnO2+KNO3+2KOH = K2MnO4+KNO2+H2O 2K2MnO4+2H2O = 2KMnO4+2KOH+H2
Химические свойства:
2KMnO4 = K2MnO4+MnO2+O2 (t) 4KMnO4+H2O = 4MnO2+3O2+4KOH (t) 4KMnO4+4KOH = 4K2MnO4+O2+2H2O (t)
Марганцевая кислота
Получение:
Мn2O7+H2O = 2HMnO4(на холоде)
Химические свойства:
4HMnO4 = 4MnO2+3O2+2H2O (t) HMnO4+NaOH = NaMnO4+H2O HMnO4+NH3*H2O = NH4MnO4+H2O (<20C)
Кислота является сильным окислителем:
2HMnO4+14HCl = 2MnCl2+5Cl2+8H2O HMnO4+2(NH3*H2O) = 2MnO2+N2+6H2O (>20C)
Mn2O7
Получение:
2KMnO4+H2SO4(к) = Mn2O7+K2SO4+H2O
Химические свойства:
2Mn2O7 = 4MnO2+3O2 Mn2O7 = 2MnO2+O3 Mn2O7+H2O = 2HMnO4
Реакции перманганата калия с восстановителями в кислой, нейтральной и щелочной средах.
Cильный ок-ль в кислой среде, средней силы - в нейтральной среде и лишен окисляющего действия в щелочной среде.
2KMnO4+5Na2SO3+3H2SO4 = 2MnSO4+K2SO4+5Na2SO4+3H2O 2KMnO4+3Na2SO3+H2O = 2MnO2+3Na2SO4+2KOH 2KMnO4+Na2SO3+2NaOH = K2MnO4+Na2SO4+Na2MnO4+H2O
Железо, кобальт, никель (VIIIB):
Общая характеристика и химические свойства железа, кобальта и никеля.
В своих устойчивых соединениях, эти элементы проявляют степень окисления +2, +3. Для элементов триады (семейства) железа характерно свойство присоединять нейтральные молекулы, например, оксида углерода (II). Карбонилы Ni(CO)4, Fe(CO)5.
Кобальт и никель менее реакционноспособны, чем железо. При обычной температуре они устойчивы к коррозии на воздухе, в воде и в различных растворах.
Fe/Co+2HCl(р) = Fe/CoCl2+H2 Ni+2HCl(р) = NiCl2+H2 (t) Fe/Co+H2SO4(р) = Fe/CoSO4+H2 Ni+H2SO4(р) = NiSO4+H2 (t)
Наиболее устойчивыми являются соединения железа (III), кобальта (II) и никеля (II) – для них известны почти все соли.
Химические свойства Co, Ni:
1. Устойчивы к воде
2. Метагидроксиды способны окислять воду:
4MeO(OH)+2H2O = 4Me(OH)2+O2
3. При взаимодействии с кислотами метагидроксиды восстанавливаются до степени окисления +2:
2NiO(OH)+6HCl = 2NICl2+Cl2+4H2O
4. Некоторые соли кобальта сильные окислители:
4CoF3+2H2O = 4CoF2+O2 +4HF
2MeSO4 = 2MeO+2SO2+O2 (t) 2Me(NO3)2 = 2MeO+4NO2+O2 3Me+8HNO3 = 3Me(NO3)2+NO+4H2O
Химические свойства железа:
3Fe+3O2+6H2O = 4Fe(OH)3 2Fe+3Br2 = 2FeBr3 Fe+2HCl = FeCl2+H2 Fe+H2SO4 = FeSO4+H2 Fe+4HNO3(разб., гор.) = Fe(NO3)3+NO↑+2H2O
Концентрированные кислоты — окислители (HNO3, H2SO4) пассивируют железо на холоде, однако растворяют его при нагревании:
Fe+6HNO3(к) = Fe(NO3)3+3NO2+3H2O 2Fe+6H2SO4 = Fe2(SO4)3+3SO2 +6H2
При высокой температуре (700-900° С) железо реагирует с парaми воды:
3Fe+4H2O = Fe3O4+4H2
Накаленная железная проволока ярко горит в кислороде, образуя окалину — оксид железа (II, III):3Fe+2O2 = Fe3O4
При слабом нагревании железо взаимодействует с хлором и серой, а при высокой температуре — с углем, кремнием и фосфором.
FeO:
Черный легко окисляющийся порошок. Основный оксид
Получение:
Fe2O3+CO = 2FeO+CO2
Химические свойства:
FeO+2HCl = FeCl2+H2O FeO+4NaOH = Na4FeO3+2H2O (t)
Fe2O3:
Самое устойчивое природное кислородсодержащее соединение железа. Амфотерен.
Поучение:
Fe2(SO4)3 = Fe2O3+3SO3,
Химические свойства:
Fe2O3+6HCl = 2FeCl3+3H2O Fe2O3+2NaOH = 2NaFeO2+H2O
Получение и свойства гидроксидов и солей железа ( II и III ).
Fe(OH)2:
Получение:
Fe2++2OH- = Fe(OH)2
Химические свойства:
Амфотерен:
Fe(OH)2+2HCl = FeCl2+2H2O Fe(OH)2+2NaOH = Na2[Fe(OH)4]
Fe(OH)3:
Получение:
4Fe(OH)2+2H2O+O2 = 4Fe(OH)3 Fe3++3OH- = Fe(OH)3
Химические свойства:
Fe(OH)3+3HCl = FeCl3+3H2O Fe(OH)3+NaOH = NaFeO2+2H2O (сплавление) Fe(OH)3+3KOH = K3[Fe(OH)6]
Качественные реакции на ионы железа.
Качественная реакция на ион железа (II) – реакция с гексацианоферратом(3) калия K3[Fe(CN)6]
К3[Fe(CN)6 ]+FeCl2 = KFe[Fe(CN)6])↓+2KCl
Качественная реакция на ион железа (III) – реакция с гексацианоферратом(2) калия K4[Fe(CN)6]
К4[Fe(CN)6 ]+FeCl3 = KFe[Fe(CN)6])↓+3KCl
Железо, никель, хром, марганец. Получение в промышленности:
Железо:
Fe2O3+3CO = 2Fe+3CO2 Fe3O4+CH4 = 3Fe+CO2+2H2O
Особо чистое железо получают:
Fe(CO)5 = Fe+5CO (t) FeC2O4 = Fe+2CO2 (t)
Никель:
2NiS+3O2 = 2NiO+2SO2 NiO+C = Ni+CO
Хром:
Fe(CrO2)2+4C = Fe+2Cr+4CO (t) - феррохром
С целью получения самого металла хромистый железняк подвергают окислительному плавлению с поташом:
4Fe(CrO2)2+8K2CO3+7O2 = 8CO2+2Fe2O3+8K2CrO4 (1100C) 2K2CrO4+H2SO4 = K2Cr2O7+K2SO4+H2O K2Cr2O7+2C = Cr2O3+K2CO3+CO (t) или K2Cr2O7+S = Cr2O3+K2SO4 (t) Cr2O3+2Al = 2Cr+Al2O3
Марганец:
MnO2+2C = 2CO+Mn (t) MnO2+Fe2O3+C = Mn+2Fe+5CO (t) - ферромарганец
Пирометаллургические способы получения металлов (Pb, Cu, Zn) из сульфидных руд.
Свинец:
2PbS+3O2 = 2PbO+2SO2 PbO+CO = Pb+CO2 (t)
Медь:
2Cu2S+3O2 = 2Cu2O+2SO2 2Cu2O+Cu2S = 3Cu+SO2
Цинк:
2ZnS+3O2 = 2ZnO+2SO2 ZnO+C = Zn+CO (t)
Окислительное действие нитрата калия и хлората калия при нагревании (сплавлении):
Хлораты калия, натрия:
4KClO3 = KCl+3KClO4 (t) 2KClO3 = 2KCl+3O2 (t, MnO2)
Примеры окислительной активности хлоратов:
KClO3+3Mg = KCl+3MgO (t) NaClO3+5NaCl+3H2SO4 = 3Na2SO4+3Cl2+3H2O
Образование аммиакатов и гидроксокомплексов металлов и их разрушение кислотами и при нагревании:
Аммиакаты: Аммиачные комплексы обычно получают при взаимодействии солей или гидроксидов металлов с аммиаком в водных или неводных растворах, либо обработкой тех же солей в кристаллическом состоянии газообразным аммиаком:
AgCl(тв)+2NH3*H2O = [Ag(NH3)2]Cl+2 H2O Cu(OH)2(тв)+4NH3*H2O = [Cu(NH3)4](OH)2+4H2O NiSO4+6NH3*H2O = [Ni(NH3)6]SO4+6H2O CoCl2+6NH3(г) = [Co(NH3)6]Cl2 [Ni(NH3)6]SO4+3 H2SO4 = NiSO4+3(NH4)2SO4
Разрушение при нагревании:
[Ni(NH3)6]Cl2 = NiCl2+6NH3 (t)
Гидроксокомплексы металлов:
Гидроксокомплексы образуются в реакциях протолиза из аквакомплексов:
[Al(H2O)6]3++H2O = [Al(H2O)5(OH)]2++H3O+
либо при растворении амфотерных гидроксидов в водных растворах гидроксидов щелочных металлов:
Zn(OH)2+2OH = [Zn(OH)4]2
При рассмотрении способов разрушения гидроксокомплексов можно выделить несколько случаев.
1. При действии избытка сильной кислоты получаются две средних соли и вода:
Na[Al(OH)4]+4HCl(изб.) = NaCl+AlCl3+4H2O, K3[Cr(OH)6]+6HNO3(изб.) = 3KNO3+Cr(NO3)3+6H2O.
2. При действии сильной кислоты (в недостатке) получаются средняя соль активного металла, амфотерный гидроксид и вода:
Na[Al(OH)4]+HCl = NaCl+Al(OH)3+H2O, K3[Cr(OH)6]+3HNO3 = 3KNO3+Cr(OH)3+3H2O.
3. При действии слабой кислоты получаются кислая соль активного металла, амфотерный гидроксид и вода:
Na[Al(OH)4]+H2S = NaHS+Al(OH)3+H2O, K3[Cr(OH)6]+3H2CO3 = 3KHCO3+Cr(OH)3+3H2O.
4. Разрушение при нагревании:
Na[Al(OH)4] = NaAlO2+2 H2O (при нагревании)
Реакции термического разложения некоторых кислых солей ( NaHCO3, NaH2PO4, Na2HPO4, NaHSO4):
2NaHCO3 = Na2CO3+CO2+H2O (t) NaH2PO4 = NaPO3+H2O (t) 2Na2HPO4 = Na4P2O7+H2O (t) 2NaHSO4 = Na2S2O7+H2O (t)
Гидролиз солей (по катиону, по аниону, одновременный гидролиз двух солей).
Качественную и количественную стороны гидролиза удобно рассматривать с позиции концепции сильных и слабых электролитов (неассоциированных и ассоциированных).
Практически все электролиты, относящиеся к категории слабых в водных растворах, характеризуются тем, что равновесие их диссоциации смещено влево, в сторону недиссоциированных частиц. Иными словами, для них характерна не диссоциация, а наоборот – ассоциация.
Ассоциация - связывание соответствующими анионами протонов, катионами – ионов ОН- в недиссоциированные частицы.
А ионы Н+ и ОН- всегда имеются в воде за счет незначительной диссоциации.
Рассмотрим более подробно происходящие процессы на примерах двух солей – СuCl2 и Na2CO3.
1. Хлорид меди (II) является сильным электролитом, поэтому в водном растворе полностью диссоциирует на ионы:
СuCl2 = Cu2++2Cl-
Гидроксид меди (II) относится к слабым электролитам, иными словами катион Cu2+ при наличии в растворе ионов ОН- будет активно связывать их в малодиссоциированную частицу CuOH+, нарушая тем самым равновесие диссоциации воды:
Н2О = Н++ОН- Cu2++H2O = CuOH++H+
В результате, согласно принципу Ле Шателье, усилится диссоциация воды и в растворе увеличится концентрация ионов водорода по сравнению с той, которая была в воде. Раствор становится кислым, его рН<7, подобная ситуация называется гидролизом по катиону.
Разумеется, гидролиз хлорида меди может идти и дальше, по второй ступени:
CuOH++H2O = Cu(OH)2+H+
При наличии возможности протекания ступенчатого гидролиза, этот процесс реально протекает лишь по первой ступени, т.к. продукты гидролиза по первой ступени подавляют вторую
2. Сходная ситуация возникает и в растворе Na2CO3. В результате полной диссоциации этой соли в растворе образуются ионы СО32-, являющиеся анионами слабой угольной кислоты. Этот ион при наличии в растворе протонов будет активно связывать их в малодиссоциированную частицу НСО3-, нарушая тем самым равновесие диссоциации воды:
Н2О = Н++ОН- СО32-+Н2О = НСО3-+ОН-
В результате усилится диссоциация воды и в растворе увеличится концентрация ионов ОН- по сравнению с той, которая была в воде. Раствор стал щелочным, его рН>7, в этом случае говорят о гидролизе по аниону.
Поляризационное взаимодействие катионов и анионов с сильно полярными молекулами воды ведет к реакции, называется гидролизом солей.
Гидролиз соли по катиону и по аниону одновременно можно представить в общем виде следующим образом:
Kt++A-+H2O = KtOH+HA
