
+!!!Экзамен ФИЗИЧЕСКАЯ ХИМИЯ
.docUВОПРОСЫ ДЛЯ ПОДГОТОВКИ К ЭКЗАМЕНУ ПО ФИЗИЧЕСКОЙ ХИМИИ
Часть 1
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА |
|
|
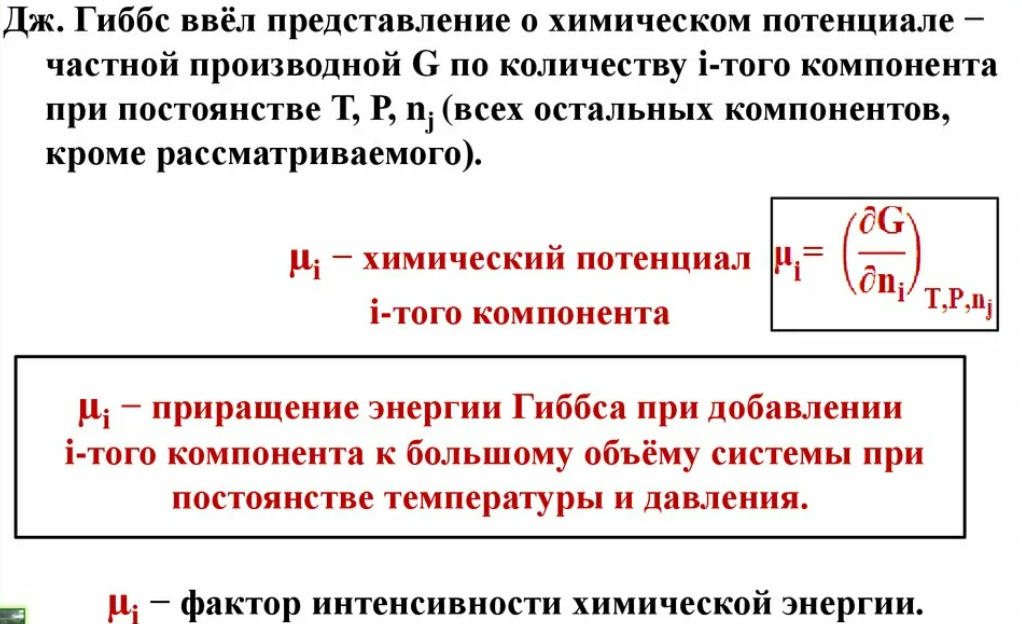
Химическая термодинамика – раздел физической химии, где изучаются взаимные превращения различных форм энергий в ходе химических реакций, а также определяется принципиальная возможность, направление и предел самопроизвольного протекания процессов в заданных условиях. Термодинамическая система – совокупность тел (веществ), находящихся во взаимодействии и отделенных от окружающей среды условной (воображаемой) или реальной границей (поверхностью раздела). В химической термодинамике рассматриваются только макроскопические системы, состоящие из очень большого числа частиц - поскольку только к этим системам применимы такие понятия как: температура, давление, теплота и некоторые другие. Взаимодействие системы с окружающей средой может происходить путем обмена энергией (механической, тепловой и др.) и веществом. Открытая система –обменивается с окружающей средой и веществом, и энергией. Закрытая система –обменивается с окружающей средой только энергией. В такой системе отсутствует обмен веществом с окружающей средой. Изолированная система –не обменивается с окружающей средой ни веществом, ни энергией. Функции состояния – термодинамические свойства системы, изменение которых при переходе из одного состояния системы в другое зависит только от ее начального и конечного состояния и не зависит от пути (способа) перехода Функции процесса – термодинамические свойства системы, изменение которых при переходе из одного состояния системы в другое зависит от пути (способа) перехода. Химическое равновесие – это состояние системы, в которой протекает обратимый процесс одновременно в прямом и обратном направлениях с одинаковой скоростью. Состав системы в результате такого процесса не меняется во времени, если условия его протекания остаются постоянными. Внутренняя энергия (U) – функция состояния, которая характеризует общий запас энергии системы и включает в себя все виды энергий движения и взаимодействия всех частиц, составляющих систему: атомов, ядер, электронов, молекул Теплота (Q) – микроскопическая, неупорядоченная, форма передачи энергии хаотически двигающимися частицами. Направление передачи теплоты определяется температурой. Теплота является функцией процесса. Понятия теплоты и работы применимы только к процессам, но не к состоянию системы. Работа (W) – макроскопическая форма передачи энергии от одной системы к другой, в форме кинетической энергии направленного (упорядоченного) движения частиц. Работа является функцией процесса. Согласно
первому
началу термодинамики,
термодинамическая система (например,
пар в тепловой машине) может совершать
работу только за счёт своей внутренней
энергии или каких-либо внешних
источников энергии.
|
|
работа
расширении газа в бесконечно малом
процессе равна
Для
реального конечного процесса расширения
газа
Изохорный процесс (V = const) Если
процесс протекает при постоянном
объеме системы, то изменение объема
dV =
0,
Изотермический процесс (T =const) Из
уравнения Менделеева-Клапейрона
|
|
|
|
Тепловой эффект процесса не зависит от пути его протекания (промежуточных стадий), а определяется начальным и конечным состоянием системы при условии, что давление и температура или объем системы и температура в ходе всего процесса остаются постоянными.
|
|
Теплоемкость – это физическая величина, которая характеризует способность вещества поглощать и отдавать тепло. Она показывает, сколько теплоты необходимо передать или извлечь из вещества, чтобы изменить его температуру на определенную величину.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Общей
закономерностью формы самих кривых
зависимости энергии Гиббса от
концентрации является поведение их
вблизи чистых компонентов. Оно вытекает
из закона Рауля для разбавленных
растворов и его следствия — закона
Генри (в разбавленных растворах
∆ G =
(1- xRBR) В пределе при xRВR → 0∆ G → 0 (т.е. к величине энергии Гиббса компонента A в структуре рассматриваемой фазы). Тогда предельный наклон кривой ∆ G = f (x) равен:
откуда следует, что при х RBR → 0 → ∞, т.е. кривая G(x) подходит кординатам компонентов снизу, с вертикальной касательной, как это показано на рисунке 3.1.
|
|
|
|
|
|
|
|
|
|
Химические реакции, протекающие на границе раздела фаз, называются гетерогенными химическими реакциями. При равенстве скоростей прямой и обратной реакции наступает химическое равновесие в гетерогенной системе. Примерами гетерогенных процессов является пароводяная конверсия углерода, или восстановление оксидов металлов водородом: СR(к)R + 2НR2RО = СОR2R + 2НR2R , МеОR(к)R + НR2 R= МеR(к)R + НR2 RО. Как и для любого равновесия, условием гетерогенного химического равновесия является равенство энергии Гиббса нулю, ΔG = 0. Для реакции пароводяной конверсии углерода константа равновесия имеет вид: КRрR = (рRСО2R)RрR (рRН2R)P2PRрR/(рRН2ОR)P2PRрR, для восстановления металла КRрR = (рRН2OR)RрR/(рRН2R)RрR. Из приведенных выражений следует, что в уравнения констант гетерогенного химического равновесия не входят концентрации твердых веществ, участвующих в прямой и обратной реакциях. Это особенность гетерогенного химического равновесия |
|
Зависимость константы равновесия химической реакции от температуры может быть описана с помощью уравнения Вант-Гоффа: ln(K) = -ΔH/R * (1/T) + ΔS/R. K - константа равновесия, ΔH - изменение энтальпии, ΔS - изменение энтропии, R - газовая постоянная, T - температура. Уравнение изобары химической реакции выводится из уравнения Гиббса-Гельмгольца. Оно позволяет определить зависимость константы равновесия от температуры и предсказать, как изменение температуры может влиять на направление реакции. Анализ уравнения изобары позволяет оценить энергетические параметры реакции, такие как энтальпия и энтропия, и их влияние на состояние равновесия. |
|
|
|
Изменение давления и добавка инертных газов могут влиять на сдвиг равновесия химической реакции.
1. Изменение давления: - При увеличении давления, сдвиг равновесия происходит в сторону образования меньшего количества газовых молекул. Это соответствует принципу Ле Шателье. - При уменьшении давления, сдвиг равновесия происходит в сторону образования большего количества газовых молекул.
2. Добавка инертных газов: - Добавка инертных газов не влияет на равновесие химической реакции, так как они не участвуют в реакции и не взаимодействуют с другими веществами. Они просто увеличивают общее давление системы без влияния на концентрации реагентов и продуктов.
В обоих случаях, изменение давления и добавка инертных газов, может повлиять на равновесие химической реакции, но не изменит значение константы равновесия. |
|
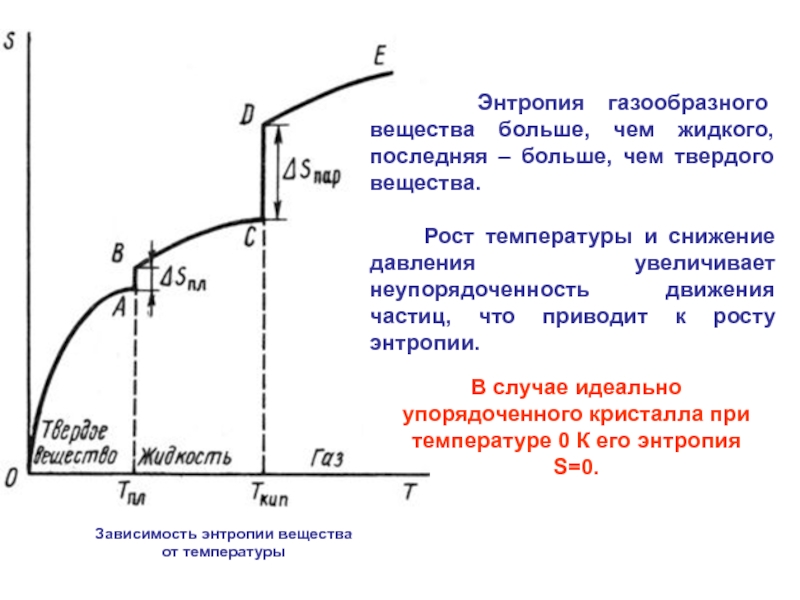
1. Невозможность достижения абсолютного нуля температуры. 2. При приближении к абсолютному нулю температуры, энтропия вещества стремится к нулю. 3. Вещества, имеющие ненулевую энтропию при более высоких температурах, не могут достичь абсолютного нуля температуры. 4. Тепловая теорема Нернста подтверждает невозможность полного перевода тепловой энергии в механическую работу без потерь. |
ФАЗОВЫЕ РАВНОВЕСИЯ И РАСТВОРЫ |
|
|
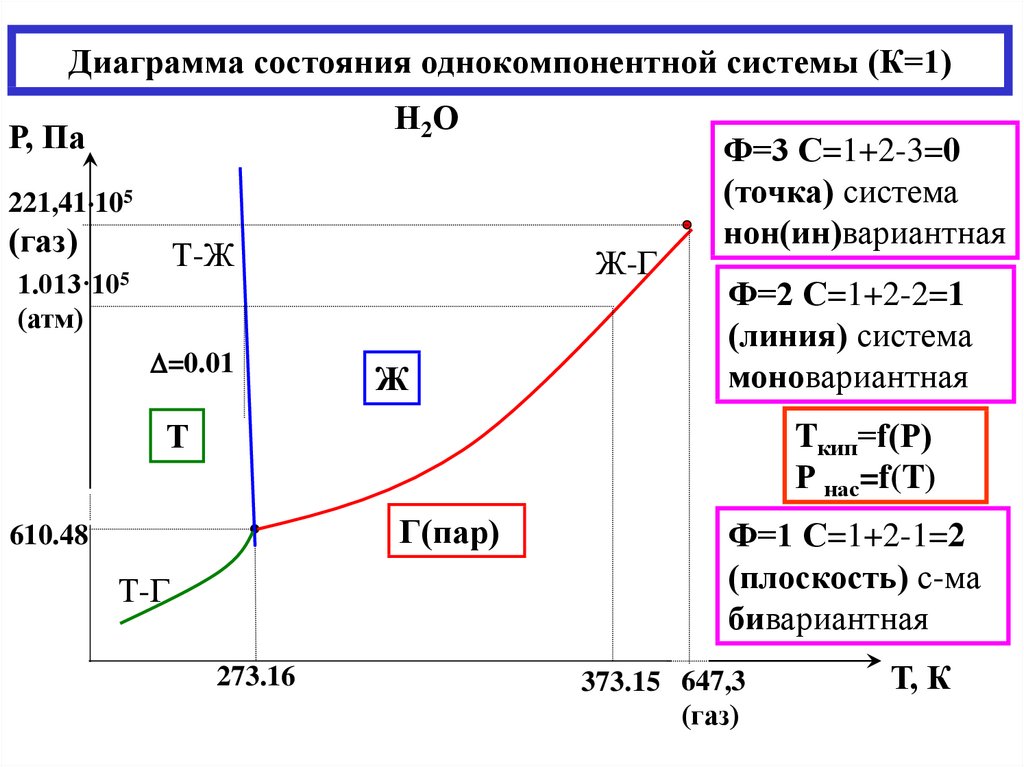
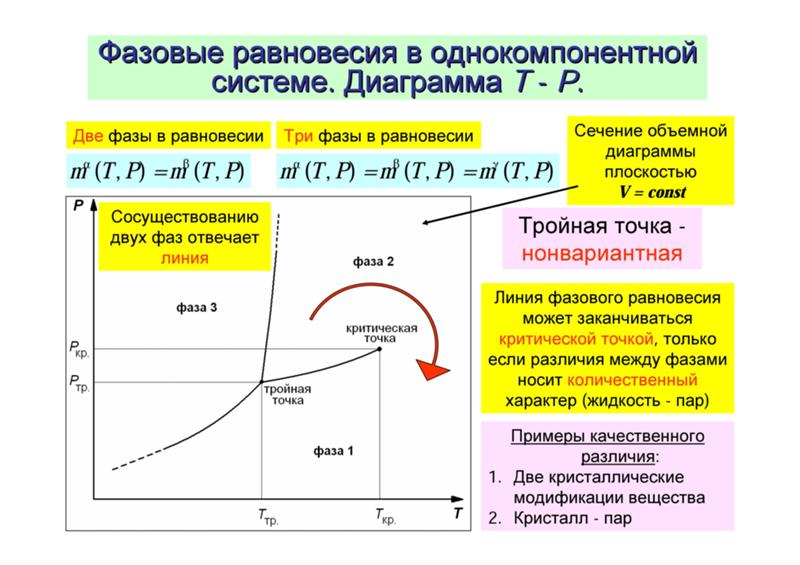
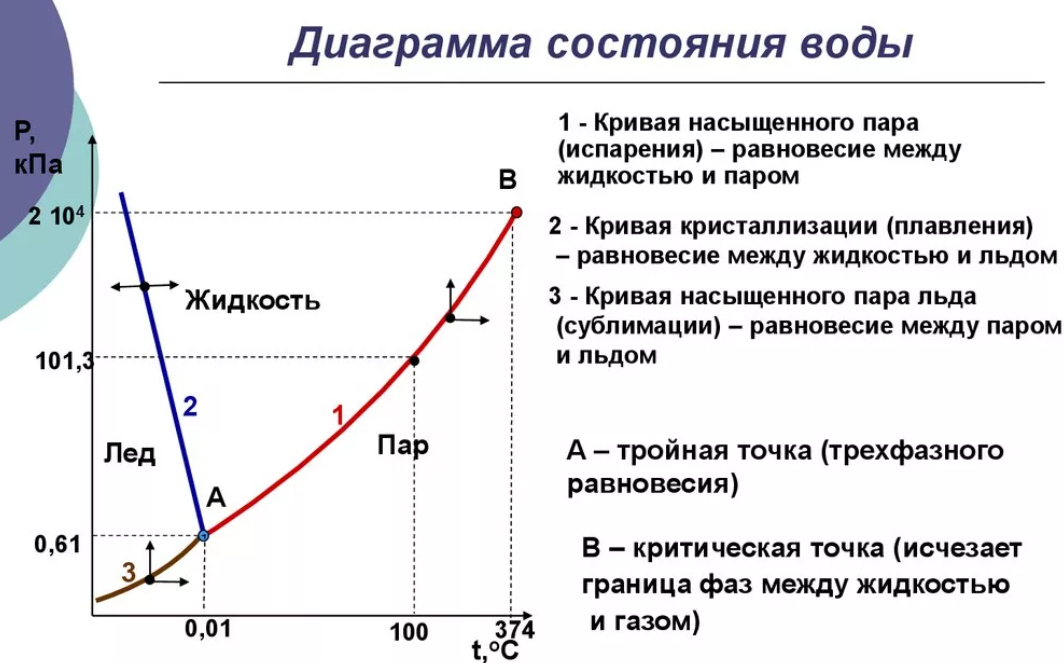
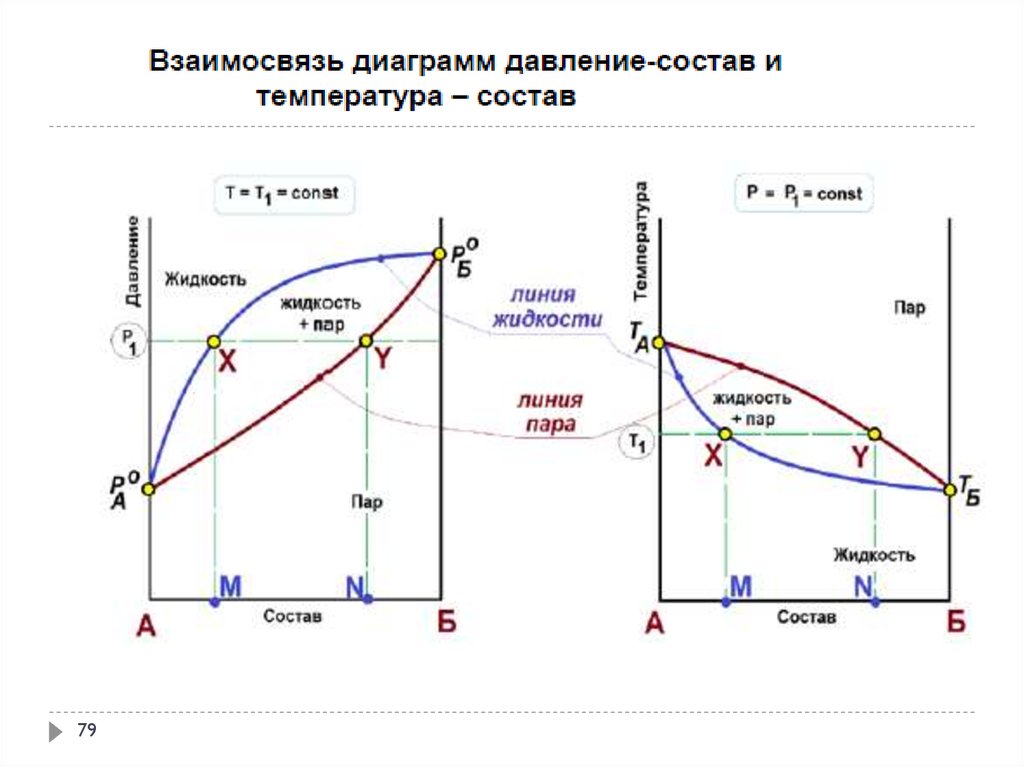
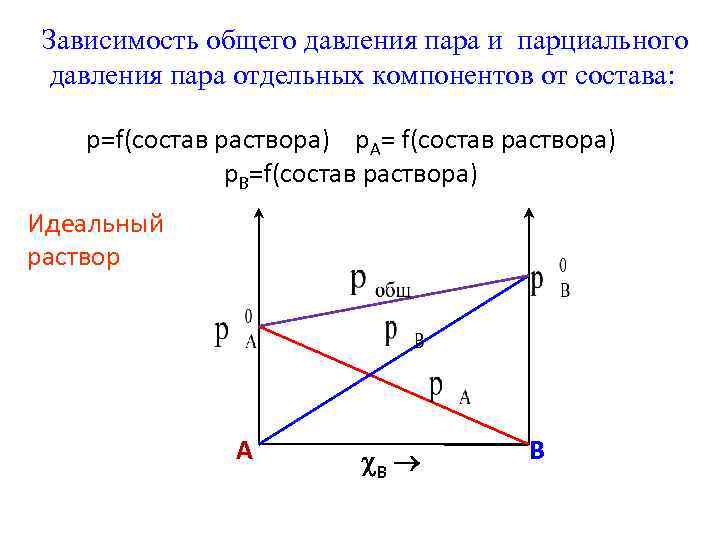
Фаза – совокупность однородных частей системы, отделенная от других частей системы границей (поверхностью) раздела и имеющая в каждой точке одинаковые химические и физические свойства. Фаза характеризуется уравнением состояния. Составляющие вещества – вещества, которые могут быть выделены из системы и вне нее могут устойчиво существовать.
Термодинамической степенью свободы (вариантностью) системы называется число параметров, которые можно независимо менять, не меняя при этом числа и вида фаз данной системы. Например, состояние идеального газа определяется давлением, объемом и температурой, которые связаны уравнением Менделеева — Клапейрона. Два из этих параметров могут быть выбраны произвольно, третий при этом имеет вполне определенное значение. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
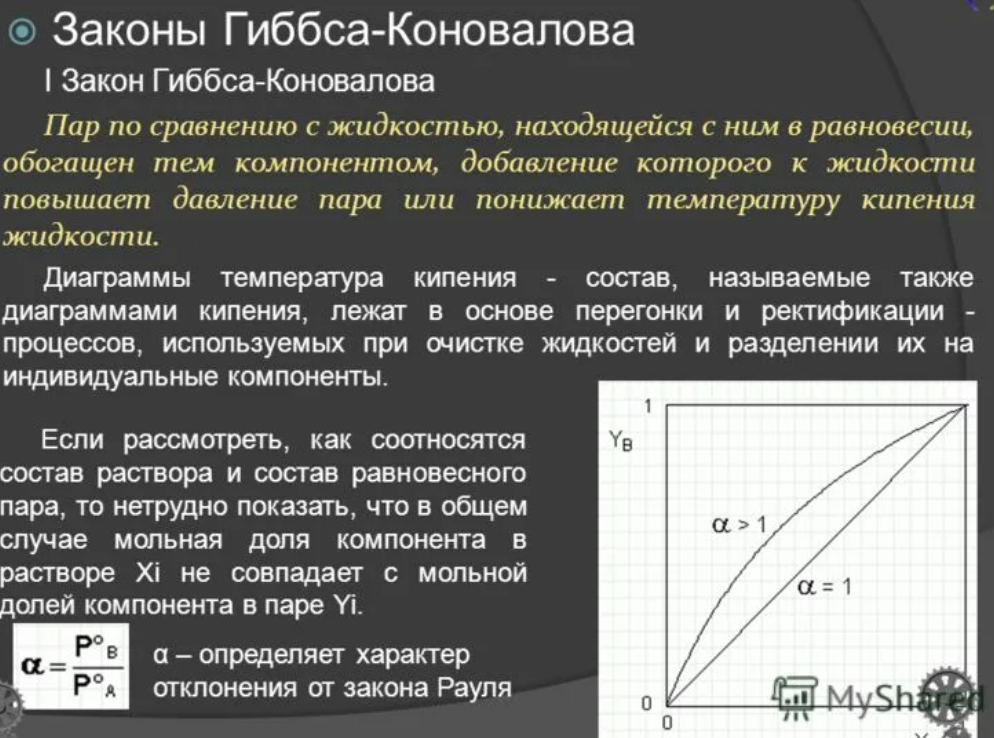
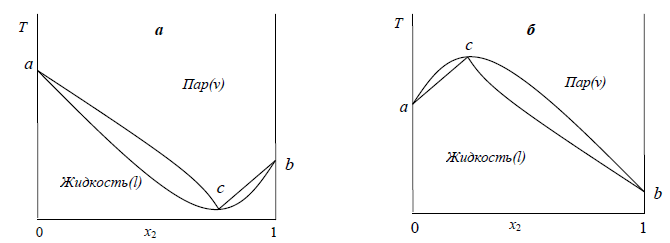
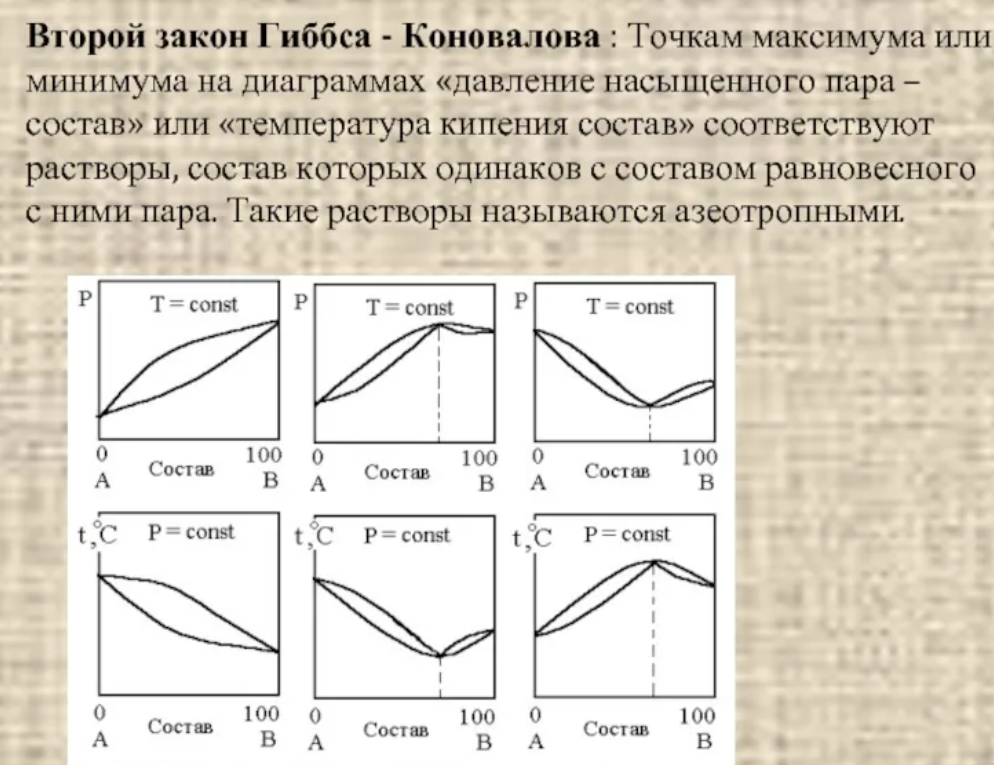
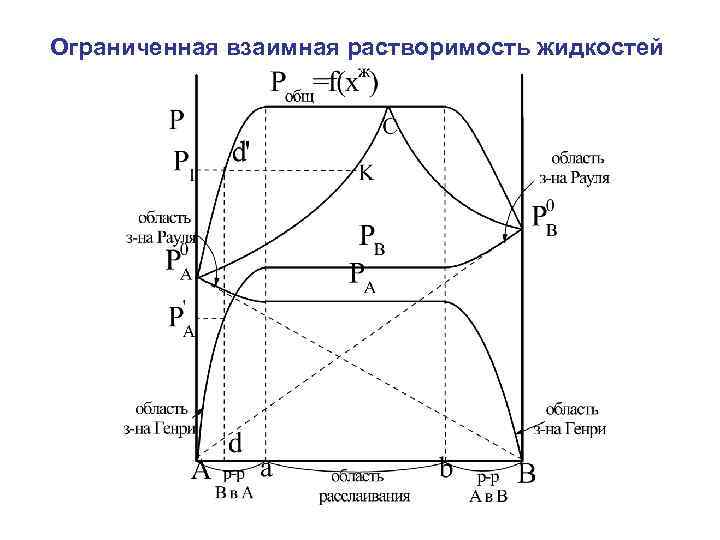
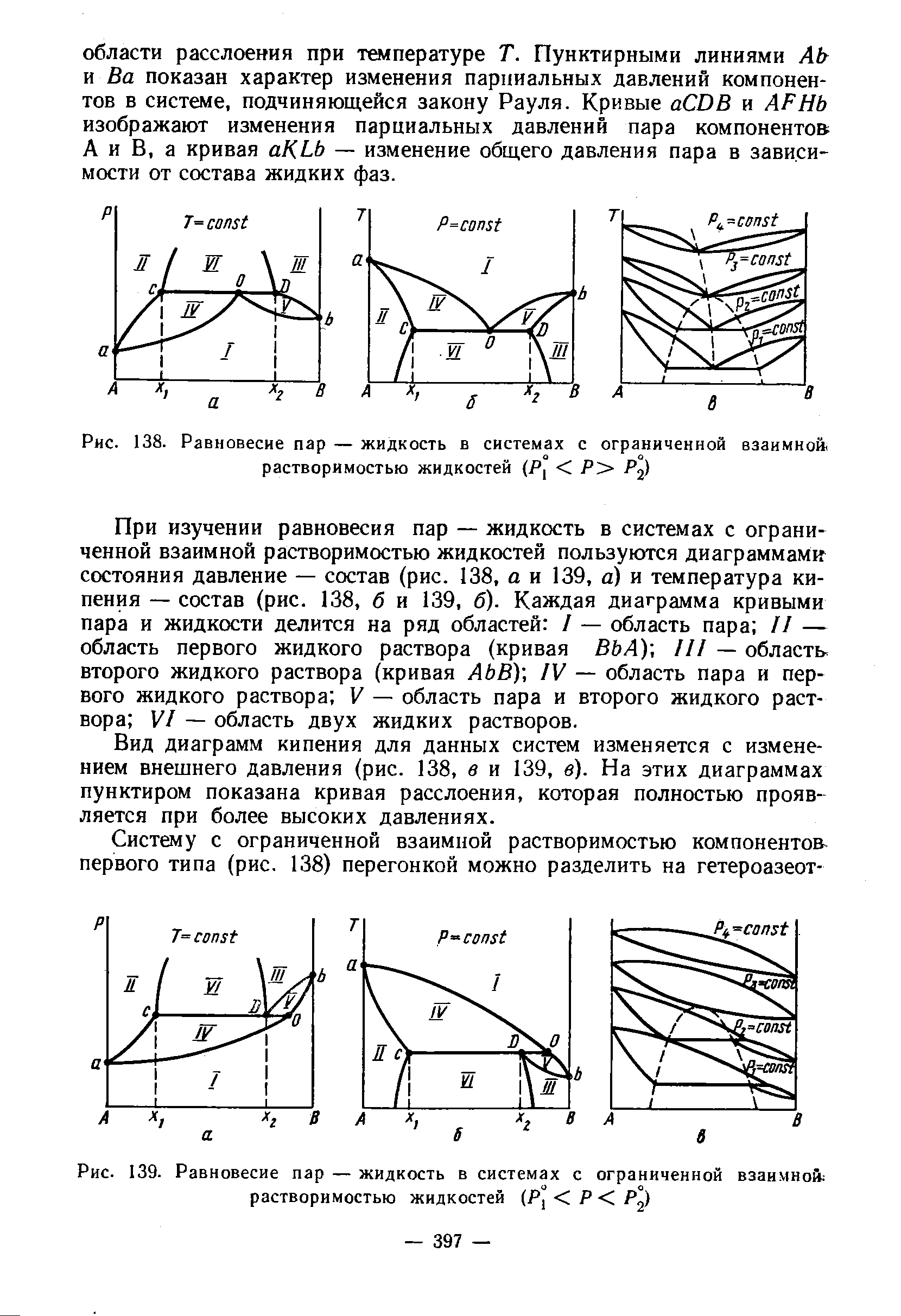
Экстремумы на зависимостях температура кипения – состав (точки c на рисунке 2.4) называются азеотропными точками. В этих точках состав жидкости и пара одинаков. Таким образом, по виду диаграммы температура кипения – состав можно определить идеальный раствор или нет и какие отклонения от закона Рауля для него характерны
|
|
Перегонка, или ректификация, является процессом разделения смесей жидкостей на компоненты с различными температурами кипения. Она широко применяется в физической химии для разделения смесей на основе различий в их температуре кипения. Процесс ректификации основан на принципе фракционирования, когда смесь подвергается повторному нагреву и охлаждению в специальном аппарате, называемом колонной. В колонне происходит контакт паров и жидкости, что позволяет разделить компоненты смеси на основе их различных летучих характеристик. Во время ректификации, смесь подается в верхнюю часть колонны и нагревается. В результате, компоненты с более низкими температурами кипения испаряются и поднимаются вверх по колонне. Затем они конденсируются на пластинах или упаковке внутри колонны и собираются в качестве фракций. На каждом уровне колонны происходит фракционирование, что позволяет получить более чистые компоненты. Таким образом, ректификация является важным процессом в физической химии для разделения смесей на основе их различных температур кипения и используется во многих промышленных и лабораторных процессах. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
компонентов из твердых тел, обычно с помощью органических растворителей (экстрагентов). Применяется для выделения органических соединений из растительного сырья, растительных и эфирных масел и др.
|

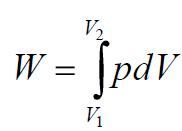
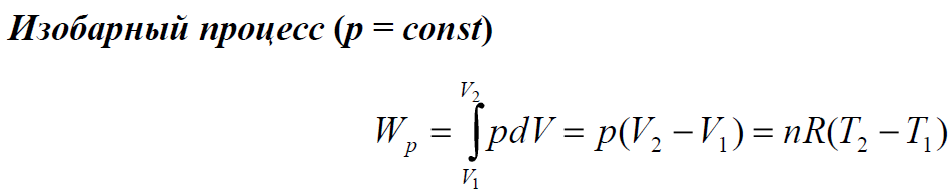









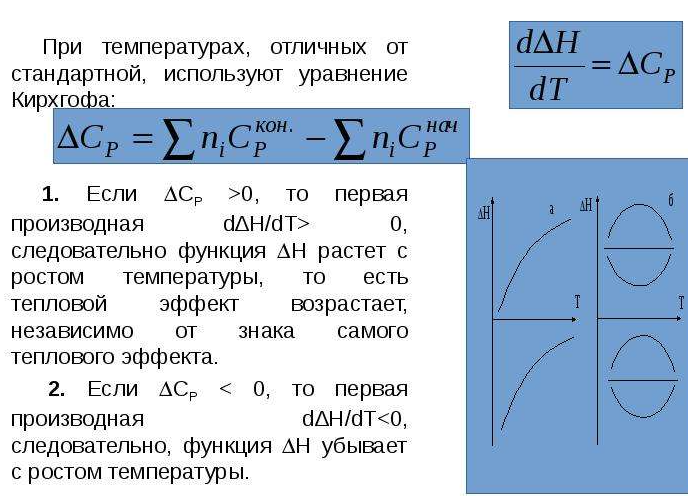







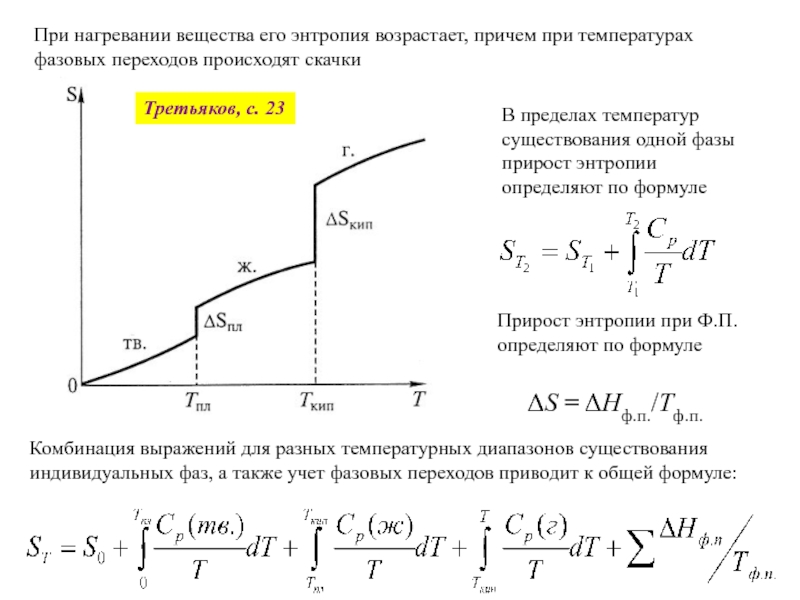












 где H - 3TUэнтальпияU3T, T - абсолютная
температура и G - свободная
энергия Гиббса системы,
все при постоянном давлении p. Уравнение
утверждает, что изменение отношения Г
/ Т при постоянном
давлении в результате бесконечно
малого изменения
температуры составляет коэффициент H
/ TP2P.
где H - 3TUэнтальпияU3T, T - абсолютная
температура и G - свободная
энергия Гиббса системы,
все при постоянном давлении p. Уравнение
утверждает, что изменение отношения Г
/ Т при постоянном
давлении в результате бесконечно
малого изменения
температуры составляет коэффициент H
/ TP2P.















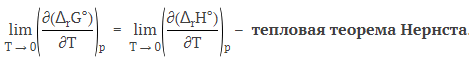































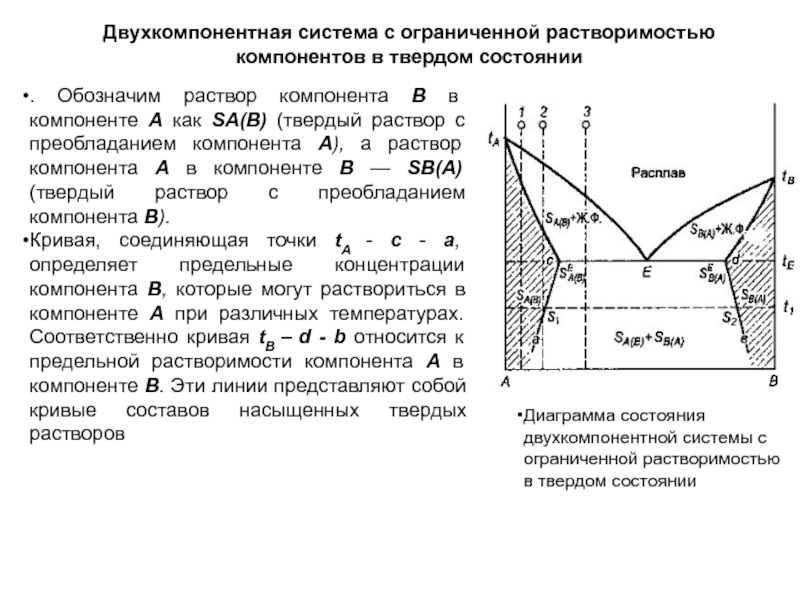
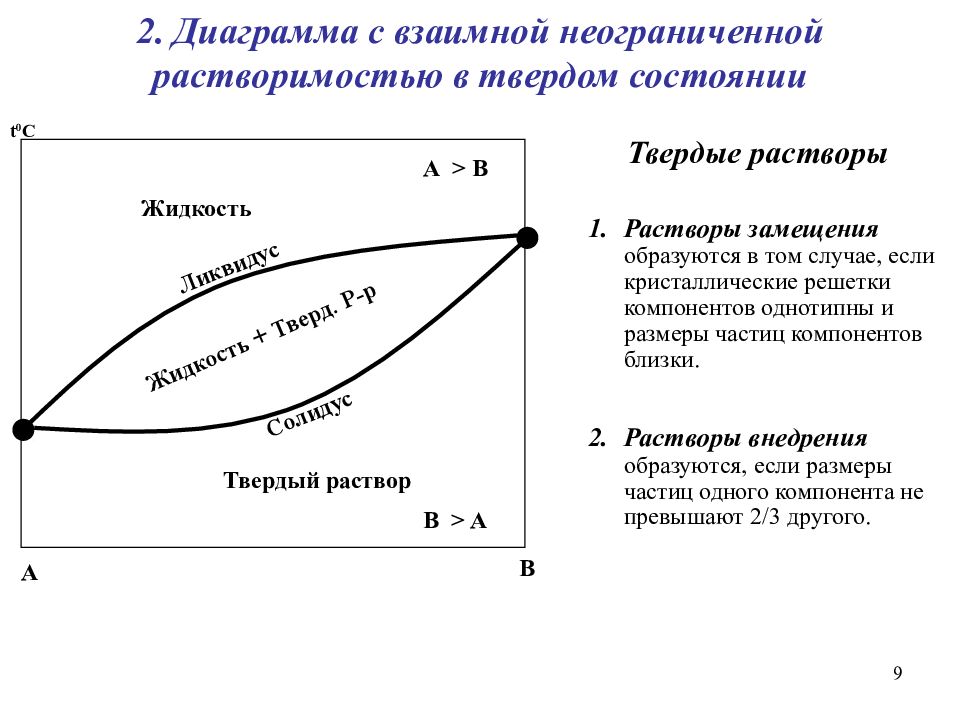
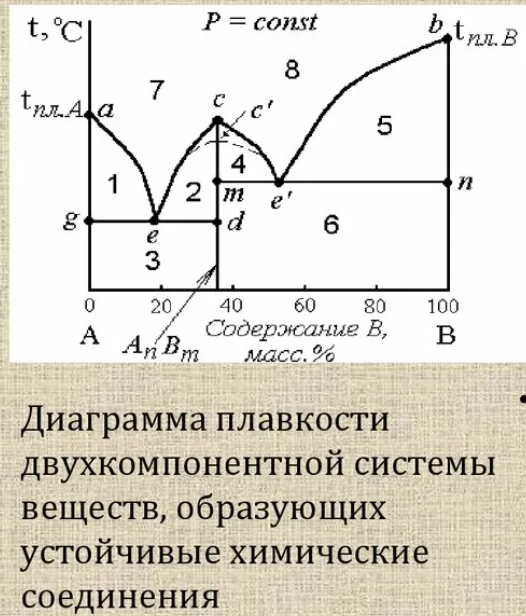
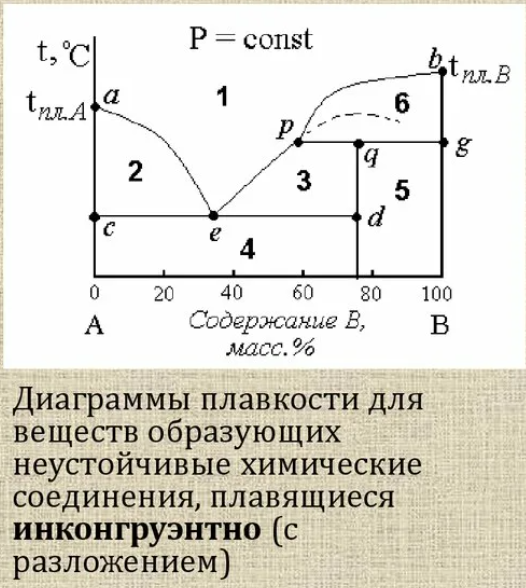


 Экстраги́рование
- способ
извлечения одного или нескольких
Экстраги́рование
- способ
извлечения одного или нескольких
