спирты 1
.docСпирты.
Спирты-это производные углеводородов, содержащие функциональную группу ОН.
Спирты бывают одноатомные, содержащие одну группу ОН, например – СН3СН2ОН,
двухатомные,
например- НОСН2СН2ОН,
называются гликолями, трехатомные-глицерин
НОСН2СН(ОН)СН2ОН, и т. д.
Номенклатура
По номенклатуре IUPAC спирты имеют окончание ОЛ, цепь нумеруют таким образом,
чтобы атом углерода, связанный с ОН имел наименьший номер:
4 3 2 1
СН3СН2СН(ОН)СН3 2-бутанол -НОСН2СН2СН2ОН 1,3-пропандиол
4 3 2 1
СН3СН(СН3)СН(ОН)СН3 3-метил-2-бутанол
- Спирты бывают первичные, если гидроксил связан с первичным атомом углерода, например,
СН3СН2СН2ОН, вторичные, если ОН у вторичного атома углерода , например, написанный выше
2-бутанол и третичные, если ОН у третичного атома углерода (СН3)3СОН.
Часто спирты называют по радикалам, связанным с группой ОН, например, метиловый спирт-
СН3ОН, этиловый-С2Н5ОН, изопропиловый—СН3СН(ОН)СН3 и т. д.
Карбинольная номенклатура.
По этой номенклатуре спирты называют как производные простейшего спирта, который
в этом случае называют карбинолом.
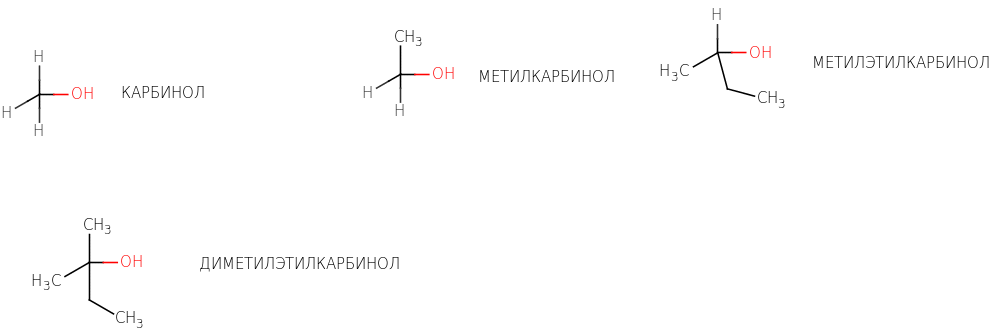
СПОСОБЫ ПОЛУЧЕНИЯ
Гидролиз галогеналкилов
RCH2Cl + NaOH→ RCH2OH + NaCl для первичных и вторичных спиртов
R3CCl + HOH→ R3COH + HCl для третичных спиртов (реакция обратима)
Гидратация алкенов
Н2SO4
СН3СН=СН2 + НОН → СН3СН(ОН)СН3
Восстановление альдегидов и кетонов
RCH=O + H2 → RCH2OH кат. Ni или Pt для первичных спиртов из альдегида
R2C=O + H2 → R2CHOH кат. Ni или Pt для вторичных спиртов из кетона
Mg –органический синтез.
В этом способе используют алкилмагнийгалогениды(реактивы Гриньяра) и карбонильные
соединения. Реактивы Гриньяра всегда надо получать из галогеналкилов и Mg нагреванием в растворе абсолютного(т.е. лишенного следов влаги) диэтилового
эфира.
абс.эфир
RBr + Mg → RMgBr В присутствии влаги реактивы Гриньяра разлагаются
RMgBr + HOH→ RH + MgBrOH
Для получения первичных спиртов в качестве карбонильного соединения используют
формальдегид, для вторичных- любые другие альдегиды, для третичных-кетоны.
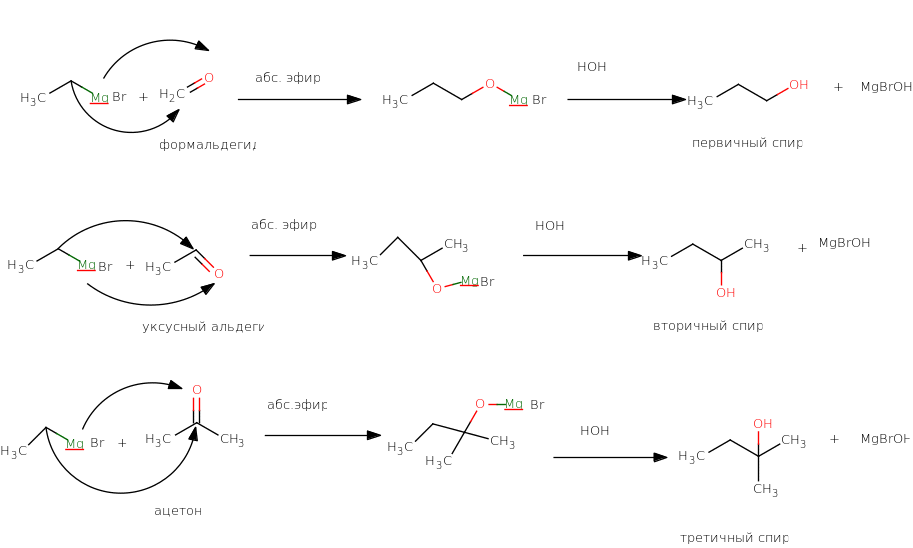
&+ &-
При присоединении реактива Гриньяра по связи С=О образуется смешанный алкоголят
магния, который превращают в спирт гидролизом.
ХИМИЧЕСКИЕ СВОЙСТВА
1.Кислотно-основные свойства
Спирты обладают слабокислыми свойствами, более слабыми чем у воды.
Со щелочами не реагируют, образуют алкоголяты при действии щелочных
металлов: 2 СН3ОН + 2 Na → 2CH3ONa + H2
Алкоголяты разлагаются под действием воды, как более сильной кислоты:
RONa + HOH → ROH + NaOH
Кислые свойства слегка уменьшаются при переходе от первичных спиртов к вторичным и третичным. Самая сильная кислота- метиловый спирт.
При взаимодействии спиртов с алкилмагнийгалогенидами образуется алкоголят и выделяется углеводород:
ROH + CH3MgBr → ROMgBr + CH4
Основные свойства спиртов определяются способностью атома кислорода принимать
протон на неподеленную электронную пару, имеющуюся на внешнем электронном уровне, и выражены более сильно, чем у воды:
.. +
RCH2OH + H+ → RCH2OH2
Образовавщийся алкилоксониевый катион стабилизирован за счет делокализации положительного заряда под действием положительного индуктивного эффекта (+I)
алкильного радикала: ∂+ +
RCH2→OH2 Электронная плотность смещается к кислороду.
Основные свойства спиртов увеличиваются при переходе от первичных к третичным спиртам, т. к. у третичного радикала индуктивный эффект больше
2. Замещение гидроксильной группы.
Гидроксильная группа в спиртах может замещаться при действии галогеноводородных кислот, реакция обратима. Третичные спирты реагируют легче, чем вторичные и первичные:
ROH + HBr → RBr + HOH
←
Можно заместить группу ОН при действии хлористого тионила:
ROH + SOCl2 → RCl + SO2 + HCl
или пятихлористого фосфора:
ROH + PCl5 → RCl + POCl3 + HCl
3.Реакция этерификации
Спирты взаимодействуют с кислотами с образованием сложных эфиров и воды:
H2SO4
RCOOH + R1OH → RCOOR1 + HOH
←
Реакция обратима, требует нагревания, присутствия катализатора- серной к-ты и отгонки образующейся воды.
На холоду с конц. серной кислотой может образоваться эфир серной кислоты:
ROH + HOSO3H → ROSO3H + HOH
4.Реакции дегидратации
Внутримолекулярная дегидратация проходит под действием таких кислот, как H2SO4,
H3PO4 или при действии Al2O3 при достаточно сильном нагревании. При этом водород отщепляется от соседнего, наименее гидрогенизированного атома углерода:
H2SO4 t
CH3CH2CH(OH)CH3 → CH3CH=СHCH3 + HOH
Легче всего дегидратируются третичные спирты.
Межмолекулярная дегидратация –проходит при более низкой температуре и требует
гораздо меньшего количества кислоты- соотношение спирт: кислота-2:1, при этом
образуются простые эфиры:
H2SO4
2ROH → ROR + HOH
5.Окисление
Первичные и вторичные спирты окисляются такими окислителями как KMnO4 , хромовая
смесь и др. При окислении первичных спиртов первоначально образуются альдегиды,
которые очень быстро окисляются в кислоты.
RCH2OH → RCH=О → RCOOH
Вторичные спирты в этих условиях превращаются в кетоны:

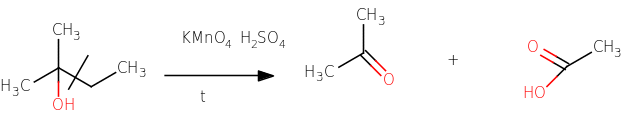
Третичные спирты окисляются очень трудно, в жестких условиях при действии КMnO4 в
присутствии конц. H2SO4 при интенсивном нагревании, при этом разрывается углеродная
цепь: