
Карбоновые кислоты
.docxКарбоновые кислоты
Кислоты содержат функциональную группу СООН
По номенклатуре IUPAC эта группа обозначается окончанием -овая кислота
НСООН муравьиная к- та метановая кислота
СН3СООН уксусная к-та этановая к-та
СН3СН2СООН пропионовая к-та пропановая к-та
СН3СН2СН2СООН масляная к-та бутановая к-та
СН3СН(СН3)СООН изомасляная к-та метилпропановая к-та
5 4 3 2 1
СН3СН(СН3)СН2СН2СООН 4-метилпентановая к-та
Нумерация начинается от углеродного атома карбоксильной группы.
НООС-СООН щавелевая к-та этандиовая к-та
НООССН2СООН малоновая к-та пропандиовая к-та
СПОСОБЫ ПОЛУЧЕНИЯ
Окисление первичных спиртов или альдегидов
RCH2OH → RCH=O → RCOOH Окислители -хромовая смесь, KMnO4
2.Гидролиз нитрилов- RCN
Нитрилы получают из галогеналкилов реакцией нуклеофильного замещения
RCl + KCN → RCN + KCl
H+
RCN + 2 HOH → RCOOH + NH4+ гидролиз в кислой среде
Можно проводить гидролиз и в щелочной среде, тогда получиться соль кислоты
NaOH
RCN + 2 HOH → RCOONa + NH4OH
С помощью металлоорганических соединений, например, реактивов Гриньяра
Абс. Эфир HBr
RMgBr + CO2 → RCOOMgBr → RCOOH + MgBr2
Оксосинтез
t p
СН2=СН2 + СО + НОН → СН3СН2СООН
Kat Co (кобальт)
ХИМИЧЕСКИЕ СВОЙСТВА
1.Кислые свойства
В группе СООН существует сопряжение электронной пары, находящейся на
внешнем электронном уровне атома кислорода и π-электронов связи С=О,
поэтому связь О ←Н поляризована в большей степени, чем , например, в спиртах,
водород более подвижен, кислые свойства выше. Образующийся при отщеплении
протона анион RCOO- характеризуется равномерным распределением отрицательного
заряда по обоим атомам кислорода, что способствует его устойчивости и облегчает
его образование

Органические кислоты более слабые, по сравнению с минеральными, и реагируют
только с активными металлами 1 и 2 гр.
2RCOOH + 2 Na → 2 RCOONa + H2
Соли образуются и с NaOH и с NaHCO3 , угольная кислота более слабая
RCOOH + NaOH → RCOONa + HOH
RCOOH + NaHCO3 → RCOONa + CO2 +HOH
2.Остальные свойства кислот будем рассматривать при получении производных
кислот.
Существуют след. виды производных:
СОЛИ RCOOM(металл)
ГАЛОГЕНАНГИДРИДЫ, в основном это хлорангидриды RCOCl
СЛОЖНЫЕ ЭФИРЫ RCOOR1
АМИДЫ RCONH2
НИТРИЛЫ RCN
АНГИДРИДЫ RC(O)OC(O)R
Хлорангидриды
Получают хлорангидриды из кислот при действии хлористого тионила-SOCl2 или
треххлористого или пятихлористого фосфора:
RCOOH + SOCl2 → RCOCl + SO2 + HCl
RCOOH + PCl5 → RCOCl + POCl3 + HCl
3RCOOH + PCl3 → 3 RCOCl + P(OH)3
Хлорангидриды очень реакционноспособные соединения, реагируют с водой,
спиртами, аминами, солями кислот:
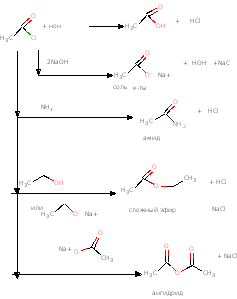
Т.е из хлорангидрида можно получить почти все производные кислоты.
При восстановлении хлорангидриды превращаются в альдегиды
RCOCl + H2 (Pd) → RCOH
Сложные эфиры
Один из способов получения сложных эфиров-реакция этерификации:

Реакция обратима и воду из реакционной массы надо удалять, чтобы полностью
прореагировали исходные соединения.
Сложный эфир можно получить из хлорангидрида, см.выше.
Можно получить и из ангидрида, см. свойства ангидридов (ниже), а также из
солей кислот: RCOONa + C2H5Cl → RCOOC2H5 + NaCl
Химические свойства сложных эфиров
Гидролиз
Гидролиз в кислой среде это обратная реакция этерификации
RCOOCH2CH3 + HOH (H+) → RCOOH + CH3CH2OH
Избыток ←
Можно гидролизовать в щелочной среде, тогда реакция необратима
СН3СН2СООСН3 + NaOH(HOH) → CH3CH2COONa + CH3OH
2 . Аммонолиз
Сложные эфиры взаимодействуют с аммиаком с образованием амидов,
обратная реакция идет с трудом:
СН3СН2СООСН3 + NH3 → CH3CH2CONH2 + CH3OH
Переэтерификация
При действии на сложный эфир избытка спирта в условиях реакции
этерификации, получается сложный эфир с этим спиртом
СН3СН2СООСН3 + н-С4Н9ОН → СН3СН2СООС4Н9 + CH3OH
Изб.
Ангидриды
Ангидриды получают из хлорангидридов и солей кислот, как было показано
выше в свойствах хлорангидридов, или из кислот отщеплением воды в присутствии
водоотнимающих катализаторов

Химические свойства ангидридов
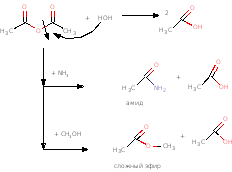
Ангидриды реагируют с нуклеофилами, которые атакуют электрофильный
карбонильный углеродный атом, затем расщепляется связь О-С, можно получить
амид или сложный эфир.
Амиды
Амиды можно получить из кислоты при действии аммиака, сначала получается
аммонийная соль, затем при сухой перегонке отщепляется вода и образуется амид
t
RCOOH + NH3 → RCOONH4 → RCONH2 + HOH
Амиды также можно получить из хлорангидридов (см. выше), из ангидридов (см.выше)
и из сложных эфиров (см.выше)
Химические свойства амидов
Амиды гидролизуются водой в кислой или щелочной среде с образованием кислот
или солей кислот
RCONH2 +HOH(H+) → RCOOH + NH4+
RCONH2 + HOH(OH-) → RCOO- + NH3
При действии водоотнимающих реагентов от амидов отщепляется вода с образованием
нитрилов
P2O5
RCONH2 → RCN
-HOH
Нитрилы можно получать и из галогеналкилов
RCl + KCN → RCN + KCl
При восстановлении нитрилов образуются первичные амины

