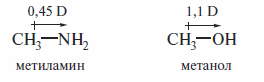Вводная КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ (1)
.docxКЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
К настоящему времени известны миллионы органических соединений. Каждый год химики синтезируют и выделяют из природных источников сотни тысяч новых соединений. Чтобы ориентироваться в этом многообразии, органические соединения принято классифицировать.
Большинство органических молекул состоит из двух частей: фрагмента, который в ходе реакции остается без изменения (остов молекулы), и группы, подвергающейся при этом превращениям (функциональная группа).
Функциональной группой называют атом или группу атомов, связанных определенным образом, наличие которых в молекуле органического вещества придает ему характерные свойства и определяет его принадлежность к тому или иному классу соединений.
Характер остова определяет ряд, к которому принадлежит данное соединение. Ниже даны определения рядов и названы некоторые их представители.
Ациклический (или алифатический, или жирный) ряд включает соединения с открытой цепью углеродных атомов; эти соединения могут быть насыщенными (предельными), например:
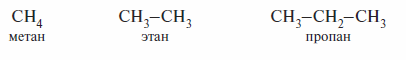
или ненасыщенными (непредельными), например:

Циклический ряд включает: карбоциклические соединения, содержащие углеродный скелет, замкнутый в цикл
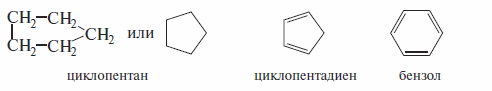
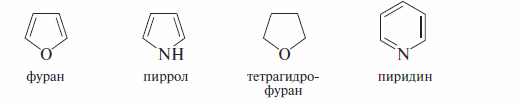
гетероциклические соединения, содержащие гетероатомы (иные, нежели углерод) в составе циклов
В свою очередь, карбоциклические соединения подразделяются на: ароматический ряд, который включает бензол и его производные, содержащие циклы с чередующимися простыми и двойными связями и отвечающие правилу ароматичности (ароматические ядра)
алициклический ряд, который объединяет все остальные карбоциклические соединения, как насыщенные, так и ненасыщенные
Наличие тех или иных функциональных групп в молекуле органического соединения определяет принадлежность этого соединения к тому или иному классу. Основные классы органических соединении.
1. Угеводороды (R—Н). II. Галогенопроизводные (R—Hlg). III. Спирты (R—ОН). IV. Эфиры простые и сложные (R—О—R, R—СО—OR). V. Карбонильные соединения — альдегиды и кетоны (RСНО, R-CO-R)
VI.Карбоновые кислоты (R—СООН) VII. Амины (R-NH2, R.NH, R3N). VIII. Нитросоединения (К—NO2).
IX. Сульфокислоты (R—S03H).
X. Металлоргаиические соединения (R—Me).
НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Чтобы ориентироваться в мире органических соединений, необходимо не только знать принципы их классификации, но и уметь правильно назвать каждое из них. При этом должно быть соблюдено важное правило: каждому названию должно соответствовать только одно соединение.
Правила, по которым образуются названия органических соединений, составляют номенклатуру. В настоящее время в органической химии применяют несколько систем номенклатуры.
Тривиальная номенклатура
Это система исторически сложившихся названий, но применяемых до настоящего времени. Как правило, эти названия были даны еще в ранний период развития органической химии и никак не отражают строение органического вещества. Например:
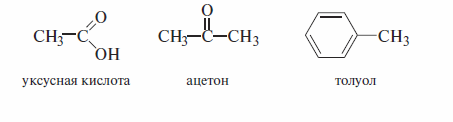
Рациональная номенклатура
По правилам рациональной номенклатуры за основу названия органического соединения принимают название наиболее простого (чаще первого) члена данного гомологического ряда. Все остальные соединения рассматривают как его производные, образованные замещением в нем атомов водорода алкильными группами, атомами или функциональными группами.
Систематическая номенклатура ИЮПАК
Систематическая номенклатура ИЮПАК (IUРАС — Международный союз теоретической и прикладной химии) является наиболее общепринятой и универсальной, с которой познакомимся при рассмотрении классов органических соединений.
ПРИРОДА КОВАЛЕНТНОЙ СВЯЗИ
Атомные орбитали
В отличие от неорганических соединений, для которых характерны ионные связи, органическим соединениям присущи ковалентные связи. Природа ковалентной связи в настоящее время интерпретируется в рамках двух подходов. В основе первого подхода лежат правило октетов Г. Льюиса и представления об электронных эффектах. Второй подход основан на квантово-химическом представлении природы ковалентной связи.
Сила, удерживающая атомы в рамках молекулы называется химической связью. Ковалентная связь осуществляется парой электронов, представляемыми каждым атомом. Движущей силой, заставляющей атомы соединяться между собой, является стремление принять, отдать или объединить электроны с тем, чтобы получить полностью заполненную внешнюю электронную оболочку атома инертного газа данного периода.
Согласно квантово-механическим представлениям, электроны в атомах находятся на атомных орбиталях. В физическом понимании каждая АО представляет собой волновую функцию. Она описывается собственным набором квантовых чисел и для атома водорода может быть выражена математической функцией. Атом каждого элемента обладает орбиталями лишь определенного типа и числа.
Ниже даны условные графические представления орбиталей атомов элементов 2-го периода и наборы квантовых чисел, описывающих эти орбитали.
Главное квантовое число n определяет размер и энергию АО; оно может принимать целочисленные значения, а его максимальное значение для данного элемента определяется номером периода таблицы Менделеева.
Побочное (азимутальное) квантовое число l определяет форму АО: l=0,1,..,(n-1).
Магнитное квантовое число m определяет пространственную ориентацию АО: m = О, ±1,..., ±l.
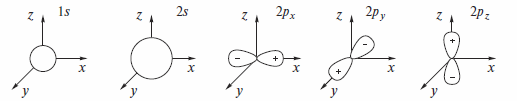
Независимо от значения n s-орбиталь всегда обладает сферической симметрией (форма шара) относительно ядра атома: волновая функция s-орбитали положительна во всей области пространства. р-Орбиталь имеет форму гантели (объемная «восьмерка»). В атоме все три p-орбитали ориентированы взаимно перпендикулярно. У каждой р-орбитали есть узловая плоскость (соответственно yz, xz и ху), в которой ее волновая функция меняет свой знак.
Показанные выше изображения АО (и соответствующие им наборы квантовых чисел) справедливы независимо от того, имеются на АО один или два электрона, или не имеется ни одного.
В образовании химических связей принимают участие лишь электроны, занимающие АО с главным квантовым чистом n, равным номеру периода, т. е. валентные электроны - электроны, находящиеся во внешних (валентных) слоях атомов. Предпочтительность орбиталей валентного слоя для связывания определяется тем, что электроны внутренних слоев очень прочно связаны с ядром. Заполнение электронами орбиталей и число валентных электронов атомов различных элементов приведены в табл.
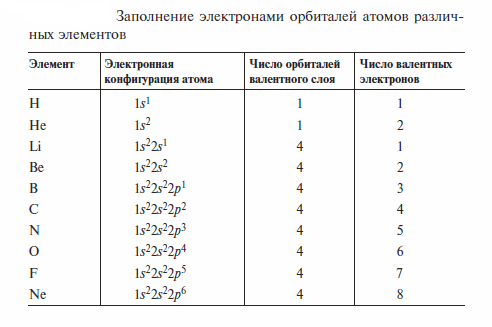
В 1915—1916 гг. В. Коссель и Г.Льюис предположили, что связи между атомами в органических молекулах имеют ковалентный характер и осуществляются за счет обобщенных пар электронов. Они полагали, что каждый из атомов, связанных ковалентной связью, вносит в нее по одному электрону. Льюис впервые сформулировал правило октетов: каждый атом стремится к заполнению вокруг себя устойчивой оболочки инертного газа. Для атома водорода такой оболочкой является двух электронная оболочка гелия; для атомов 2-го периода — восьмиэлектронная оболочка неона. Каждый электрон в формуле Льюиса изображают точкой.
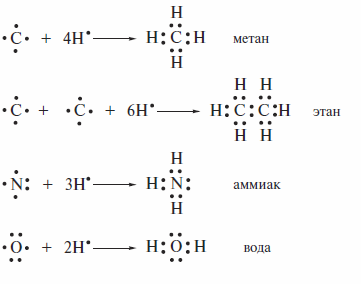
Формулы, показывающие число электронов в связях и неподеленные электронные пары (НЭП) на гетероатомах, получили название «формулы Льюиса». Такие формулы могут быть составлены и для соединений с кратными связями. При этом должно соблюдаться основное правило: каждой черточке в структурной формуле соответствует пара электронов в формуле Льюиса.
Ниже для ряда простых молекул сравниваются формулы Льюиса и структурные формулы.
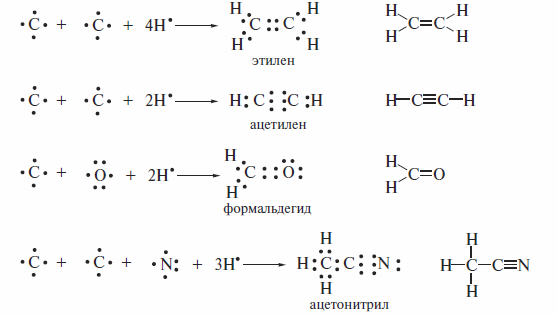
Формулы Льюиса показывают, что кратные связи содержат четыре (двойная связь) или шесть (тройная связь) электронов.
Обратимся к строению органических соединений углерода и рассмотрим электронное строение самого атома. Электронная конфигурация основного состояния атома углерода 1s22s22р2.

Следовательно, можно представить, что добавление двух электронов (от двух водородных атомов) к частично занятым 2р-орбиталям должно дать соединение СН2, где валентность углерода равна двум.

На самом деле простейшее органическое соединение углерода - метан (CH4), где атом углерода имеет валентность 4. Для того чтобы воссоздать картину атома углерода, удерживающего при себе четыре группы, необходимо обратиться к его возбужденному электронному состоянию. Возбужденное состояние атома включает образование четырех новых внешних орбиталей путем «гибридизации»(смешивания) 2s- орбитали и всех трех 2р-орбиталей. Четыре гибридные орбитали обладают одинаковой энергией, и каждая из них обозначается 2 sp3 (2 означает главное квантовое число, а sp3 указывает на то, что орбиталь является гибридной и состоит на одну четверть из s-орбитали, а на три четверти из р-орбиталей).
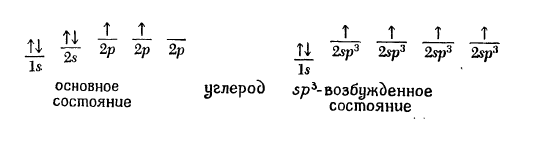
Этот процесс смешивания орбиталей можно представить следующим образом:
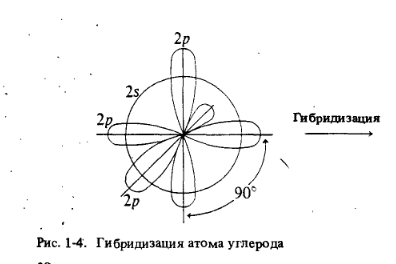
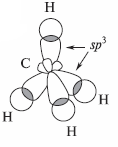
Каждая из этих орбиталей атома углерода образует связь с 1s орбиталями атома водорода.Чтоб свести до минимума отталкивание между этими четырьмя электронными парами, нужно направить их к вершинам тетраэдра, в центре которого будет находиться углерод. Поскольку водороды метана удерживаются этими электронными парами, мы приходим к заключению: молекула метана должна представлять собой тетраэдр.


Четыре гибридные орбитали атома углерода, перекрывающиеся в молекуле метана с s-орбиталями атомов водорода, образуют σ-орбитали. Связи, возникшие в результате перекрывания орбиталей вдоль линии, соединяющей ядра атомов, называют σ-связями. Электроны С—Н-связей в молекуле метана находятся, таким образом, на σ-орбиталях.
Состояние, близкое к состоянию sp3 -гибридизованного атома углерода, характерно и для атомов других элементов, имеющих в органических молекулах число связей и НЭП, равное четырем:
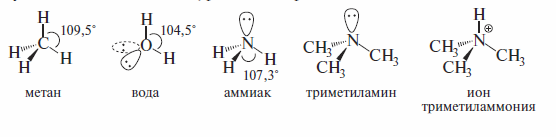
Поскольку НЭП более диффузны (занимают больший объем), чем электронные пары связей, углы между связями N—Н и О—Н несколько меньше, чем тетраэдрические (109,5°). В соответствии с этим считается, что сила отталкивания электронных пар уменьшается в направлении:
неподеленные электронные пары > электронные пары связей.
ПАРАМЕТРЫ КОВАЛЕНТНОИ СВЯЗИ
Параметры, характеризующие ковалентные связи, весьма многообразны. В этом разделе рассмотрены наиболее важные из них, в первую очередь — параметры, определяющие свойства молекул, в том числе их реакционную способность.
Энергия связи
Энергия связи представляет собой среднюю величину энергии, требуемую для гемолитического разрыва связи (энергия диссоциации). Гомолитическим называют разрыв ковалентной связи, в результате которого каждый из атомов, участвующих в ее образовании, сохраняет один электрон:
![]()
Этот способ следует отличать от гетеролитического разрыва, в результате которого один из атомов, участвующих в ее образовании, сохраняет оба электрона.
Энергия диссоциации молекулы А2 противоположна по знаку энергии, выделяющейся при образовании этой молекулы из атомов.
Ниже приведены значения энергии некоторых связей.

Анализ этих значений позволяет выявить ряд закономерностей:
1) повышение кратности увеличивает энергию связи;
2) л-связь менее прочна, чем σ-связь; например, в молекуле этилена энергия л-связи равна:
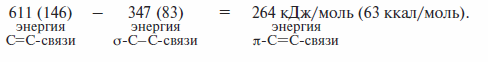
Длина связи. Ковалентный радиус атома
Длину связи удобнее всего определять на примере двухатомных молекул. Поскольку атомы в молекулах колеблются вдоль линий связей, под длиной связи следует понимать равновесное расстояние между центрами атомов. Длину связи обозначают буквой r. Половина длины ковалентной связи в симметричной молекуле, например CI—C1, называется ковалентным радиусом атома элемента.
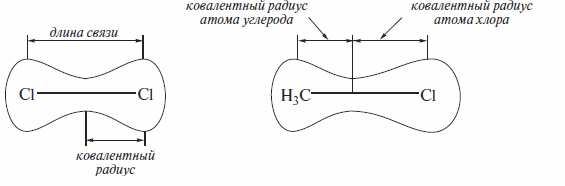
С ростом порядкового номера элемента ковалентный радиус его атома возрастает, а длины соответствующих связей увеличиваются.

Изменение гибридизации орбиталей атома ведет к изменению его ковалентного радиуса и длины его связей с другими атомами.

Полярность связи
По правилу октетов Льюиса, каждый из атомов, которые связаны ковалентной связью, вносит в нее по одному электрону. Однако лишь в некоторых ковалентных связях пара электронов равномерно распределена в области перекрывания орбиталей между атомами. Такое распределение электронов характерно прежде всего для молекул, образованных одинаковыми атомами:
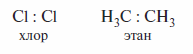
Поэтому ковалентные связи Cl—Cl и С—С, например, в молекулах хлора и этана являются неполярными. Кроме С—С-связей в углеводородах к неполярным часто относят и С—Н-связи. Однако эти связи правильнее рассматривать как малополярные.
Связи атома углерода с атомами большинства элементов являются полярными: пара электронов в них смещена в сторону более электроотрицательного атома:

Электроотрицательность — способность атома притягивать электроны собственной электронной оболочки: чем больше электроотрицательность элемента, тем сильнее притяжение между ядром и внешними (валентными) электронами.
Известно несколько шкал электроотрицательности. Наиболее распространена шкала Полинга
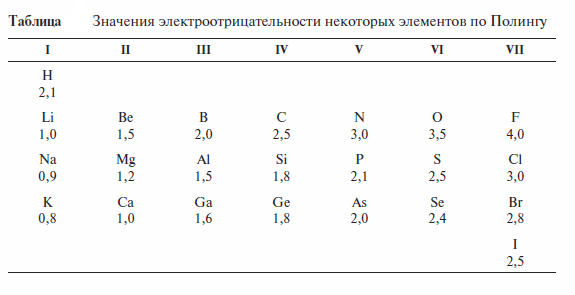
Сравнение значений электроотрицательности атомов, образующих связь, позволяет оценить полярность этой связи. Полярность связи, таким образом, понимают как меру смещения электронной плотности к одному из атомов вследствие различий величин их электроотрицательности. Величины полярности связей оценены и по экспериментальным данным, в частности на основе измерения значений дипольных моментов.

Дипольныи момент μ — функция длины связи (r) и заряда (q) на связанных атомах (измеряется в дебаях):
![]()
Дипольный момент — векторная величина, имеет направление от положительного к отрицательному заряду и изображается стрелкой над связью: