
Альдегиды и кетоны
.docxАльдегиды и кетоны
Функциональная группа С=О карбонильная
RCH=O альдегиды
RCOR1 кетоны
Альдегиды по номеклатуре IUPAC имеют суффикс аль
НСОН муравьиный альдегид метаналь
СН3СН=О уксусный альд. этаналь
СН3СН2СН=О пропионовый альд. пропаналь
СН3(СН2)2СН=О масляный альд. бутаналь
4 3 2 1
СН3СН(СН3)СН2СН=О изовалериановый 3-метилбутаналь
Нумерация начинается с углерода альдегидной группы
Кетоны по номеклатуре IUPAC имеют суффикс он
СН3СОСН3 ацетон пропанон
По рациональной номенклатуре кетоны называют по радикалам,связанным с карбонильной группой, ацетон это- диметилкетон
1 2 3 4 5
СН3СОСН2СН(СН3)СН3 4-метил-2-пентанон, карбонильный С должен иметь
наименьший номер, по рациональной номенклатуре- метилизобутилкетон.
СПОСОБЫ ПОЛУЧЕНИЯ
1.Окислением или дегидрированием первичных спиртов получают альдегиды, вторичных- кетоны

2.Гидролиз геминальных дигалогенпроизводных
СН3СН2СНCl2 + HOH → СН3СН2СН=O + 2 HCl
CH3C(Cl)2CH3 + HOH → CH3C(O)CH3 + 2 HCl
3. Гидратация ацетиленовых углеводородов
Из ацетилена образуется уксусный альдегид, из других ацетиленовых углеводородов- кетоны

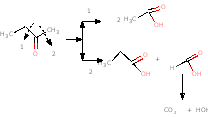
4.Пиролиз кислот
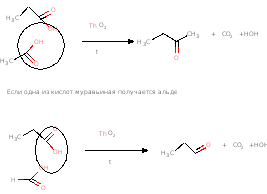
Можно подвергать пиролизу кальциевые соли кислот, выход не всегда хороший
(СН3СОО)2Са → СН3СОСН3 + СаСО3
5. Оксосинтез ( только для альдегидов),как правило получается смесь 2-х альдегидов
t, p, Co- катализатор(кобальт)
RCH=CH2 + CO + H2 → RCH2CH2CH=O + RCH(CH3)CH=O
Альдегидная группа может присоединиться к любому из, связанных двойной связью, атомов
углерода.
ХИМИЧЕСКИЕ СВОЙСТВА
∂+ ∂-
Связь С=О полярна, электронная плотность смещена к атому кислорода, след. на углероде
возникает ∂+ и он может подвергаться атаке нуклеофильным реагентом. Для карбонильных
соединений характерны реакции нуклеофильного присоединения, причем отрицательная часть
заряженной молекулы присоединяется к углероду, а положит. к кислороду.
N- → С=О и реакция начинается с атаки нуклеофила.
Важным фактором является величина ∂+ на атоме углерода, заместители повышающие ∂+
увеличивают реакционную способность, понижающие- уменьшают, поэтому легче всего вступает в реакции нуклеофильного присоединения НСН=О (метаналь), затем другие альдегиды и труднее
всего кетоны т.к. две алкильные группы за счет положительного индуктивного эффекта 2-х алкильных радикалов больше снижают ∂+ на атоме углерода карбонильной группы
R→C(O)←R. Кроме того имеет значение и стерический фактор, два объемных радикала затрудняют подход нуклеофила к карбонильному атому углерода.
1.Присоединение HCN ( реакция идет и для альдегидов и для кетонов)

2. Присоединение гидросульфита натрия
В реакцию вступают альдегиды и только метилалкилкетоны-СН3СО R
RCH=O + NaHSO3 → RCH(OH)SO3Na
Атом серы присоединяется к углероду, а водород к кислороду.
3. Присоединение алкилмагнийгалогенидов-реактивов Гриньяра
Реагируют и альдегиды и кетоны

4.Присоединение спиртов. Реагируют только альдегиды.
В присутствии основного катализатора образуются полуацетали, в присутствии кислоты-
полный ацеталь альдегида.

В кислой среде полуацеталь реагирует с еще одной молекулой спирта.
5.Взаимодействие с аммиаком. Реагируют только альдегиды.

6. Взаимодействие с гидроксиламином. Реагируют и альдегиды и кетоны.

7.Взаимодействие с гидразином и фенилгидразином. Реагируют и альдегиды и кетоны.
RCH=O + NH2NH2 → RCH=N-NH2 + HOH
Гидразон альдегида
RCOR + NH2NHPh → R2C=N-NHPh +HOH Ph- фенил
Фенилгидразон кетона
8. Взаимодействие с PCl5. Реагируют и альдегиды и кетоны.
RCH=O + PCl5 → RCHCl2 +POCl3
RCOR + PCl5 → RC(Cl2)R +POCl3
9. Взаимодействие с алкиламинами. Реагируют альдегиды.
RCH=O + H2NCH2CH2CH3 → RCH=NCH2CH2CH3 + HOH
10. Альдольная конденсация.
Реакция идет за счет подвижного атома водорода в α-положении к карбонильной группе,
которая оттягивает электронную плотность, и может стабилизировать образующийся при
отщеплении протона анион за счет мезомерного эффекта. Катализаторами процесса служат
основания, например ОН-

В результате альдольной конденсации получается гидроксиальдегид или альдоль, если его
нагревать, то отщепляется вода и образуется непредельный альдегид и конденсация, в этом
случае, называется кротоновой.
В случае, например, масляного альдегида водород отщепляется от положения соседнего с
альдегидной группой : _
СН3СН2СН2СН=О +ОН- → СН3СН2СНС=О + НОН
Из кетонов в этих условиях также реагирует только ацетон.
Если у альдегида нет атомов водорода у соседнего с карбонильной группой атома углерода,
то альдольная конденсация не идет, в присутствии конц. раствора щелочи протекает другая
реакция – Канниццаро: ( СН3)3ССН=О + КОН → (СН3)3ССН2ОН + (СН3)3ССООК
11.Реакция галогенирования
У альдегидов и кетонов при действии галогенов (брома или хлора) замещается на галоген
атом водорода в α-положении к карбонильной группе ( катализаторами служат кислоты
или щелочи)
СН3СН2СН=О + Br2 → CH3CHBrCH=O +HBr
12.Реакция Тищенко- сложноэфирная конденсация. Только для альдегидов.
Катализаторами реакции служат алкоголяты алюминия, в реакции образуется сложный эфир.
Al(OR)3
2СН3СН=О → СН3СООСН2СН3
12. Полимеризация альдегидов
В кислой среде альдегиды тримеризуются

13. Окисление
Альдегиды окисляются легко- кислородом, перекисями, KMnO4,MnO2, хромовой смесью и т.д.,
с образованием соответствующих кислот
RCH=O → RCOOH
Реакция окисления альдегидов аммиачным раствором окиси серебра позволяет отличить
альдегид от изомерного ему кетона, поскольку кетоны в этих условиях не окисляются
t
RCH=O + 2 Ag(NH3)2OH → RCOONH4 + 2 Ag + 3 NH3 +HOH
Это реакция» серебрянного зеркала»
Кетоны окисляются в жестких условиях при этом происходит разрыв С-С связи, образуются
смеси карбоновых кислот
Реакции отличающие альдегиды от кетонов-это те реакции, которые идут только для альдегидов
1.Взаимодействие с аммиаком
2.Присоединение спиртов
3.Реакция «серебрянного зеркала»
4. Сложноэфирная конденсация (Тищенко)
5.Полимеризация
