
Алкены
Ненасыщенные углеводороды, содержащие двойную связь и образующие гомологический ряд общей формулы СnН2n, называют алкенами. Тривиальное название алкенов (в настоящее время устаревшее) — олефины.
Номенклатура и изомерия
По номенклатуре ИЮПАК название алкена происходит от названия соответствующего алкана заменой суффикса -он на -ен. Аналогично образуют названия циклоалкенов.
Ниже даны примеры названий алкенов по этой номенклатуре (в скобках приведены тривиальные названия).
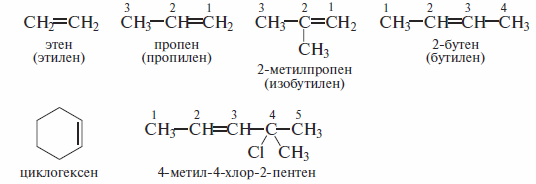
На примере названия 4-метил-4-хлор-2-пентена видно, что при составлении названия органического соединения двойная связь имеет приоритет перед алкильными группами и галогенами.
Алкены могут существовать в виде геометрических изомеров.
Поскольку фрагменты молекулы алкена не имеют возможности вращаться относительно двойной связи, заместители у углеродных атомов при этой связи могут располагаться как по одну, так и по разные стороны.
Стереоизомеры, различающиеся расположением заместителей относительно двойной связи, называют геометрическими изомерами.
Для обозначения геометрических изомеров применяют две номенклатуры: цис,транс и Е,Z
В соответствии с цис,транс-номенклатурой геометрические изомеры, в которых заместители расположены по одну сторону относительно двойной связи, называют цис-изомерами.
Геометрические изомеры, в которых заместители расположены по разные стороны относительно двойной связи, называют транс-изомерами.
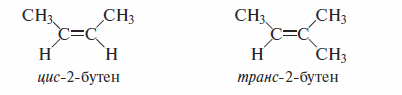
Если в качестве заместителей выступают углеводородные радикалы, преимущество при определении конфигурации алкена имеют радикалы с более длинной углеродной цепью.
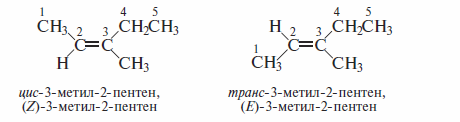
Способы получения
Большая часть способов получения алкенов как в лаборатории, так и в промышленности основана на реакциях элиминирования(отщепления). Двойная связь в субстрате образуется в этих реакциях за счет отщепления от молекулы исходного вещества молекулы водорода, галогена, воды или галогеноводорода.
1. Дегидрирование и крекинг алканов
Дегидрирование алканов служит основным источником алкенов в промышленности. В качестве катализатора применяют триоксид хрома. Процес< проводят при высокой температуре (до 450 вС). Этим методом из этана получают этилен, из н-бутана — бутены, а из изобутана — изобутилен:
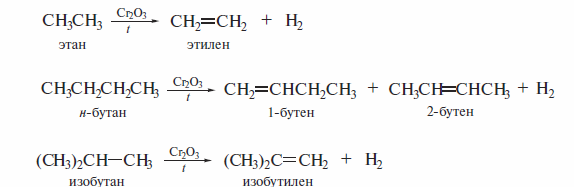
2. Дегалогенирование вицинальных лигалогеналканов
Эту реакцию, как правило, проводят действием Zn-пыли на 1,2-дигалоген алкан (виц-дигалогеналкан) в спиртовом или уксуснокислом растворе.

3).Дегидратация спиртов (элиминирование)

Отщепление воды от спиртов проводят нагреванием спирта при высокой температуре в присутствии сильных минеральных кислот (H2S04, H3P04). При этом сначала образуется сложный эфир, который наряду с этиленом дает молекулу кислоты. Дегидратацию этанола ведут при 180º С.
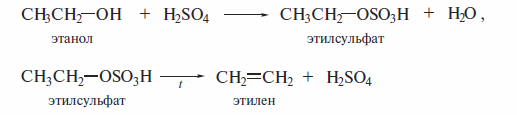
Дегидратацию гомологов этанола проводят при более низкой температуре. Если возможно получение нескольких изомеров, то преимущественно образуется более замещенный алкен
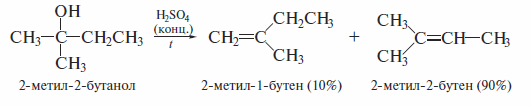
По
другому способу спирт пропускают в
парах нал твердым катализатором (Аl2O3,
оксиды тория или вольфрама). Температура
при этом достигает 300—350 °С, а выход
алкена приближается к 100 %.
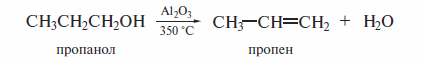
4). Дегидрогалогенирование галогеналканов
![]()
Процессу дегидрогалогенирования способствуют высокая основность реагента и повышенная температура. В качестве основания применяют спиртовые растворы NaOH или КОН или амины (анилин, пиридин, хинолин).
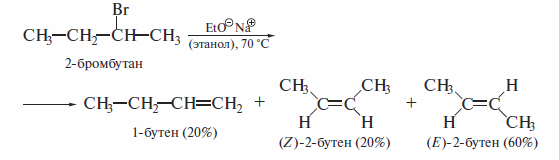
Как видно из приведенных данных, реакции дегидратации и дегидрога-
логенирования протекают регио- и стереоселективно. Изомерный состав
продуктов этих реакций элиминирования определяется правилом Зайцева.
Правило Зайцева. При дегидрогалогенировании галогеналканов и дегид-
ратации спиртов протон отщепляется преимущественно от наименее
гидрогенизированного {имеющего меньшее число атомов водорода)
атома углерода (1875 г.).
Одним из факторов, объясняющих это эмпирическое правило, является
различная устойчивость изомерных алкенов: при дегидратации и дегидро-
галогенировании образуется наиболее замещенный, термодинамически бо-
лее устойчивый алкен. Стереоселективность реакции определяется боль-
шей устойчивостью транс-изомера .
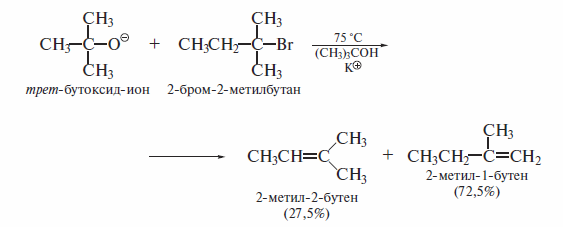
При применении пространственно затрудненного основания в реакции дегидрогалогенирования наблюдается нарушение правила Зайцева. Например, нагревание 2-бром-2-метилбутана с трет-бутоксидом калия в третичном бутиловом спирте дает 27,5% 2-метил-2-бутена и 72,5% 2-метил-1-бутена:
4).Восстановление ацетиленовых углеводородов и диенов
Эти реакции требуют применения специальных катализаторов.
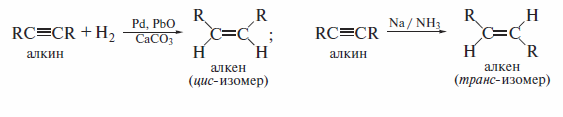
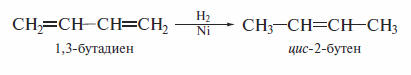
Электронное строение
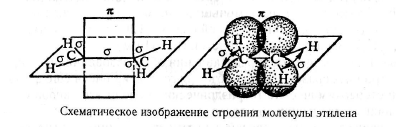
Электронное строение алкенов иллюстрируется ниже на примере этилена.
В терминах правша октетов электронное строение этилена представляется следующей формулой Льюиса:
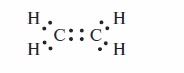
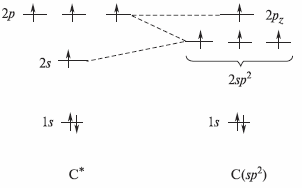
При образовании двойных связей в молекулах этиленовых соединений мы встречаемся с гибридизацией одной s- и двух р-орбиталей углерода с образованием трех эквивалентных гибридных орбиталей, называемых sр2-орбиталями.
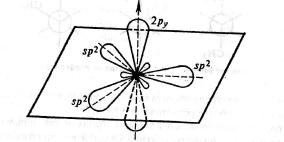
Ось чертвертой атомной p-орбитали, не затронутой гибридизацией, расположена под прямым углом к плоскости, в которой лежат три оси sр2 -гнбридных орбиталей.
Ниже показаны формирование sp2-гибридных АО атома углерода
Связи, находящиеся в плоскости молекулы этилена, являются σ-связями. 2p-орбитали атомов углерода перпендикулярны плоскости молекулы; они негибридизованы и образуют π-связь.
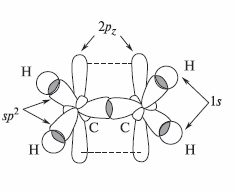
Другими словами двойная связь образована за счет перекрывания вдоль линии С - С-связи sp2-гибридных орбиталей атомов углерода (σ-связь) и бокового перекрывания негибридизованных углеродных 2pπ-орбиталей (л-связь).

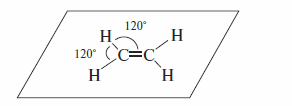
Все атомы в молекуле этилена лежат в одной плоскости, углы между связями
равны 120°, а атомы углерода находятся в sр2-гибридизации.
Физические свойства
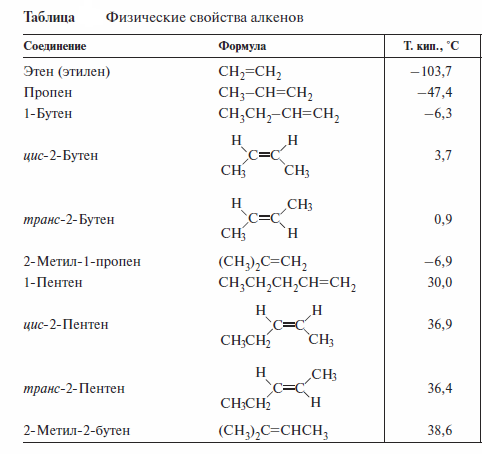
Некоторые физические свойства ряда алкенов приведены в таблице. Эти свойства подобны свойствам соответствующих алканов.
Низшие алкены (С2—С4) являются газами. Средние алкены (начиная с С5) — жидкости, не смешивающиеся с водой. Высшие алкены (начиная с С18) — твердые вещества. Изомерные алкены имеют близкие температуры кипения, причем 1-алкены кипят несколько ниже, чем их изомеры с внутренней двойной связью. транс-Изомеры имеют более низкие температуры кипения.
Особого внимания заслуживает сравнение термодинамической устойчивости изомерных алкенов. Ниже в качестве примера приведен ряд возрастания (слева направо) термодинамической устойчивости изомерных бутенов, который составлен на основе экспериментальных данных теплот гидрирования:
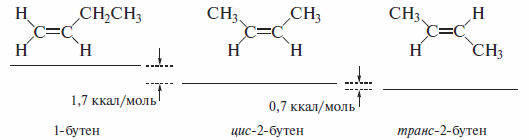 Дизамешенные
алкены (цис-
и
транс-2-бутены)
более устойчивы, чем монозамещенные
(1-бутен) вследствие аддитивности
стабилизирующего индуктивного эффекта
метильных (алкильных) групп, транс-2-бутен
более устойчив, чем цис-2-бутен,
благодаря наличию в последнем
пространственного отталкивания метильных
групп, находящихся у соседних атомов
углерода.
Дизамешенные
алкены (цис-
и
транс-2-бутены)
более устойчивы, чем монозамещенные
(1-бутен) вследствие аддитивности
стабилизирующего индуктивного эффекта
метильных (алкильных) групп, транс-2-бутен
более устойчив, чем цис-2-бутен,
благодаря наличию в последнем
пространственного отталкивания метильных
групп, находящихся у соседних атомов
углерода.
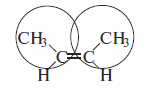
Хотя различие в энергиях образования изомерных цис- и транс-алкенов составляет не более I ккал/моль, энергая активации для перехода одного изомера в другой очень велика — -272 кДж/моль (65 ккал/моль). Это объясняется тем, что указанный переход требует разрыва π-связи.
Химические свойства(реакции) алкенов
Главной структурной особенностью, определяющим реакционную способность олефинов, является двойная связь, представляющая собой сочетание σ- и л-связей (sp2-гибридизация). По энергетическим причинам (энергия двойной связи меньше, чем энергия двух ординарных) двойная связь легко переходит в две ординарные σ-связи путем присоединения по месту двойной связи двух атомов или атомных групп. Таким образом, для олефииов наиболее типичны реакции присоединения.
