
ргр1 26 вар
.docx
Министерство науки и высшего образования Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего образования
«Магнитогорский государственный технический университет
им. Г.И. Носова»
Кафедра металлургии и химических технологий
Термодинамика процессов горения топлива
Домашнее задание по дисциплине
«Физико-химические основы металлургических процессов»
вариант 26
Выполнил:
Проверил:
Магнитогорск
ФОРМУЛИРОВКА ЗАДАНИЯ
Задача №1. Для реакции водяного газа:
 (1)
(1)
определить возможное направление реакции и равновесный состав газа при соответствующих температурах и составе исходной смеси (табл. 1).
Уравнение зависимости константы равновесия от температуры имеет вид:
 (2)
(2)
Определить аналитически и графически температуру, при которой исходная смесь будет находиться в равновесии.
Задача 2. Для реакции:
 (3)
(3)
уравнение зависимости константы равновесия от температуры имеет вид:
 (4)
(4)
определить равновесный состав газа в зависимости от температуры и давления (табл. 2). Полученные значения представить в виде таблицы и графика.
Таблица 1
Температура и состав исходной смеси для реакции водяного газа
(исходные данные для задачи № 1)
Вариант |
Температура, ОС |
Состав исходной газовой смеси |
|||||||||||
% СО |
% |
% С |
%
|
||||||||||
26 |
500 |
600 |
700 |
800 |
900 |
15 |
15 |
15 |
55 |
||||
Таблица 2
Значение температуры и давления для реакции
(исходные данные для задачи №2)
Вариант |
Температура, ОС |
Давление (атм.) |
|||||||
26 |
500 |
600 |
700 |
800 |
900 |
0,15 |
1,5 |
15 |
|
Задача №1:
Равновесный состав газа в реакции водяного газа:
(1)
Данная реакция имеет место во многих процессах горения топлива, определяя в значительной степени состав газа в доменной печи при взаимодействиях водяного пара с коксом при мокром и сухом тушении.
Равновесие реакции количественно характеризуется константой равновесия:
 (2)
(2)
Данная система трехкомпонентная и однофазная, поэтому:
C = k – f + n = 3 – 1 + 1 = 3
Значит, равновесный состав газа зависит от трех факторов: температуры Т и двух исходных концентраций.
Константа равновесия реакции может быть рассчитана по эмпирическому уравнению:
 (3)
(3)
 (4)
(4)
По условию задачи известен исходный состав газа:
15 % СО, 15 %
,
15 %
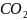 ,
55 %
.
,
55 %
.
Значит, в 100 моль исходного газа содержалось такое же количество моль каждого компонента:

Допустим, что при некоторой температуре tOC реакция возможна в прямом направлении и к моменту достижения равновесия прореагирует Х моль СО с Х моль , и появилось Х моль и Х моль . Тогда при равновесии количества молей газов (об. %)
(15 – Х) моль СО (15 – Х) моль
(15 + Х) моль (55+ Х) моль
 (5)
(5)
Решая уравнение (5) относительно Х при различных температурах, получу два значения корня уравнения, приведенных в таблице 1.
Таблица 1
Расчетные данные
tOC |
|
|
|
% СО |
% |
% |
% |
500 |
5,306 |
1,66 |
51,56 |
13,3 |
13,3 |
16,6 |
56,6 |
600 |
2,762 |
-1,311 |
88,07 |
16,3 |
16,3 |
13,7 |
53,7 |
700 |
1,645 |
-3,74 |
188,77 |
18,8 |
18,8 |
11,3 |
51,2 |
800 |
1,08 |
-5,66 |
1285,66 |
20,6 |
20,6 |
9,3 |
49,3 |
900 |
0,760 |
-7,2 |
-379,5 |
22,2 |
22,2 |
7,8 |
47,8 |
Из таблицы следует, что только корень имеет физический смысл. По знаку этого корня оценю возможные направления реакции при каждой температуре. Направление процесса можно определить по известному уравнению изотермы Вант-Гоффа:
 (6)
(6)
 =
= = 3,6
= 3,6
При 500 C , значит
, значит
 ,
реакция прямая (протекает слева направо).
,
реакция прямая (протекает слева направо).
При 600,700,800,900
 значит
значит
 ,
прямая обратная (справа налево)
,
прямая обратная (справа налево)
Температура, при которой исходная смесь находится в равновесии:
 OC
(7)
OC
(7)
Таблица 1 иллюстрирует влияние температуры на равновесный состав газа. Повышение температуры вызывает увеличение концентрации исходных веществ, т.е. равновесие смещается в обратном направлении (справа налево). Это характерно для экзотермических реакций.
Оценю среднее значение теплового коэффициента реакции:
 (8)
(8)
С учетом уравнения (3), получаем:

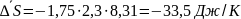
Равновесная температура для исходной смеси может быть найдена и графически:
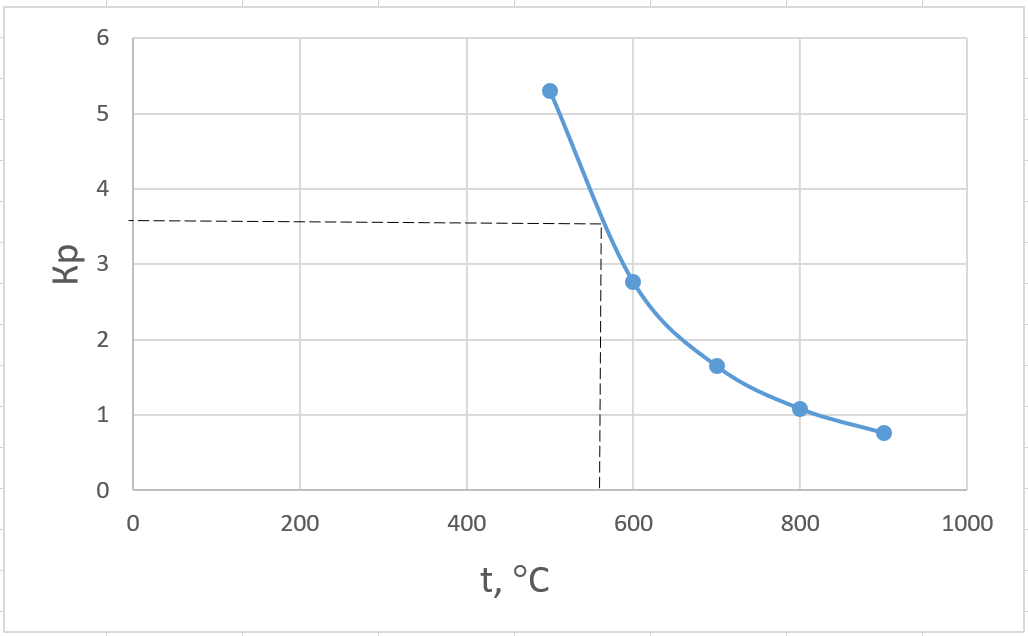
Рис. 1. К определению равновесной температуры
Задача №2:
Равновесный состав газа в реакции: (1)
Данная реакция имеет место во всех процессах взаимодействия газовой фазы с твердым углеродом в коксохимическом производстве и металлургии. Поскольку система двухкомпонентная и двухфазная, то вариантность по правилу фаз Гиббса равна:
C = k – f + n = 2 – 2 + 2 = 2
то есть равновесный состав зависит от двух параметров температуры Т и давления Р.
% СО =

 (2)
(2)
Уравнение зависимости константы равновесия для реакции (1) имеет вид:
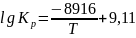
Тогда
 (3)
(3)
Пусть %
 + %
=
100 %
(4)
+ %
=
100 %
(4)
Приведу уравнение (2) к стандартному виду квадратного уравнения, получу:
 (5)
(5)
Решая это квадратное уравнение относительно % , найду состав газа при разных давлениях (табл. 2).
Таблица 2
Равновесный состав газа
tOC |
|
Об. %СО при давлениях (атм) |
||
0,15 |
1,5 |
15 |
||
500 |
0,004 |
15 |
5 |
1,6 |
600 |
0,079 |
50,9 |
20,5 |
7 |
700 |
0,884 |
87,1 |
52,8 |
21,5 |
800 |
6,32 |
97,7 |
83,5 |
47,2 |
900 |
32,28 |
99,5 |
95,7 |
74,3 |
Данные расчета представлены на рис. 2.

Рис. 2. Равновесный состав газа при разных давлениях
Из таблицы 2 и
рисунка 2 следует, что повышение
температуры вызывает увеличение
 и смещение равновесия реакции вправо,
что характерно для эндотермических
процессов.
и смещение равновесия реакции вправо,
что характерно для эндотермических
процессов.

Увеличение давления смещает равновесие влево, так как в этом направлении уменьшается число моль газов.





 моль
моль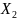 моль
моль