
задачи
.docxМинистерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего образования «Магнитогорский государственный технический университет им. Г.И.Носова»
Кафедра металлургии и химической технологии
Домашнее расчетное задание по дисциплине
«Техническая термодинамика и теплотехника»
Вариант 26
Выполнил
Студент гр.
Проверил
Ст. преподаватель
Магнитогорск
Пример решения
Задача 1
Рассчитаем горение твердого топлива с элементным анализом на сухую массу:
Элементный состав на сухую массу, масс.% |
Wᴾ, % |
коэффициент избытка воздуха α |
||||||
C |
H |
O |
S |
N |
|
|
||
88 |
5 |
6 |
0,5 |
0,5 |
5,5 |
1,5 |
||
1) Определим необходимый объем кислорода на горение твердого топлива;
2) Определим состав и объем продуктов горения твердого топлива;
3) Определим калориметрическую температуру горения твердого топлива.
Для расчета используем следующие данные:
-коэффициент избытка воздуха 1,45;
- относительная влажность воздуха 0,65;
- атмосферное давление 95 кПа;
- парциальное давление водяного пара 9,84 мм. рт. ст.;
- температура поступающего из атмосферы воздуха 11 0С;
- температура нагрева воздуха 400оС;
- пиротехнический коэффициент 0,75.
1) Рассчитаем количество кислорода на горение твердого топлива.
Для расчета необходимо перевести состав с сухой на рабочую массу. Для этого воспользуемся следующим уравнением:

где Wр = 5,5 %. Тогда:
Ср= 88*(100 – 5,5)/100= 83,16%
Hр= 5* 5,5 = 4,725 %
Nр = 0,5*5,5 = 0,4725 %
Sр = 0,5 * 5,5 = 0,4725 %
Oр = 6* 5,5 = 5,67 %
Σ = 100 %
Найдем количество кислорода, идущего на горение твердого топлива. Расчёт ведем на 100 кг топлива. Горение топлива можно представить следующими реакциями:
C + O2 = CO2
12,00 22,40
4,125 23,1
4H + O2 = 2H2O
4 22,40
2,625 1,84 1,84
S + O2 = SO2
32,00 22,40
Количество кислорода, требуемого для сжигания 100 кг топлива:
VO2=155.232+31.752+0.33075
= 183,3458 м /100
кг
/100
кг
Количество азота поступающего на горение воздуха:
VN2=
183.3458* =
689,7293
м
/100
кг
=
689,7293
м
/100
кг
Необходимое для полного сжигания твердого топлива количество воздуха составит
- теоретическое:
Vтв= VO2 + VN2=183,3458 + 689,7293 = 873,075 м /100 кг.
- действительное:
Vдв = Vтв*α = 873,075 *1,5 = 1034,594 м /100 кг
ρO2 = MO2/22,4 = 32/22,4 = 1,42 кг/м3
ρN2 = 1,25 кг/м3
ρH2O = 0,80 кг/м3
Определяем количество и состав продуктов горения. Результаты расчетов представлены в табл. 3.7.
Таблица 1
Состав и количество продуктов горения твердого топлива, м3/100кг
Элемент |
CO2 |
H2O |
SO2 |
N2 |
O2 |
∑ |
C |
155,232 |
|
|
|
|
|
H |
|
52,92 |
|
|
|
|
S |
|
|
0,33075 |
|
|
|
N топл |
|
|
|
0,378 |
|
|
N2 из возд |
|
|
|
669,8213 |
|
|
H2O |
|
6,875 |
|
|
|
|
H2O из возд |
|
26,88660394 |
|
|
|
|
Альфа=1 |
155,232 |
86,68160394 |
0,33075 |
670,1993 |
0 |
912,4436 |
альфа=1,45 |
155,232 |
98,78057571 |
0,33075 |
971,6188 |
80,12419 |
1306,086 |
Доли |
0,118853 |
0,07563097 |
0,00025324 |
0,743916 |
0,061347 |
1 |
Воздух на горение поступает влажный. Влагосодержание рассчитывается по формуле:
Хвозд = 0,622* φ* Рнас/ (В - φ*Рнас) =
= 0,622*0,95*33,7*133,3/ (97000-0,95*33,7*133,3) = 0,028625 кг/кг.
VN2 газ возд =VN2возд*α = 689,7293*1,5=1035,161 м3/100 кг.
VN2топл=mN2/ρN2=0,4275/1,25=0,378
Определим количество водяного пара, поступающего с воздухом на горение:
VH2Oвозд = х* Vтв*22,4/МН2О = 0,028625 *873,075 *22,4/18 = 31,10066 м3/100 кг.
Объем избытка кислорода:
VизбО2 = VтО2*(αmax – 1) =183.3458 *(1,5 - 1) = 91,672875 м3/100 кг.
Рассчитаем теплоту горения топлива по формуле Менделеева:
Qрн = 0,339*Ср + 1,03*Hр - 0,109*(Oр - Sр) - 0,0251*Wр=
= 0,339*83,16 + 1,03*4,725- 0,109*(5,67–0,4725) - 0,0251*5,5 = МДж/кг.
Начальная энтальпия продуктов горения составит:
Iнач = (Qрн + Qв)/Vдпг = (+)/= 3373,52 кДж/кг.
Физическая теплота, вносимая подогретым воздухом, определяется как:
Qв = Vдв*I400 /100 = */100 = 2976,93 кДж/кг.
Используя справочные данные, определим, при какой температуре продукты горения твердого топлива, приведенного в табл. 3.7. состава имеют начальную энтальпию, близкую к расчетной. Результаты вычислений представлены в табл. 3.8.
Таблица 2
Начальные энтальпии смеси продуктов горения твердого топлива при различных температурах
Компонент |
Доли |
I 1700, кДж/м^3 |
Q, кДж/м^3 |
|
CO2+SO2 |
0,119106 |
4087,1 |
486,798233 |
|
H2O |
0,075631 |
3203,05 |
242,249778 |
|
N2 |
0,743916 |
2486,28 |
1849,58404 |
|
O2 |
0,061347 |
2632,09 |
161,47024 |
|
∑ |
2740,10229 |
|||
Таблица 3
Компонент |
Доли |
I 1900, кДж/м^3 |
Q, кДж/м^3 |
CO2+SO2 |
0,119106 |
4634,76 |
552,027838 |
H2O |
0,075631 |
3657,85 |
276,646744 |
N2 |
0,743916 |
2808,22 |
2089,08043 |
O2 |
0,061347 |
2971,3 |
182,279681 |
∑ |
3100,03469 |
||
Рассчитаем калориметрическую температуру горения топлива:
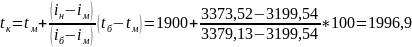 0С
0С
Действительная температура горения:
tд= tк*φ = 1996,9*0,75=1497,66 0С
Вывод: рассчитали необходимое для горения топлива воздух Vдв=559,49 м3/100м3; рассчитали количество и состав продуктов сгорания
Компонент |
Доли |
CO2+SO2 |
|
H2O |
|
N2 |
|
O2 |
|
рассчитали температуру горения tд=1497,66 0С
