
ph_lab_9
.docxМИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра физики
отчет
по лабораторной работе №9
по дисциплине «Физика»
Тема: Исследование термодинамических циклов
Студент гр. 1205 |
|
Агеев А.А. |
Преподаватель |
|
Мыльников И.Л. |
Санкт-Петербург
2021
Цель
работы:
исследование политропно-изохорно-изотермического
 и адиабатно-изохорно-изотермического
и адиабатно-изохорно-изотермического
 циклов.
циклов.
Приборы и принадлежности: баллон с воздухом, манометр, микрокомпрессор, лабораторные термометр и барометр.
Исследуемые закономерности
Определение
показателя политропы.
Первое начало термодинамики формулируется
следующим образом: сообщённое системе
количество теплоты
 расходуется на увеличение внутренней
энергии
расходуется на увеличение внутренней
энергии
 системы и совершение системой работы
системы и совершение системой работы
 :
:
 ,
,
где
 – теплоёмкость газа в изохорном процессе.
– теплоёмкость газа в изохорном процессе.
 -цикл.
Процесс расширения воздуха является
политропным, в котором теплоёмкость
газа С остаётся постоянной. Первое
начало термодинамики для политропного
процесса имеет вид
-цикл.
Процесс расширения воздуха является
политропным, в котором теплоёмкость
газа С остаётся постоянной. Первое
начало термодинамики для политропного
процесса имеет вид

 или
или

где
C – теплоемкость воздуха в политропном
процессе,
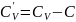 . Из этого соотношения с помощью уравнения
состояния идеального газа можно получить
уравнение Пуассона для политропного
процесса
. Из этого соотношения с помощью уравнения
состояния идеального газа можно получить
уравнение Пуассона для политропного
процесса
 или
или
 ,
где n – показатель политропы,
,
где n – показатель политропы,
 где
где
 и
–теплоемкости
газа в изобарном и изохорном процессах.
и
–теплоемкости
газа в изобарном и изохорном процессах.
SVT-цикл.
Предположим, что процесс расширения
воздуха является адиабатным. Адиабатный
процесс является одним из видов
политропных процессов, он происходит
без теплообмена с окружающей средой:
 и теплоемкость газа в этом процессе
и теплоемкость газа в этом процессе
 .
Поэтому показатель политропы в этом
процессе равен
.
Поэтому показатель политропы в этом
процессе равен
 и называется показателем адиабаты.
Взаимосвязь между параметрами состояния
в адиабатном процессе также описывается
уравнениями Пуассона либо объединенным
газовым законом.
и называется показателем адиабаты.
Взаимосвязь между параметрами состояния
в адиабатном процессе также описывается
уравнениями Пуассона либо объединенным
газовым законом.
Показатель
политропы
 может быть определён экспериментально:
может быть определён экспериментально:
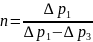
Зная , можно определить мольную теплоемкость газа в политропном процессе

где
 – показатель адиабаты, равный отношению
теплоемкостей газа в изобарном и
изохорном процессах,
– показатель адиабаты, равный отношению
теплоемкостей газа в изобарном и
изохорном процессах,
 ,
,
 ,
,
 – число
степеней свободы молекул газа, R=8,31
Дж/(K
– число
степеней свободы молекул газа, R=8,31
Дж/(K моль) –
универсальная газовая постоянная.
Воздух можно считать двухатомным газом,
для которого при небольших температурах
моль) –
универсальная газовая постоянная.
Воздух можно считать двухатомным газом,
для которого при небольших температурах


Протокол наблюдений
Лабораторная работа № 9
«Исследование термодинамических циклов»
Выполнил студент группы аааааааааа аааааааааааааааааааааааа
Таблица 9.1
p2, Па |
V1, л |
t1, °С |
T1, К |
|
|
|
|
Таблица 9.2
|
1 |
2 |
3 |
4 |
5 |
6 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Работа выполнена «___» _______ 2021 г. __________________
Контрольные вопросы:
В каких случаях изменение внутренней энергии системы равно количеству теплоты, подведенному к системе?
В изохорическом процессе, так как в нём работа не совершается.
Сформулируйте и выведите закон Бойля-Мариотта , используя основное уравнение кинетической теории газов и уравнение состояния газа.



Обработка результатов.
Рассчитаем избыточные давления
 ,
P=95%:
,
P=95%:
Исключим 10 опыт – очевидный промах








Рассчитаем показатель политропы
 на участке 1-2 nVT-цикла:
на участке 1-2 nVT-цикла:










Начальное состояние:



Состояние 1 (1*):


Состояние 2:





Состояние 2*:






Состояние 3:



Состояние 3*:

Процесс
изотермический, тогда




Изменения внутренней энергии:
1-2:



2-3:
3-1:

Работа газа:


Холодильные коэффициенты для nVT и SVT циклов:
Цикл nVT (1-2-3-1):

Цикл SVT (1-2*-3*-1):

Т.к.

Обратимый цикл Карно:
Для
T1,
T2:

Т.к.

Холодильные коэффициенты циклов Карно меньше холодильных коэффициентов nVT и SVT циклов в сл. Идеальности холодильной машины Карно.
Число молей воздуха в сосуде:
Мольная теплоемкость при постоянном объеме:

На
участке 1-2 воздух охлаждается, а тепло
через стеклянную колбу поступает в
систему ( ),
поэтому теплоёмкость газа в политропном
процессе
),
поэтому теплоёмкость газа в политропном
процессе
 отрицательна
отрицательна
Изменение энтропии
nVT (1-2-3-1):
Политропа
1-2:
Политропа
2-3: :
Политропа
3-1: :
Изменение
энтропии за цикл:

Вывод: при выполнении лабораторной работы исследованы политропно-изохорно- изотермический (nVT) и адиабатно-изохорно-изотермический (SVT) циклы. С помощью экспериментально измеренных величин избыточных давлений Δp1 и Δp3 определены показатель политропного процесса n, найдены холодильные коэффициенты ε для nVT- и SVT-циклов. С помощью уравнения состояния идеального газа были вычислены параметры состояния (p, V, T). На основе полученных данных построены графики nVT- и SVT-циклов в pV-координатах. Найдены изменения энтропии ΔS для каждого процесса nVT- и SVT-циклов.



