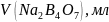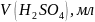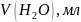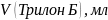- •Уп.02ведение технологических процессов производства неорганических веществ (2 н.)
- •Содержание
- •1. Безопасность труда и пожарная безопасность в химической лаборатории. Первичные средства пожаротушения. Оказание первой помощи
- •2.Классификация химической посуды по назначению. Освоение простейших приемов работы с химической посудой
- •3. Определение плотности растворов ареометром и пикнометром
- •Определение плотности растворов ареометром
- •Определение плотности растворов пикнометром
- •4. Сборка установки для титрования. Определение объема 1 капли раствора
- •5. Определение карбонатной жесткости питьевой воды
- •6. Установление молярной концентрации серной кислотыпо тетраборату натрия
- •7. Определение общей жесткости питьевой воды
- •8. Определение массовой концентрации карбоната натрия в кальцинированной соде
- •9. Определение массовой концентрации NaOHи при совместном присутствии
- •10. Исследование процесса адсорбции
6. Установление молярной концентрации серной кислотыпо тетраборату натрия
Цель работы: установить молярную концентрации серной кислоты по тетраборатунатрия.
Оборудование и реактивы: штатив, бюретка; колбы вместимостью 250 мл; пипеткавместимостью 10 мл, раствор серной кислоты, проточная вода, индикатор метиловыйоранжевый.
Технические средства обучения: калькулятор.
Ход работы:
Установление
титра и нормальной концентрации кислоты
при помощи тетраборатанатрия основана
на реакции:
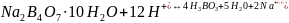
Водный раствор тетрабората натрия имеет щелочную среду. В результате титрования раствором кислоты среда становится кислой. Соответственно окраска индикатораметилоранжа изменяется от желтой до розовой.
Пипеткой отобрали 10 мл буры 0,05 Н в три колбы для титрования. Прибавили 5-7 капель метилоранжа и титровали раствором серной кислоты до перехода желтой окраски в бледно-розовую.
№ анализа |
Тетраборат натрия |
Серная кислота |
Индикатор |
1 |
10 |
21,2 |
5-7 капель метилового оранжевого |
2 |
10 |
21 |
|
3 |
10 |
21 |
|
Среднее значение |
10 |
21,06 |
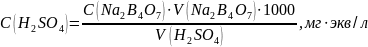
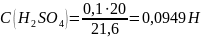
Вывод: в данной работе мы определили карбонатную жесткость питьевой воды.
7. Определение общей жесткости питьевой воды
Цель работы: определить общую жесткость питьевой воды.
Оборудование и материалы: штатив, бюретка, колбы вместимостью 250 мл, пипетка вместимостью 100 мл, аммоний хлористый, аммиак, 25% водный раствор, трилон Б 0,05 Н, индикатор эриохром черный.
Технические средства обучения:калькулятор.
Ход работы:
Буферный
раствор приготовили следующим  образом:
образом:
5,4 г аммония хлористого растворить в 20 мл воды, добавить 35 мл 25% раствора аммиака и довести объем раствора до 100 мл.
Пипеткой на 100 мл отбирают анализируемую воду в три колбы для титрования на 250 мл, прибавить 5 мл буферного раствора, 2-3 капли раствора или смеси на кончике лопатки индикатора эриохрома черного. Оттитровать раствор при энергичном взбалтывании 0,05 Н раствором трилона Б до перехода окраски от розового до синего.
№ анализа |
|
|
Индикатор |
1 |
100 |
9,1 |
2-3 капли раствора или смеси на кончике лопатки эриохрома черного |
2 |
100 |
9,0 |
|
3 |
100 |
8,9 |
|
Среднее значение |
100 |
9,0 |
Содержание общей жесткости (Ж) в миллиграммах эквивалент на литр рассчитали по формуле:
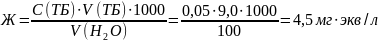
Вывод: в данной работе мы определили общую жесткость питьевой воды.
8. Определение массовой концентрации карбоната натрия в кальцинированной соде
Цель
работы: определить
массовую концентрацию карбоната натрия
в кальцинированной соде.
Оборудование и материалы: штатив, бюретка, колбы вместимостью 250 мл, кислота соляная, натрий углекислый, метиловый оранжевый.
Технические средства обучения: калькулятор.
Ход работы:
Взвесили от 2,3 до 2,5 г кальцинированной соды, поместили в коническую колбу вместимостью 250 см3, растворили в 20см3воды и оттитровали раствором соляной кислоты в присутствии метилового оранжевого до изменения окраски раствора из желтой в розовую.
№ анализа |
карбонат натрия |
Соляная кислота |
Индикатор |
1 |
0,5 |
8.2 |
5-7 капель метилового оранжевого |
2 |
0,5 |
7,5 |
|
3 |
0,5 |
8,2 |
|
Среднее значение |
0,5 |
8,0 |
Массовую долю углекислого натрия (Х) в процентах вычислили по формуле: в данной работе
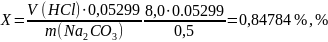
0,05299 – масса углекислого натрия в граммах, соответствующая 1см3раствора соляной кислоты 1 Н.
Вывод: в данной работе мы определили массовую концентрацию карбоната натрия в кальцинированной соде.