
С 60
.pdf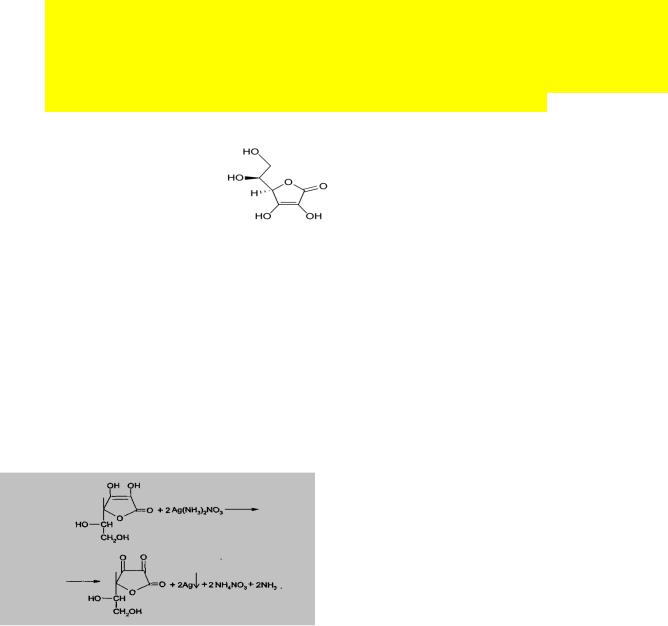
Ситуационная задача № 60
1. Комплекс испытаний применяемых для оценки качества кислоты аскорбиновой в виде 5% раствора для инъекций, а также лекарственных форм внутриаптечного изготовления предусматривает применение в качестве реагентов соединений йода (растворы йода и калия йодата). В соответствии с химической структурой лекарственного средства, дайте обоснование выбору и использованию данных реагентов в аналитическом контроле кислоты аскорбиновой:
Исходя из химического строения и свойств кислоты аскорбиновой, объясните способность её реагировать с раствором йода и калия и йодата.
Предложите другие реакции для идентификации лекарственного препарата и укажите степень их специфичности.
Рассмотрите применение 0,1 моль/литр раствора йода в количественном определении кислоты аскорбиновой на примере лекарственной прописи состава:
Кислоты аскорбиновой………… 0,1 Кислоты никотиновой…………0,05
Сахара………………………….0.25
1) Предложите способ количественного определения кислоты никотиновой с учётом присутствия в смеси второго компонента. Укажите значение молярной массы эквивалента для обоих веществ и формулы для расчета их содержания. Объясните сущность йодатометрического титрования кислоты аскорбиновой в растворе для инъекций и необходимость применения при этом раствора формальдегида. Как отразится на результате анализа его отсутствие? Укажите значение молярной массы эквивалента.
Acidum ascorbinicum Vitaminum C
Кислота аскорбиновая Витамин С
Ascorbic Acid
Функциональные группы: лактонная группировка, спиртовые гидроксильные группы, енольные гидроксильные группы, два оптически активных атома углерода (хиральные центры).
Подлинность: 1. ИК-спектр (в сравнении со стандартом или со спектром в ФС).
2.УФ-спектр ( max зависит от рН среды: при рН 7 λ=265 nm, при рН 2 – λ=243 nm)
3.Тпл.=190°C-193°C ( с разложением). Из-за нестойкости препарата при нагревании для определения Тпл. его предварительно сушат при температуре 60°C в течение 2 часов. Скорость подъема температуры - 5°C в 1 минуту (по той же причине).
4.Удельное вращение (от +22° до +24°) - 2% водный раствор.
ГФ Х регламентирует в качестве испытания на подлинность следующие реакции:
5. Реакция «Серебряного зеркала»: к раствору препарата приливают раствор серебра нитрата, происходит окисление кислоты аскорбиновой до кислоты дегидроаскорбиновой). Образуется темный осадок металлического серебра.
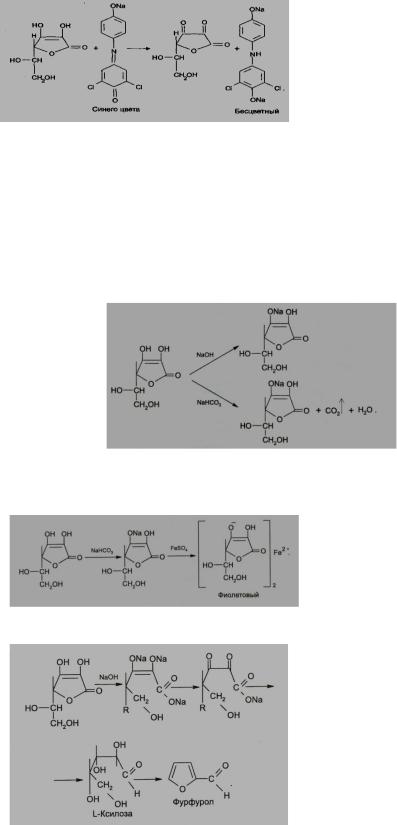
6. Реакция с 2,6-дихлорфенолиндофенолятом. К препарату добавляют указанный реактив, происходит восстановление реагента и синее окрашивание реагента исчезает.
Нефармакопейные реакции:
Аскорбиновая кислота обладает восстановительными свойствами (за счет наличия в структуре молекулы двух енольных гидроксилов). Поэтому препарат вступает в ОВР с окислителями, в том числе с реактивом Фелинга, раствором йода и калием йодатом, которые окисляют кислоту до дикетоаскорбиновой.
7. За счет наличия енольных гидроксилов в молекуле аскорбиновой кислоты препарат дает кислую реакцию среды на лакмус. При действии разбавленными растворами щелочей она ведет себя как одноосновная кислота. Разрыва лактонного цикла в этих условиях не происходит, а образуются нейтральные монощелочные соли.
8.Кислотные свойства обуславливают реакцию образования аскорбината железа. Реактив – железа (II) сульфат, не обладающий свойствами окислителя. Происходит реакция солеобразования, наблюдается фиолетовое окрашивание.
9.Взаимодействие с сильными щелочами. Происходит реакция гидролиза лактонного кольца и образование фурфурола.
По ГФХ препарат должен выдерживать испытание на органические примеси, сульфатную золу и тяжелые металлы.
Количественное определение: Йодатометрия (ГФ Х. Вариант прямого титрования)
Кислоту аскорбиновую титруют в присутствии калия йодида, небольшого количества кислоты хлороводородной и крахмала 0,1 н. стандартным раствором калия йодата до синего окрашивания:
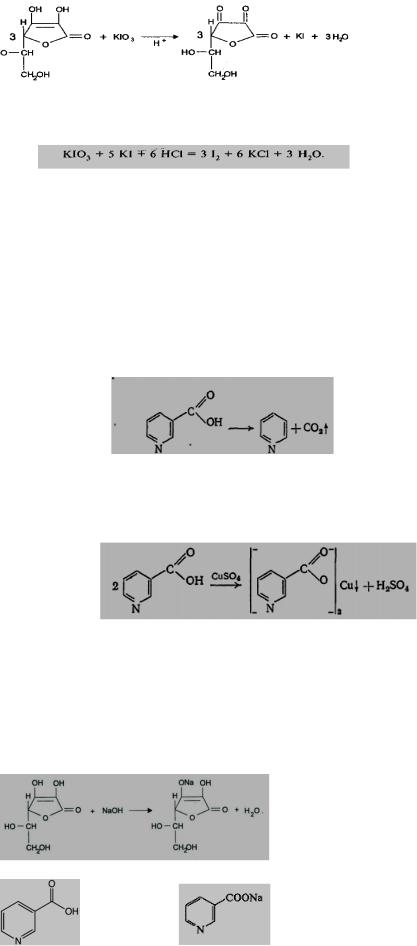
Избыточная капля титрованного раствора калия йодата реагирует с калия йодидом, выделяя йод, который указывает на конец титрования:
Возможные методы количественного определения аскорбиновой кислоты:
ОВР: йодометрия, индофенольный метод, йодхлорметрия, цериметрия. Кислотно-основные: алкалиметрия. Физико-химические: спектрофотометрия
Анализ смеси: Rp: Acidi ascorbinici 0,1
Acidi nicotinici 0,05 Sacchari 0,25
Реакция подлинности на кислоту никотиновую (ГФХ) 1. ИК-спектр (в сравнении со стандартом или со спектром в ФС). 2. УФ-спектр 3. Тпл.=234-238°C 4. Реакция разложения кислоты никотиновой путем нагревания с кристаллическим карбонатом натрия. Образуется пиридин, который легко обнаружить по характерному запаху:
5. Кислота никотиновая ввиду кислых свойств ее растворов обладает способностью образовывать нерастворимые соли (с ионами меди образуется осадок синего цвета – никотинат меди)
Если эту реакцию проводить в присутствии роданида аммония, то образуется тройное комплексное соединение, окрашенное в зеленый цвет. Если два ингредиента смеси обладают кислотными свойствами, а один из них является восстановителем, возможно их количественное определение в одной навеске. Для количественного определения ингредиентов проводят последовательное титрование вначале суммы кислот стандартным раствором натрия гидроксида. При этом значение величины z при расчете молряной массы эквиваленты М (1\z) для каждого вещества равно 1. Таким образом, Мэкв. (к-ты аскорбиновой)=176,13 г/моль, Мэкв.(к-ты никотиновой)=123,11 г/моль.
+ NaOH + H2O
Метод – прямая алкалиметрия, вариант нейтрализации, основан на кислотных свойствах препаратов. Титрант – 0,1 Н NaOH

Индикатор – фенолфталеин. Затем йодометрическим методом в той же аликвотной доле определяют кислоту аскорбиновую.
Метод – прямая йодометрия, основана на окислительно-восстановительных свойствах препарата. Титрант – 0,1 н раствор йода. Индикатор – крахмал. В точке эквивалентности наблюдается окрашивание раствора за счет взаимодействия избыточной капли йода с крахмалом и образования комплекса синего цвета.
2С+1 – 2е =2С+2 (f=1/2)
Расчет содержания кислоты никотиновой проводят по разности титрований с учетом эквивалентных объемов титрантов, когда количество 0,1 Н раствора йода, пошедшего на титрование кислоты аскорбиновой, в 2 раза больше, чем количество 0,1 Н раствора натрия гидроксида, израсходованного на такую же массу кислоты аскорбиновой. При титровании кислоты аскорбиновой 0,1 Н раствором йода f=1/2. Мэкв.=88,06 г/моль. Это означает, что на одну и ту же аликвотную долю смеси будет расходоваться 0,1 н раствора йода в два раза больше, чем 0,1 н раствора натрия гидроксида. Поэтому при расчете количества раствора, пошедшего на титрование кислоты никотиновой, из общего объема 0,1 н раствора гидроксида натрия следует вычесть ½ объема 0,1 н раствора йода, ихрасходованного на титрование кислоты аскорбиновой.
|
V |
I 2 |
kT |
Р |
Хк ты аскорбиновой, г |
|
I 2\к тааскорбиновая |
|
|
|
|
а |
|
|
|
|
|
|
где Х – масса определяемого вещества, г; V - объем титрованного раствора, мл; k – коэффициент поправки на титрованный раствор; P – общая масса порошка по прописи, г;
а – объем, мг, или масса, г, лекарственной формы, отобранный для анализа, k - поправочный коэффициент.
1 мл 0,1 н раствора йода соответствует 0,008806 г кислоты аскорбиновой.
Хк ты никотиновой, г |
((V |
NaOH |
k V |
I 2 |
\ 2k)T |
NaOH \ник.к та |
|
|
|
||||
|
|
|
|
а |
|
|
|
|
|
|
|
|
Р)
1 мл 0,1 н раствора едкого натра соответствует 0,01231 г к-ты никотиновой.
В растворах аскорбиновая кислота легко окисляется, инъекционные растворы готовят на воде, насыщенной СО2, с добавлением стабилизаторов-антиоксидантов (натрия сульфит, натрия метабисульфит). В раствор аскорбиновой кислоты для инъекций добавляют натрия гидрокарбонат для нейтрализации кислой реакции среды, раздражающей ткани. При йодатометрическом методе количественного определения кислоты аскорбиновой в инъекционном растворе следует учитывать наличие антиоксидантов-стабилизаторов, которые будут реагировать с титрантом — КIO3. Поэтому вначале к раствору добавляют раствор формальдегида, связывающий антиоксиданты. Затем кислоту аскорбиновую титруют стандартным раствором калия йодата.
2. Охарактеризуйте стабильность кислоты аскорбиновой в водном растворе. Назовите вещества, входящие в состав инъекционного раствора и обоснуйте их роль. Напишите паспорт для изготовления 10 доз инъекционного раствора кислоты аскорбиновой.
Аскорбиновая кислота (витамин С) хорошо, растворим в воде, используется в виде порошка, таблеток, инъекционных растворов 5%-10%. Например изотоническая концентрация аскорбиновой кислоты = 5% (0.9/0.18).
Rp. Solutionis Acidi ascorbinici 5%- 10ml Sterilisa!

D.S. no 1 мл 2 раза в день.
Кислота аскорбиновая - легко окисляемое вещество, при термической обработке окисляется даже незначительным количеством кислорода, содержащегося в воде для инъекций и в воздухе под пробкой, при этом надо использовать воду для инъекций, свежеприготовленную в течение 30 минут и быстроохлажденную.
-флакон следует заполнять доверху
-целесообразно с помощью спец. установок насыщать воду (углекислотой в токе инертного газа) Растворы кислоты аскорбиновой вследствие сильнокислой реакции среды при введении
вызывает болевые ощущения.
Для нейтрализации среды в состав раствора надо вводить натрия гидрокарбонат в эквивалентном количестве 23.85 на 1л.5% раствора, образующийся аскорбинат натрия сохраняет лечебные свойства аскорбиновой кислоты.
Для повышения стабильности добавить следует антиоксидантнатрия сульфит безводный. Отпускать раствор следует в ампулах из светозащитного стекла и обеспечить хранение в защищенном от света месте. Срок годности 5 суток до вскрытия.
Рабочая пропись:
Воды для инъекций до 1000мл Кислоты аскорбиновой 50,0 натрия гидрокарбонат 23.85 натрия сульфит безводного 0.2 V-1000мл
На обратной стороне ППК расчет рабочей прописью
-номинальный объем 1 доза 10 мл, объем флакона должен быть 10.5 мл; объем 10 доз105 мл.
-кислоты аскорбиновой 2,5 * 2=5,0 для объема 105 мл - 2.5
-натрия гидрокарбонат 2.385 на 100мл, а для объема 105 мл-2.5
-натрия сульфит безводный 0.02 (1% раствор-10 мл)
-воды для инъекций до 100 мл, для объема 105 мл (с учетом прироста объема кислоты аскорбиновой 0.69 мл/г КУО натрия гидрокарбоната 0.3 мл/г)=98,6 мл.
-т.к. кислота аскорбиновая относиться к легко окисляемым препаратам при высокой t, согласно приказу № 214 стерилизовать надо при t 100С30 мин. Лицевая сторона ППК. Aqua pro injectionis 98.6 Acidi ascorbinici 5.25 натрия гидрокарбонат 2.5 натрия сульфит безводного 1 % 2 мл У = 1 0 5 м л
Готовить в асептических условиях, подготовить рабочее место. В стерильную подставку отмерить свежее полученной воды для инъекций 98,6 стерильным цилиндром. На РВ грузоподъемность 20,0 отвесить 5,25 кислоты аскорбиновой + натрия гидрокарбоната ( сорта для инъекций) растворить, затем 2 мл 1% раствора натрия сульфита ( после полного растворения отдать на анализ). После положительного анализа профильтровать в стеклянный флакон, через двойной, стерильный сухой бумажный фильтр с подложенным стерильным тампоном ваты сорта «гладкая». Первую порцию вернуть на фильтр, проверить на чистоту, закрыть пробкой, затем обкатать колпачком, подготовить к стерилизации. На колпачке написать Acidi ascorbinici 5%,дата,ФИО. Простерилизовать при t 100С30 мин, оформить к отпуску:
- этикетка «для инъекций», с указанием полного состава на латинском языке, № анализа, дата, цена, срок годности 5 суток до вскрытия.
3. Проведите сравнительную оценку различным способом стерилизация инъекционных растворов в промышленном производстве. Предложите оптимальный метод стерилизации для препарата по указанной прописи. Объясните как влияет на качество и стабильность растворов

материал упаковки, например стекло, и как учитывается это влияние при производстве инъекционных лекарственных средств.
Стерилизация инъекционных растворов в промышленном производстве проводят различными способами, в зависимости от термической стойкости входящих компонентов.
Чаще всего используют термический способ, а именно насыщенным паром под давлением. Стерилизацию проводят в паровых стерилизаторах вертикальных марки (ВК-5;ВК-3), горизонтальных (ГК-100;ГП-280,ГП-400;ГПД- 280). ВК - вертикальный круговой, ГП -горизонтальный прямоугольный односторонний, ГПДгоризонтальный прямоугольный двусторонний. Температура стерилизации 120132С.
Метод основан на способности водяного пара вызывать набухание и коагуляцию клеточного белка, что приводит к гибели вегетативных и споровых форм микроорганизмов.
Стерилизация жестким паром, в паровых стерилизаторах при t =100°С, используют для веществ не выдерживающих высокую температуру, когда этот метод является единственно возможным.
Текучий пар убивает вегетативные формы микроорганизмов.
Растворы термолабильных веществ (хлорида, випасола, барбитала натрия) стерилизуют фильтрованием (глубинные или мембранные фильтры)
-стерилизация растворов должна проводиться не позднее 3-х часов после изготовления, под контролем провизора.
-повторная стерилизация не допускается
-после стерилизации проводится повторный контроль, на отсутствие механических включений, качество укупорки флаконов и полный химический контроль (рН, подлинность, количественное содержание).
-стабилизаторы после стерилизации проверяют только в случаях предусмотренных НД. Инъекционная ЛФ и вода периодически проверяется органами Госсанэпидем надзора. Растворы считаются забракованными, если они соответствуют нормам, хотя бы по одному из показателей:
-физико-химические свойства
-механические примеси
-стерильность
-апирогенность
-герметичность
-недостаточный объем заполнения.
4. Дайте теоретическое обоснование организации рабочего места для изготовления приведённой выше
прописи. Обоснуйте порядок внутриаптечного контроля качества данной лекарственной формы и
сроки хранения её в аптеке. Каким документом должно быть оформлено изъятие данной
лекарственной формы на анализ контрольно-аналитической лаборатории и к какому виду товарных
операций следует её отнести? Как будет организован учёт данного вида операции?
Виды внутриаптечного контроля качества лекарственных средств утверждены приказом № 214 от 16.07.1997г. «Инструкции по контролю качества лекарственных средств, изготовленных в аптечных учреждениях».
Всего шесть видов внутриаптечного контроля качества: письменный, органолептический, опросный, физический, химический,

контроль при отпуске.
Данная лекарственная форма подвергается обязательным видам контроля (письменному, органолептическому и контролю при отпуске) и выборочно может быть подвергнута физическому и опросному видам контроля. Так как дана лекарственная форма для инъекций, то обязательным для неё будет являться полный химический контроль (качественный и количественный).
Согласно приказу МЗ РФ № 214 сроки хранения в аптеке изготовленных лекарственных средств: Для водных растворов с бензилпенициллином и водных растворов глюкозы – 1 сутки Для глазных капель – 2 суток Для инъекционных растворов и инфузий – 2 суток
Для настоев, отваров, слизей – 2 суток Для эмульсий, суспензий – 3 суток
Для остальных лекарственных форм – 10 суток Изъятие лекарственной формы на анализ в КАЛ оформляется «Актом изъятия лекарственной
формы», которое осуществляет провизор – аналитик КАЛ при проверке организации внутриаптечного контроля качества в аптеке и изготовления лекарственных форм.
В акте отражаются:
Наименование лекарственных форм изъятых на анализ Количество изъятых лекарственных форм Результаты анализа
Акт изъятия составляется в двух экземплярах. Один экземпляр забирает провизор – аналитик КАЛ, второй экземпляр остается в аптеке.
Данный вид товарных операций относится к «Прочему документированному расходу». Стоимость этих товаров, израсходованных на анализ, списывается в конце месяца в «Отчет о финансово-хозяйственной деятельности аптеки за месяц» в раздел «Товарный отчет» часть РАСХОД.
5. Виды шиповника как лекарственные растенияисточники витамина С. Дайте их краткую ботаническую характеристику. Приведите латинские названия растений, сырья, семейства. Укажите сырьевую базу. Какими физико-химическими методами подтверждают присутствие витамина C в лекарственном растительном сырье?
Плоды шиповника – Fructus Rosae. Шиповник коричный – Rosa cinamomea Шиповник собачий – Rosa canina Семейство – Розоцветные – Rosaceae.
В ГФ XI описано 13 видов шиповника, которые делят на 2 секции (шиповник коричный и собачий).
Все эти виды — кустарники с шипами на побегах и стеблях. Листья сложные, непарноперистые, с зубчатыми листочками. Цветки обоеполые, 5-лепестные, с розово-красным венчиком, реже белой расцветки. Плод ложный, многоорешковый. Настоящие плоды — мелкие орешки, находящиеся внутри оранжево-красного сочного разросшегося цветоложа — гипантия. Орешки угловатой формы, наверху несущие волоски, вся внутренняя поверхность плода усажена многочисленными длинными щетинистыми волосками.
Распространение
Сырьевая база обеспечена за счет дикорастущих растений. Шиповники произрастают по всей России.
Химический состав
Плоды шиповника — ценное поливитаминное сырье. Фармакопейные виды шиповника делятся на высоковитаминные и низковитаминные. Содержание аскорбиновой кислоты в плодах высоковитаминных видов — не менее 1%.
Плоды шиповника содержат витамин С, Р, каротин, жирное масло, органические кислоты.
Фармакологическое действие
Препараты из плодов шиповника оказывают разнообразное действие: желчегонное, мочегонное, противоатеросклеротическое, бактерицидное, противовоспалительное, вяжущее,

ранозаживляющее, кровоостанавливающее, седативное, слабительное, кроветворное, общеукрепляющее.
Применяют в виде отваров, сиропа, сбора, как поливитаминное средство: жирное масло и препарат “Каротолин” как средство, стимулирующее регенерацию тканей, препарат “Холосас” как желчегонное средство.
Количественное определение.
Количественное определение проводят титриметрическим методом. Основан на способности аскорбиновой кислоты восстанавливать 2,6 – дихлорфенолиндофенол. Определение ведут в кислой среде, титрант – натриевая соль, титруют до розового окрашивания.
6.Объясните роль ферментов и специфику их получения с помощью биотехнологии
Ферменты - биокатализаторы, играют ключевую роль в биологических процессах. Люди с давних времен использовали ферменты при выделке кож, в пивоварении, сыроделии. Первый патент на производство амилазы из Asp. orisae был зарегистрирован И. Такамине в 1894 году. К настоящему времени известно около 10000 ферментов, но практическое значение имеют не более 200. Основные области применения ферментов:
1.Медицина
2.Хлебопекарная и легкая промышленности – амилазу; мясомолочная и текстильная – протеиназы; моющие средства (биодобавки - энзимы). Реннин (сычужный фермент) – для быстрого створаживания молока и производства сыра.
3.Научные исследованиях - нуклеазы – инструмент генно-инженерных работ, протеазы используются для посттрансляционной модификации белков и т.д..
Использование ферментов в медицине происходит по нескольким направлениям, основными из которых яволяются энзимодиагностика и энзимотерапия.
Энзимодиагностика
Энзимодиагностика – это исследование активности ферментов плазмы крови, мочи, слюны с целью диагностики тех или иных заболеваний. Примером может служить фермент лактатдегидрогеназа, определение его активности в плазме крови необходимо при заболеваниях сердца, печени, скелетной мускулатуры.
Энзимотерапия
Энзимотерапия – это использование ферментов в качестве лекарственных средств.
Самыми распространенными ферментативными препаратами являются комплексы ферментов желудочно-кишечного тракта (Фестал, Панзинорм форте, Мезим форте, Энзистал и т.п.), содержащие пепсин, трипсин, амилазу и т.п., и используемые для заместительной терапии при нарушениях переваривания веществ в желудочно-кишечном тракте.
Тканевой фермент гиалуронидаза вводят для размягчения рубцов, появления подвижности в суставах, рассасывания гематом. Коллагеназу применяют для ускорения отторжения некротизированных тканей, для очистки трофических язв.
Цитохром с – белок, участвующий в процессах тканевого дыхания. Его применяют при асфиксии новорожденных, астматических состояниях, сердечной недостаточности, различных видах гепатита и т.п.
Рибонуклеаза и дезоксирибонуклеаза входят в состав глазных капель для лечения вирусных конъюнктивитов.
Источники ферментов
Ранее ферменты получают из растений – папаин – из млечного сока папайи; фицин – из растений рода Ficus. Протеолитические ферменты (химотрипсин, трипсин, пепсин), из органов сельскохозяйственных животных.
В настоящее время ферменты в основном получают биотехнологическими методами с использованием микроорганизмов-продуцентов. Это связано со следующими преимуществами микроорганизмов:
1)микроорганизмы легко культивировать;
2)они быстро размножаются;
3)микроорганизмы растут на относительно дешевых средах круглый год независимо от климата и времени года;
4)микроорганизмы можно изменять на генетическом уровне, получая мутантысверхпродуценты и продуценты ферментов с нужными свойствами.
5)микробиологические ферменты более устойчивы.
Получают экзо- и эндоферменты. Экзо-ферменты продуцируются микроорганизмами в питательную среду, эндо – остаются в клетках.
Очевидно, что легче получать и выделять экзоферменты, можно использовать более мягкие условия. Это имеет немаловажное значение, так как необходимо не просто выделить фермент, а выделить активный фермент. Часто проблему транспорта фермента из клетки решают генноинженерным путем.
Требования, предъявляемые к промышленному штамму
1.Апатогенный.
2.Штамм должен образовывать преимущественно один фермент (легче выделять).
3.Не продуцировал токсины и вредные вещества.
4.Хорошо развивался в условиях культивирования.
Культивирование микроорганизмов - продуцентов ферментов целесообразно в средах строго детерминированного состава, обеспечивающих направленный биосинтез нужного фермента.
Синтез многих ферментов репрессируется легкоусвояемыми источниками углерода (глюкозой, фруктозой, маннозой и др.); этот эффект носит название катаболитной репрессии (иногда глюкозньм эффектом). Катаболитной репрессии подвержен биосинтез таких ферментов, как - амилаза, целлюлаза, глюкоамидаза, инвертаза и др.
Ферменты, катализирующие превращение азотсодержащих субстратов, также регулируются по механизму катаболитной репрессии; их биосинтез репрессируется ионами аммония или быстроусвояемыми аминокислотами. Аминокислоты в анаэробных условиях культивирования инициируют биосинтез соответствующих декарбоксилаз. При наличии в среде большой концентрации мочевины стимулируется биосинтез уреазы. Введение в среду культивирования аргинина индуцирует биосинтез аргиназы. Источниками органического азота могут служить пептон, триптон, дрожжевой экстракт, гидролизат казеина или любая их смесь.
Наличие в среде культивирования различных биополимеров обусловливает одновременное накопление комплекса протеаз, амилаз, нуклеаз, липаз.
На рост микроорганизмов и биосинтез ферментов существенное влияние оказывают ионы кальция, марганца, цинка и др. Ионы железа и магния активируют и стабилизируют протеолитические ферменты. Присутствие ионов железа и меди в среде культивирования существенно для биосинтеза железо- и медьсодержащих ферментов, участвующих, как правило, в окислительно-восстановительных реакциях (утилизации и превращения энергии). Отсутствие таких ионов может негативно отразиться на скорости многих метаболических процессов и на биосинтезе ферментов, катализирующих эти процессы.
Продуценты ферментов, относящиеся к строгим анаэробам, требуют полностью бескислородных условий культивирования и очень богатых, полноценных сред. Процесс культивирования в этом случае можно проводить в более простых ферментерах, так как не нужна аэрация и перемешивание.
Оптимизация питательных сред и условий культивирования для обеспечения направленного биосинтеза продуцентом целевого продукта является важным этапом разработки биотехнологического процесса получения высокоочищенных ферментов. Преимущественный биосинтез культурой нужного продукта с минимальным содержанием посторонних белков позволяет в дальнейшем существенно упростить выделение и очистку ферментов.
