
С 53
.pdf
Ситуационная задача № 53
В аптеке по рецепту врача был изготовлен раствор для наружного применения состава:
Гексаметилентетрамина |
|
Натрия салицилата .................................. |
по 2,0 |
Воды очищенной ....................................... |
100 мл |
Провизор-аналитик при проведении внутриаптечного контроля качества изготовленной лекарственной формы использовал в качестве реагента концентрированную серную кислоту для одновременного обнаружения обоих компонентов, а для количественного определения применил кислотно-основное титрование путем титрования 0,1 М раствором кислоты хлороводородной в присутствии эфира. После отделения эфирного слоя и добавления спирта титровал 0,1 М раствором натрия гидроксида при сильном встряхивании.
Входе проведения плановых контрольных мероприятий по соблюдению действующих лицензионных требований контролирующим органом установлено, что в аптеке хранение дезинфицирующих ЛС, предназначенных для реализации, осуществляется в одном помещении с медицинскими изделиями из резины. Медицинские изделия из резины хранятся на стеллаже, который расположен в 0,5 м от отопительной батареи в проходе. Хранение осуществляется при температуре 25º С и относительной влажности воздуха 55 % совместно со спиртовым раствором йода и Хлорамином Б.
Вусловиях крупного фармацевтического производства используются вода очищенная
ивода для инъекций.
Вфармацевтической практике используются листья толокнянки и брусники.
Задание (вопросы):
1. В соответствии с каким НД осуществлялся технологический процесс изготовления лекарственной формы? Правила оформления ППК.
Приказ мз рф от 22 мая 2023 г. N 249н об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, имеющими лицензию на фармацевтическую деятельность Натрия салицилат - Белый кристаллический порошок или мелкие чешуйки, без запаха,
сладковато-соленого вкуса. Гексаметилентетрамин - Бесцветные кристаллы или белый кристаллический порошок, без запаха, жгучего и сладкого, а затем горьковатого вкуса. Легко растворим в воде и спирте.
ППК обратная сторона:
Гексаметилентетрамина 2,0 Натрия салицилата 2,0 Воды очищенной 100 мл
КУО гексаметилентетрамина =0,78 КУО натрия салицилата = 0,59 ∆V= 0,78*2+0,59*2=2,74 мл
∆V < 3 % → не учитываем. Воды берем 100 мл
ППК лицевая сторона № _ Rp №_ Дата___:
Aq.pur 100ml Natrii salicylatis 2,0
Hexamethylentetramini 2,0 100 ml № 1
Приготовил: Проверил:
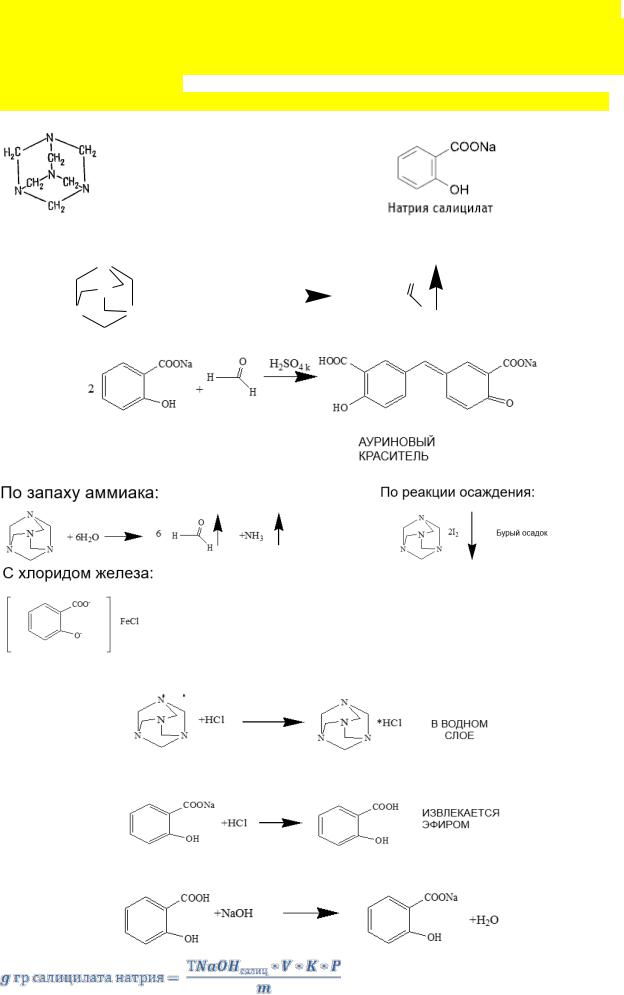
2. Обоснуйте действия провизора-аналитика в выборе методов анализа данной смеси. Объясните взаимодействие компонентов в присутствии концентрированной серной кислоты, укажите результат реакции. Обоснуйте выбор стандартного раствора для количественного определения. Какое образующееся вещество остается в водном растворе,
а что извлекается эфиром?
Какое вещество определяется после отделения эфирного слоя и добавления спирта?
гексаметилентатрамин В водных растворах гексаметилентетрамин способен к гидролизу, который ускоряется в кислой среде и протекает по схеме:
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
N |
+ 2H2SO4 |
+ 6H2O |
|
6 H |
|
+ 2 (NH4)2SO4 |
|
|
|
|
||||
|
|
|
|||||
N |
|
N |
|
|
|
|
H |
Образовавшийся формальдегид доказывают по реакции с салициловой кислотой:
ДРУГИЕ СПОСОБЫ ИДЕНТИФИКАЦИИ:
Моносалицилат железа (фиолетовый)
Количественное определение проводилось путём титрования смеси 0,1 М раствором HCl в присутствии эфира:
После отделения эфирного слоя и добавления спирта титровали NaOH при сильном встряхивании:

3. На каком рабочем месте в ассистентской комнате была изготовлена данная лекарственная форма? Какое оборудование должна иметь ассистентская комната аптеки?
Какие виды внутриаптечного контроля данной лекарственной формы должен применить провизор-аналитик?
Данная ЛФ была изготовлена в ассистентской на столе для внутренних ЛФ. Ассистентская комната в аптеке должна иметь следующее оборудование: вертушки, сушильный шкаф, ассистентский стол, автоклав, дистилляторы, электроплитку.
В соответствии с Приказом МЗ РФ № 249н к обязательным видам контроля относятся: письменный, органолептический и контроль при отпуске.
Органолептический контроль - проверка ЛФ по показателям: Описание (внешний вид, цвет, запах), однородность, отсутствие видимых механических включений (в жидких лекарственных формах). На вкус проверяются выборочно лекарственные формы, предназначенные для детей.
Контроль при отпуске - проверка упаковки ЛП физико-химическим свойствам, дозы, реквизиты рецепта, маркировки ЛС.
Провизор-аналитик применил химический контроль. Химический контроль заключается в оценке качества изготовления ЛП по показателям: качественный анализ (подлинность ЛС) и количественный анализ (количественное определение ЛС).
Качественному анализу должны подвергаться выборочно ЛП различных ЛФ, изготовленные фармацевтом (провизором) в течение рабочего дня, но не менее 10% от общего количества изготовленных каждым фармацевтом ЛП. Качественному и количественному анализу (полный химический контроль) подвергаются в обязательном порядке: ЛФ, изготовленные по рецептам и требованиям, в количестве не менее трех ЛФ при работе в одну смену с учетом различных видов ЛФ.
4. Порядок проведения надзора лицензионных требований и обращения ЛС при осуществлении фармацевтической деятельности. Органы надзора, порядок и сроки проведения, оформление результатов.
Сделайте заключение о соответствии действующим требованиям организации хранения в АО дезинфицирующих ЛС и медицинских изделий из резины, дайте критическую оценку профессиональным действиям работников аптеки.
Постановление Правительства РФ от 31 марта 2022 г. N 547 "Об утверждении Положения о лицензировании фармацевтической деятельности".
Лицензирование фармацевтической деятельности осуществляют следующие лицензирующие органы:
а) Федеральная служба по надзору в сфере здравоохранения б) исполнительные органы субъектов Российской Федерации
в) Федеральная служба по ветеринарному и фитосанитарному надзору Соискатель лицензии должен соответствовать следующим лицензионным требованиям:
а) наличие производственного объекта или объектов (помещений, зданий, сооружений) и оборудования по месту осуществления фармацевтической деятельности б) наличие производственного объекта или объектов (помещений, зданий, сооружений) и оборудования по месту осуществления фармацевтической деятельности
в) наличие производственного объекта или объектов (помещений, зданий, сооружений) и оборудования по месту осуществления фармацевтической деятельности г) наличие производственного объекта или объектов (помещений, зданий, сооружений) и оборудования по месту осуществления фармацевтической деятельности
д) наличие производственного объекта (помещения, здания, сооружения) и оборудования по месту осуществления фармацевтической деятельности, принадлежащих на праве собственности или на ином законном основании, предусматривающем право владения и право пользования

е) наличие производственного объекта или объектов (помещений, зданий, сооружений) и оборудования по месту осуществления фармацевтической деятельности ж) наличие у медицинской организации - соискателя лицензии лицензии на осуществление медицинской деятельности;
з) наличие в соответствии с правилами надлежащей аптечной практики лекарственных препаратов для медицинского применения, правилами надлежащей практики хранения и перевозки лекарственных препаратов
Сделайте заключение о соответствии действующим требованиям организации хранения в АО дезинфицирующих ЛС и медицинских изделий из резины, дайте критическую оценку профессиональным действиям работников аптеки
Приказ Минздрава РФ от 13.11.1996 N 377 «Об утверждении Инструкции по организации хранения в аптечных учреждениях различных групп ЛС и изделий медицинского назначения»
Приказ Минздравсоцразвития РФ от 23.08.2010 N 706н «Об утверждении Правил хранения ЛС»
Специалисты аптеки проявляют незнание правил хранения ЛП и ТАА или полную безответственность, т.к. согласно приказу 706н: «Дезинфицирующие ЛС следует хранить в герметично укупоренной таре в изолированном помещении вдали от помещений хранения пластмассовых, резиновых и металлических изделий и помещений получения дистиллированной воды», а согласно приказу 377: для наилучшего сохранения резиновых изделий в помещениях хранения необходимо создать:
защиту от света, особенно прямых солнечных лучей, высокой (более 20 град. C) и низкой (ниже 0 град.) температуры воздуха; текучего воздуха (сквозняков, механической вентиляции); механических повреждений (сдавливания, сгибания, скручивания, вытягивания и т.п.);
для предупреждения высыхания, деформации и потери их эластичности, относительную влажность не менее 65%;
изоляцию от воздействия агрессивных веществ (йод, хлороформ, формалин, кислоты и щелочи, хлорамин Б и др);
условия хранения вдали от нагревательных приборов (не менее 1 м).
Заключение о соответствии действующим требованиям организации хранения в АО, дезинфицирующих ЛС и медицинских изделий из резины: НЕ СООТВЕТСТВУЕТ.
5.Характеристика методов и условий хранения воды очищенной и воды для инъекций
вусловиях фармацевтического производства.
Согласно ФС «Вода очищенная». |
Согласно ФС «Вода для инъекций». Хранение воды |
||||||
Хранение воды очищенной должно |
для инъекций должно осуществляться при |
||||||
осуществляться в закрытых |
температуре от 5 |
о |
С до 10 |
о |
С или от 80 |
о |
о |
|
|
|
С до 95 С в |
||||
емкостях, изготовленных из |
закрытых емкостях, изготовленных из материалов, |
||||||
материалов, не изменяющих свойств |
не изменяющих свойств воды, защищающих воду |
||||||
воды и защищающих ее от |
от попадания механических включений и |
||||||
инородных частиц и |
микробиологических загрязнений, но не более 24 |
||||||
микробиологических загрязнений. |
часов. |
|
|
|
|
|
|
Существуют 2 системы хранения и распределения воды – горячая и холодная. При горячем хранении подавляется рост микроорганизмов, но требуются специальные трубопроводы и теплообменники для регулирования температуры при подаче в точку отброса. При холодном хранении подавление роста микроорганизмов осуществляется путём озонирования или УФ-облучения системы. Предпочтительней использование озона, т.к. он разрушает биопленку на поверхности мембран трубопроводов и уничтожает пирогены. При УФ-облучении происходит только снижение концентрации микроорганизмов. Часто используют комбинирование двух методов.

6. Дайте характеристику растительных источников лекарственного сырья, содержащего арбутин: латинские названия видов, сырья, семейств; сырьевая база, медицинское применение.
Брусника обыкновенная
Листья брусники - vitis-idaeae Folia (витис-идэаэ фолиа)
Побеги брусники - Vaccinii vitis-idaeae Cormus (витис идэаэ кормус) Брусника обыкновенная - Vaccinium vitis-idaea (вакциниум витис идэа). Семейство брусничные – Vacciniceae (вакциниацэ)
По всей европейской части страны; особенно много в Западной и Восточной Сибири, на Дальнем Востоке, в Заполярье. Основные районы заготовок - Беларусь, Сибирь, северные, северо-восточные и западные области России.
Химический состав: арбутин, урсуловая кислота, фитонциды, флавоноиды, витамины, дубильные вещества.
Листья брусники оказывают антимикробное, вяжущее и противовоспалительное действие, обусловленное наличием в растении фенольного гликозида арбутина, а также урсоловой кислоты и фитонцидов. Фитонциды листьев подавляют рост золотистого стафилококка. Препараты обладают вяжущим и капилляроукрепляющим свойством.
Толокнянка обыкновенная
Листья толокнянки - Uvae-ursi Folia (увэ-урси фолиа) Побеги толокнянки - Uvae-ursi Cormus (увэ-урси кормус)
Толокнянка обыкновенная - Arctostaphylos uva-ursi (арктостафилос ува-урси) Семейство вересковые – Ericaceae (Эрикацэ)
Лесная зона европейской части страны, Западная Сибирь, Поволжье, центральные области, реже - Дальний Восток. Основные районы заготовок - Литва, Беларусь, Псковская, Новгородская, Вологодская и Тверская области.
Химический состав: арбутин, дубильные вещества, фенолкарбоновые кислоты, флавоноиды, сапонины, полисахариды.
Антисептическое действие, Мочегонное действие, вяжущее действие.
