
С 49
.pdf
Ситуационная задача № 49
На производственной практике студент обратил внимание на то, что в аптеке с большим трудом выполняются требования, предъявляемые ГФ к лекарственной форме Суспензии. Он обратился к провизору-технологу с вопросом о возможности применения технологического приема дробного фракционирования (взмучивания) при изготовлении препарата по прописи:
Возьми: Спирта этилового……...................................................50 мл
Крахмала |
|
Цинка оксида |
|
Талька поровну ............................................................ |
15,0 |
Воды очищенной ......................................................... |
250 мл |
Глицерина ...................................................................... |
50,0 |
Смешай. Дай. Обозначь...................... |
Втирать в кожу стоп |
Для проведения аналитического контроля компонентов прописи студент проконсультировался с провизором-аналитиком.
При получении суспензий в условиях промышленного производства учитывается фактор влияния дисперсности частиц твердой фазы на биологическую доступность гетерогенных систем.
В фармацевтической практике используется лекарственное растительное сырье Змеевика корневища.
Задание (вопросы):
1. Каковы требования ГФ к лекарственной форме Суспензии?
Согласно ГФ 15 издания:
Суспензия – жидкая ЛФ, представляющая собой гетерогенную , содержащая одно или несколько твердых действующих веществ, распределенных в жидкой дисперсионной среде.
Требования:
-Описание: после взбалтывания суспензия должна представлять собой жидкость с однородно распределенными в ней частицами.
-pH – при необходимости, если этого требует частная ФС. Метод потенциометрии.
-Размер частиц – согласно ОФС «Оптическая микроскопия»
Не допускается наличие частиц с максимальным размером более 100 мкм , если иное не указано в НД.
-Проходимость через иглу – для суспензий для парентерального применения.
-Седиментационная устойчивость – ЛП взбалтывают и переносят в мерный цилиндр. Флакон, из которого перенесли суспензию, не должен содержать на стенках агрегатов и агломератов частиц дисперсной фазы.
Время ресуспендирования для суспензий для приема внутрь и для парентерального применения – не более 1 минуты.
Суспензии – глазные капли – не более 30сек.

-Вязкость. Испытание должно быть предусмотрено для суспензий, в которых содержатся вещества, увеличивающие вязкость. Согласно ОФС «Вязкость» методом ротационной вискозиметрии.
-Однородность дозирования – согласно ОФС «Однородность дозирования» для суспензий в однодозовых индивидуальных упаковках.
-Микробиологическая чистота – согласно ОФС «Микробиологическая чистота», испытание должны выдерживать все суспензии, за исключением стерильных.
-Стерильность – в соответствии с ОФС «Стерильность», должны выдерживать суспензии, к которым предъявляется требование стерильности.
-Извлекаемый объём – для суспензий для приёма внутрь согласно ОФС
«Извлекаемый объём».
Не проводят для суспензий в однодозовых индивидуальных упаковках, если проводят испытание на однородность дозирования.
-Масса (объем) содержимого упаковки – проводят для всех суспензий за исключением суспензий для приема внутрь, согласно ОФС «Масса (объём) содержимого упаковки».
-Упаковка в соответствии с ОФС «Упаковка, маркировка и транспортирование ЛС».
-Маркировка в соответствии с ОФС «Упаковка, маркировка и транспортирование ЛС». Должна быть предусмотрена предупредительная надпись «Перед употреблением взбалтывать».
-Хранение в соответствии с ОФС «Хранение лекарственных средств». В упаковке, обеспечивающей стабильность в стечение указанного срока годности ЛП, в защищенном от света месте при температуре от 8 до 15 градусов, если нет других указаний в НД.
2.Охарактеризуйте процесс изготовления суспензии, включая все стадии изготовления и контроля качества.
Назовите установленные объемы тары для экстемпоральных ЛП, содержащих этиловый спирт, номенклатура которых включена в перечень ЛП, в отношении которых устанавливаются требования к объему тары, упаковке и комплектности.
Правила хранения спирта этилового в аптеке, организации оптовой торговли ЛС, медицинской организации согласно НПА по хранению различных групп ЛП и ТАА.
Изготовление суспензии в аптечных организациях производится в соответствии с правилами, регламентированными приказом 249н ЛФ – суспензия гидрофильных ЛВ. Изготавливается по массе.
Изготовление суспензий в ступке путем измельчения порошкообразных нерастворимых ЛС производится по правилам изготовления порошков с последующим диспергированием оптимальным количеством жидкости (в количестве 1/2 от массы измельчаемого ЛС) и разбавлением дисперсионной средой. Не подлежат фильтрации.
В отпускной флакон отвешивают 50,0 глицерина. В ступку отвешивают по 15,0 крахмала, цинка оксида и талька, измельчают с 23 г глицерина ((15+15+15)/2=23,0). Пульпу смывают во флакон 250 мл воды, используя

прием взмучивания. Добавляют 50 мл спирта этилового в последнюю очередь во флакон для отпуска, перемешивают.
Масса общая = 15,0 х 3 + 250 + 50 + 50 х 0,827 = 386,4 ППК обр. сторона: ингредиенты записываются в порядке указанном в рецепте на русском языке.
ППК лиц. сторона: заполняется сразу после изготовления ЛП, с указанием ЛС на латинском языке, в соответствии с последовательностью технологических операций.
Контроль качества:
Приказы 249н Все изготовленные ЛП подлежат обязательному письменному,
органолептическому контролю при отпуске. Также может быть выборочно проведен контроль: опросный, физический, химический.
Про спирт
Приказом № 1093н не установлены ограничения по объему отпуска этилового спирта в чистом виде или в смеси по рецептам. Этиловый спирт должен отпускаться в количестве, выписанном мед работником в рецепте, но с учетом установленных ограничений объема тары спирта этилового в заводской упаковке.
Постановление Правительства РФ от 27 августа 1999 г. № 967 "О производстве и обороте спиртосодержащих ЛС и парфюмернокосметической продукции". ЛП, содержащие этиловый спирт, предназначенные для внутреннего применения, подлежат отпуску в таре, содержащей установленный объем (25 миллилитров, 50 миллилитров, 100 миллилитров).
В соответствии с Приказом Минздрава РФ от 23.08.2010 №706н «Об утверждении правил хранения ЛС» спирт этиловый относится к группе легковоспламеняющихся ЛС, поэтому его хранение должно осуществляться отдельно от других ЛС; в плотно укупоренной прочной стеклянной или металлической таре, чтобы предупредить испарение из сосудов. Не допускается хранение у отопительных приборов. Расстояние от стеллажа или штабеля до нагревательного элемента должно быть не менее 1 м.
Спирты в больших количествах хранятся в металлических емкостях, заполняемых не более чем на 75% объема. Спирт этиловый относится к ЛС, подлежащим ПКУ, хранят в металлических запирающихся шкафах.
3. Физические константы, характеризующие качество спирта этилового и глицерина. Реакции для установления их подлинности. Назовите реакцию, позволяющую их дифференцировать. Какие методы количественного определения можно предложить?
1) Глицерин - Прозрачная, бесцветная, сиропообразная жидкость без запаха, сладкого вкуса, нейтральной реакции.
Ткип = 290 0С, Плотность 1,223-1,233 г/см 3
Подлинность глицерина:
- образование акролеина под действием водоотнимающих средств (Дегидратация глицерина в присутствии калия гидросульфата приводит к
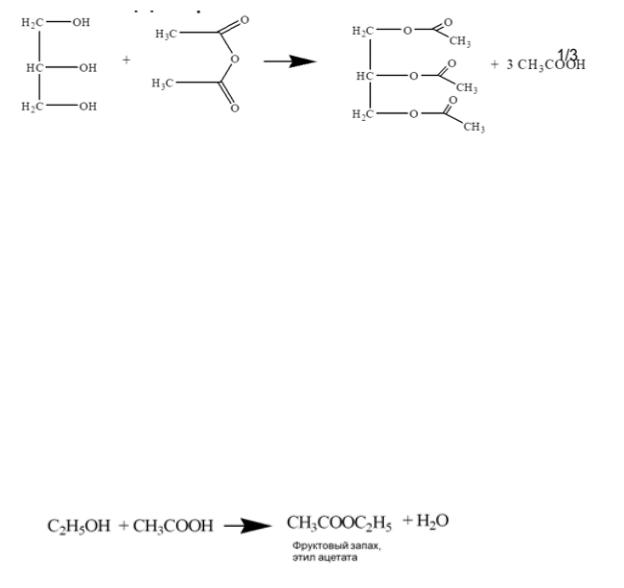
образованию непредельного альдегида – акролеина, характеризующегося неприятным специфическим и раздражающим запахом).
- образование глицерата меди (ею можно отличить спирт этиловый от глицерина) синее окрашивание.
CuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
Кол.опр.глицерина:
-Метод ацитилирования. Глицерин взаимодействует с уксусным ангидридом в присутствии безводного ацетата натрия при нагревании. Образующуюся уксусную кислоту титруют щелочью. Индикатор фенолфталеин до розового окрашивания.
CH3COOH + NaOH = CH3COONa + H2O
Одновременно будет титроваться кислота, образовавшаяся при гидролизе избытка уксусного ангидрида, поэтому необходима постановка контрольного опыта.
ФС на препарат регламентирует определение таких показателей как плотность, температура кипения, предел кислотности и щелочности.
2) Спирт этиловый 95% (C2H5OH) Прозрачная, бесцветная, легко летучая жидкость с характерным запахом. Ткип = 78 0С, плотность 0,812 г /см 3 спирт от глицерина можно отличить по плотности.
Кислотные свойства
Спирты как кислоты взаимодействуют с активными металлами (K, Na, Ca) с образованием алкоголятов: 2C2H5OH + 2Na 2C2H5ONa + Н2 ↑
Основные свойства
C2H5OH + HCl [C2H5OH2]+Cl−
Подлинность:
1) Реакция этерификации
Количественное определение:
-Метод основан на окислении спирта до ацетальдегида с помощью 0,1М раствора дихромата калия. Избыток последнего устанавливают йодометрическим методом (индикатор крахмал).

K2Cr2O7 + 6KI + 14 HNO3 = 2 Cr(NO3)3 + 3I2 + 8KNO3 +7H2O I2 + 2 Na2S2O3 = 2NaI + Na2S4O6
-оптимальным является ГЖХ.
Чистота спирта этилового: плотность, предел кислотности или щелочности. Спирт этиловый не должен содержать примесей метанола, сивушных масел, альдегидов, фурфурола.
4. Методы диспергирования компонентов при получении суспензий в условиях промышленного производства, показатели качества суспензий. Аппаратура для диспергирования при производстве суспензий, принципы работы.
|
Дисперсионный метод |
Конденсационный метод |
Суть |
Основан на измельчении частиц |
Основан на замене |
метода |
ЛВ механическими способами, с |
растворителя; при этом к |
|
помощью ультразвука и др. При |
дисперсионной среде, в |
|
получении суспензии |
которой ЛВ нерастворимо, |
|
дисперсионным методом |
добавляют раствор ЛВ в |
|
учитывают степень |
растворителе, который |
|
гидрофильности или |
смешивается с |
|
гидрофобности ЛВ, вводимого в |
дисперсионной средой. |
|
состав суспензии. |
|
Получение суспензий на крупных фармацевтических предприятиях осуществляется:
1.интенсивным механическим перемешиванием с помощью быстроходных мешалок и роторно-пульсационных аппаратов;
2.размолом твердой фазы в жидкой среде на коллоидных мельницах;
3.ультразвуковым диспергированием с использованием магнитострикционных и электрострикционных излучателей;
4.конденсационным способом.
Для получения суспензий применяют коллоидные мельницы, которые работают по принципу истирания твердых частей, фракционирования, удара или истирания и удара. Измельчение происходит в жидкой среде.
Для механического диспергирования суспензий наиболее часто применяются пропеллерные, дисковые и турбинные мешалки закрытого и открытого типа. Более тонко диспергированные и стойкие эмульсии можно получить с помощью турбинных мешалок, которые создают турбулентное движение жидкости. Турбинные мешалки бывают двух типов — открытого и закрытого.
Оценка качества суспензий Оценку качества суспензий проводят на основании материалов ГФ 14.

5. Приведите латинские названия сырья змеевика, производящих растений, семейства. Укажите химический состав и применение сырья.
Bistortae rhizomata (бистортэ ризомата) - корневища змеевика
Собранные после отцветания, очищенные от корней, остатков листьев и стеблей, отмытые от земли и высушенные корневища дикорастущих многолетних травянистых растений змеевика большого (горца змеиного) – Bistorta major (бисторта майор) и змеевика мясо-красного (Bistorta carnea). Сем. Гречишых – Polygonaceae (полигонацэ).
Химический состав. В корневищах содержатся дубильные вещества, свободные полифенолы (галловая кислота и катехин), крахмал, оксалат кальция.
Применение: оказывает вяжущее, резорбтивное, успокаивающее, противовоспалительное действие. Используют при заболевании лор органов, язва желудка, при кровотечениях.
Микроскопия на всякий
На поперечном срезе видно, что корневище имеет пучковый тип строения. Снаружи оно покрыто тонким слоем темно-бурой пробки.
Проводящие пучки расположены кольцом, овальной или веретеновидной формы (в сечении), коллатеральные, открытые.
С наружной (со стороны флоэмы) и внутренней (со стороны ксилемы) стороны к пучкам примыкают небольшие группы слабоутолщенных, слегка одревесневших склеренхимных волокон.
6. В каких случаях, и каким организациям разрешается ввоз в РФ незарегистрированных ЛП? Какой документ кроме обязательных, импортеру необходимо предоставить в таможенный орган для пропуска незарегистрированных ЛП через таможенную границу РФ? Кем выдается данный документ?
Ввоз ЛС в РФ осуществляется в порядке, установленном Правительством РФ, в соответствии с таможенным законодательством Таможенного союза в рамках ЕврАзЭС и (или) законодательством РФ о таможенном деле. Допускается ввоз в РФ конкретной партии незарегистрированных ЛС, предназначенных для проведения клинических исследований ЛП, проведения экспертизы ЛС для осуществления гос регистрации ЛП или для оказания мед помощи по жизненным показаниям конкретного пациента на основании разрешения, выданного уполномоченным федеральным органом исполнительной власти по заявлениям лиц.
В РФ можно ввозить ЛС, качество которых подтверждено сертификатом производителя ЛС, удостоверяющим соответствие ввозимых ЛС требованиям фармакопейных статей.
Лекарственные средства в РФ могут ввозить:
1)производители ЛС для целей собственного производства ЛС;
2)иностранные разработчики ЛС и иностранные производители ЛС для проведения клинических исследований ЛП, осуществления гос регистрации ЛП, включения фарм субстанции в ГРЛС, контроля качества ЛС при
наличии разрешения уполномоченного федерального органа исполнительной власти на ввоз конкретной партии ЛС;
3)организации оптовой торговли ЛС;
4)научно-исследовательские организации, образовательные организации высшего образования, производители ЛС для разработки, исследований, контроля безопасности, качества, эффективности ЛС при наличии разрешения уполномоченного федерального органа исполнительной власти;
5)мед организации для оказания мед помощи по жизненным показаниям конкретного пациента при наличии разрешения уполномоченного федерального органа исполнительной власти на ввоз конкретной партии ЛП, выданного в установленном порядке в форме электронного документа, подписанного усиленной квалифицированной электронной подписью.
Представляются следующие документы:
1)сертификат производителя ЛС, удостоверяющий соответствие ввозимого ЛС требованиям ФС или НД.
2)разрешение уполномоченного федерального органа исполнительной власти на ввоз конкретной партии ЛС.
Документы представляются в таможенные органы РФ при прибытии ЛС в РФ.
