
С 45
.pdf
Ситуационная задача № 45
Влабораторию поступил ЛП Фенхеля плоды, расфасованные на фармацевтической фабрике по 50 г в пакеты бумажные с последующим вложением в пачки картонные. Аналитик провел исследование упаковки, изучил маркировку и определил содержание действующих веществ. В протоколе анализа он отметил: маркировка нечеткая, неполная (отсутствует номер серии, данные производителя, штрих-код). Упаковка соответствует требованиям нормативного документа. Содержание эфирного масла составляет 5%.
Вусловиях фармацевтического производства из плодов фенхеля получают также масло фенхеля.
Заместитель заведующего аптекой в результате маркетингового анализа принял решение о закупке ЛП Фенхеля плоды 50,0 г у организации оптовой торговли ЛС. Был заключен договор поставки с условием доставки товара в аптеку. Менеджер оптовой организации на следующий день позвонил в аптеку и предложил забрать товар самовывозом. Аптека отказалась. Товар в установленный графиком срок поставки не был доставлен. После принятия аптекой мер, оптовая организация доставила в аптеку плоды фенхеля с неполной и нечеткой маркировкой на части упаковок. Аптека провела приемочный контроль.
Примечание. Справочная информация. Государственная Фармакопея 15 издания, ФС.2.2.0020 «Вода очищенная» Описание. Бесцветная прозрачная жидкость. рН. От 5,0 до 7,0 (ОФС «Ионометрия», метод 3). К 100
мл воды очищенной прибавляют 0,3 мл насыщенного раствора калия хлорида. Кислотность или щёлочность. К 20 мл воды очищенной прибавляют 0,05 мл фенолового красного раствора 0,1 %. При появлении жёлтого окрашивания оно должно измениться на красное при прибавлении не более 0,1 мл 0,01 М раствора натрия гидроксида. При появлении красного окрашивания оно должно измениться на жёлтое при прибавлении не более 0,15 мл 0,01 М раствора хлористоводородной кислоты. Электропроводность. В соответствии с ОФС «Электропроводность». Сухой остаток. Не более 0,001 %. Выпаривают 100 мл воды очищенной досуха и сушат при температуре 102,5±2,5 °С до постоянной массы. Восстанавливающие вещества. Доводят до кипения 100 мл воды очищенной, прибавляют 0,1 мл 0,02 М раствора калия перманганата и 2 мл серной кислоты разведённой 16 %, кипятят в течение 10 мин; розовое окрашивание должно сохраниться. Аммоний. Не более 0,00002 % (0,2 ppm). Кальций и магний. К 100 мл воды очищенной прибавляют 2 мл аммония хлорида буферного раствора рН 10,0, 50 мг индикаторной смеси эриохрома чёрного Т и 0,5 мл 0,01 М раствора натрия эдетата; должно наблюдаться чисто синее окрашивание раствора (без фиолетового оттенка). Нитраты и нитриты. Не более 0,00002 % (0,2 ppm). Сульфаты. К 10 мл воды очищенной прибавляют 0,1 мл хлористоводородной кислоты разведённой 7,3 % и 0,1 мл бария хлорида раствора 6,1 %. В течение не менее 1 ч не должно наблюдаться помутнение. Хлориды. К 10 мл воды очищенной прибавляют 0,5 мл азотной кислоты, 0,5 мл серебра нитрата раствора 2 %, перемешивают и выдерживают в течение 5 мин. Не должно быть опалесценции. Углерода диоксид. При взбалтывании воды очищенной с равным объёмом кальция гидроксида раствора (известковой воды) в наполненном доверху и хорошо закрытом сосуде не должно быть помутнения в течение 1 ч.
Тяжёлые металлы. Не более 0,00001 % (0,1 ppm). Микробиологическая чистота. Общее число аэробных микроорганизмов (бактерий и грибов) – не более 100 КОЕ в 1 мл. Не допускается наличие Еscherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa в 100 мл.
Задание (вопросы):
1. На основании полученных в лаборатории результатов сделайте заключение о возможности дальнейшего продвижения препарата на фармацевтическом рынке.
Приведите латинские названия фенхеля, его сырья и семейства. Какие действующие вещества содержатся в плодах фенхеля? Как следует поступать с растительным сырьем, если содержание действующих веществ в нем ниже нормы?
Федеральный закон от 12.04.2010 N 61-ФЗ "Об обращении лекарственных средств". Статья 46. Маркировка лекарственных средств.

ЛП, за исключением ЛП, изготовленных аптечными организациями должны поступать
вобращение, если:
1)на их первичной упаковке (за исключением первичной упаковки ЛРС) хорошо читаемым шрифтом на русском языке указаны наименование ЛП , номер серии, дата выпуска, срок годности, дозировка или концентрация, объем, активность в единицах действия или количество доз;
2)на их вторичной (потребительской) упаковке хорошо читаемым шрифтом на русском языке указаны наименование ЛП , наименование производителя ЛП, номер серии, дата выпуска, номер регистрационного удостоверения, срок годности, способ применения, дозировка или концентрация, объем, активность в единицах действия либо количество доз в упаковке, лекарственная форма, условия отпуска, условия хранения, предупредительные надписи. На вторичную (потребительскую) упаковку лекарственных растительных препаратов должна наноситься надпись:
"Продукция прошла радиационный контроль".
Поступивший препарат не соответствует по показателю «Маркировка». При нечеткой и неполной маркировке (отсутствует номер серии, данные производителя, штрих-код) данное сырье невозможно к дальнейшему продвижению на фармацевтическом рынке.
Качество плодов фенхеля регламентирует ГФ 14 Ф.С.2.5.0102.18. Латынь:
1)Фенхеля обыкновенного плоды - Foeniculi vulgaris fructus (Фоэникули вульгарис фруктус)
2)Собранные зрелые и высушенные плоды культивируемого двухлетнего и многолетнего травянистого растения фенхеля обыкновенного – Foeniculum vulgare
(фоэникулюм вульгарэ). (Плоды - плоды различных морфологических типов, отдельные плодики, соплодия и их части. Плоды собирают зрелыми, иногда в фазу технической зрелости и высушивают. Некоторые сочные плоды перерабатывают свежими)
3)Сем. сельдерейных – Apiaceae (апиацээ).
Химический состав. Эфирное масло. Компонентом его является анетол. Содержатся также жирное масло и белковые вещества.
Фармакологические свойства. Применяют при метеоризме, как отхаркивающее, иногда для улучшения вкуса в микстурах. "Ветрогонное" действие обусловлено главным образом спазмолитическим влиянием на мышечный слой кишечника.
2. К какому типу масел (по физико-химическим свойствам) относится масло фенхеля? Особенности и физико-химические основы, используемые при производстве указанного продукта.
Анетол-фенилпропаноидные соединения, ароматический эфир Масло фенхеля представляет собой бесцветную или слегка желтоватую маслянистую
жидкость, обладающим специфическим пряным ароматом. Основным веществом является анетол, а также продукты окисления этого элемента: анисовая кислота, дипентен, пинен. Компоненты эфирных масел легко вступают в реакции окисления, изомеризации, полимеризации, присоединяют галогены, кислород, серу. На свету в присутствии кислорода воздуха эфирные масла окисляются, меняют цвет (темнеют) и запах.
На физико-химической основе (эфирное масло – как летучее вещество) и основана технология его получения (перегонка):
1)измельчение сырья фенхеля на измельчителе ИТС-8
2)измельченное сырье транспортером подается в аппарат НДТ-ЗМ
3)Смесь паров эфирного масла и воды конденсируются в теплообменнике

4)дистиллят охлаждается до температуры 35-42оС и поступает в маслоотделитель, где происходит отделение эфирного масла от воды (декантация).
5)Первичное масло-сырец направляется в сборник, далее насосом на вакуум-сушку в вакуум-аппарат и через фильтр в сборник эфирного масла.
3.Факторы, оказывающие влияние на выбор поставщика, правила заключения договора поставки. Каким образом оформляются разногласия между аптекой и поставщиком? Какие возможные способы доставки товара в аптеку Вам известны?
Приказ Минздрава России от 31.08.2016 N 647н "Об утверждении Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения".
Процедура выбора поставщика состоит из трех основных этапов:
1)выявление всех потенциальных источников, производящих или поставляющих необходимую продукцию;
2)оценка выявленных поставщиков по определенным критериям;
3)завершение выбора оформлением договорных отношений.
Классификация факторов, влияющих на выбор поставщика АО
1)ценовые (вопросы размера предоплаты, отсрочки платежей, различных скидок и ценовых акций поставщиков).
2)товарные (ассортимент поставляемой продукции (товаров); качество поставляемой продукции (товаров));
3)организационные (сроки поставки, транспорт доставки, возможность экстренных поставок продукции (товаров), уровень автоматизации товарооборота и т.п.);
4)деловые (репутации поставщика: с кем он уже сотрудничает, как долго, не замешен
ли в судебных разбирательствах и т.п.).
Договор поставки – один из видов договоров купли-продажи, в силу которого поставщик-продавец, осуществляющий предпринимательскую деятельность, обязуется передать в обусловленный срок или сроки производимые либо закупаемые им товары покупателю для использования в предпринимательской деятельности или в других целях, не связанных с личным, семейным, домашним или иным подобным использованием. Субъект розничной торговли и поставщик заключают договор с учетом требований законодательства об основах гос. регулирования торговой деятельности в РФ, а также с учетом требований гражданского законодательства, предусматривающих сроки принятия поставщиком претензии по качеству продукции, а также возможность возврата фальсифицированных, недоброкачественных, контрафактных товаров аптечного ассортимента поставщику, если информация об этом поступила после приемки товара и оформления соответствующих документов. Договоры поставки заключаются только в письменной форме.
Договор поставки содержит следующие разделы:
1)Предмет договора.
2)Условия поставки. В разделе отражено, в какой срок с момента заказа производится доставка товара, когда право собственности на товар переходит к покупателю, каким транспортом осуществляется доставка.
3)Права и обязанности сторон. В разделе содержится информация о способах заказа товара и его доставки, о качестве товара, о сопутствующих документах и т.д.
4)Порядок приемки товара и направления претензий. Этот раздел контракта содержит сведения о приемке товара по качеству и по количеству, о правилах выставления претензий и возврате товара поставщику.
5)Срок действия договора.
6)Прочие условия (заключительные положения)
7)Адреса, реквизиты и подписи сторон.

Если при заключении договора поставки между сторонами возникли разногласия по отдельным условиям договора, сторона, предложившая заключить договор, должна в течение 30 дней со дня получения этого предложения, принять меры по согласованию соответствующих условий договора либо письменно уведомить другую сторону об отказе от его заключения.
Сторона, получившая предложение по соответствующим условиям договора, но не принявшая мер по согласованию условий договора поставки и не уведомившая другую сторону об отказе от заключения договора в срок, обязана возместить убытки, вызванные уклонением от согласования условий договора.
3 варианта доставки товаров в аптеку:
1)Аптека сама получает товары на складе поставщика и самостоятельно вывозит их. Доверенность подтверждает право материально ответственного лица аптеки на получение товаров.
2)Поставщик поставляет товары своим транспортом.
3)Поставщик поставляет товары через транспортные организации.
4. Какие требования рекомендует НАП учитывать аптечной организацией при подборе поставщиков ЛП и ТАА? Пакет сопроводительных документов, который обязан предоставить вместе с товаром оптовый поставщик в аптечную организацию, кто
осуществляет приемку товаров, кто осуществляет |
приемочный контроль ЛП? НПА |
|
регламентирующие порядок приемки различных групп ЛП и ТАА. |
|
|
Должностные обязанности лица, ответственного за внедрение и обеспечение системы |
||
качества в субъекте розничной торговли - аптечной |
организации. Ваши действия в случае |
|
отсутствия документов, подтверждающих качество поставляемой продукции. Зоны карантинного хранения.
Проверка сопроводительной документации при поступлении товара:
1)договор поставки,
2)товарная накладная,
3)протокол согласования цен поставки ЖНВЛП,
4)счет,
5)счет-фактура,
6)реестр сертификатов соответствия к накладной;
7)документы, подтверждающие качество товара (для ЛП - декларация о
соответствии, если БАД - удостоверение о качестве и безопасности). Отсутствие указанных сопроводительных документов или некоторых из них не
приостанавливает приемку продукции. В этом случае составляется акт о фактическом качестве и комплектности поступившей продукции и в акте указывается, какие документы отсутствуют.
Приемка товаров аптечного ассортимента осуществляется материально ответственным лицом. Если товары аптечного ассортимента находятся в транспортной таре без повреждений, то приемка может проводиться по количеству мест или по количеству товарных единиц и маркировке на таре. Если проверка фактического наличия товаров аптечного ассортимента в таре не проводится, то необходимо сделать отметку об этом в сопроводительном документе.
Приемочный контроль заключается:
1)в проверке поступающих ЛС на соответствие требованиям по показателям:
"Описание"; "Упаковка"; "Маркировка".
2)В проверке правильности оформления расчетных документов, а также наличия сертификатов соответствия производителя и других документов, подтверждающих качество ЛС в соответствии с действующими нормативными документами.
Должностные обязанности уполномоченного по качеству:
1)Контроль всех этапов обращения продукции в аптеке (закупка, приемка и приемочный контроль, распределение по местам хранения, хранение, изготовление

ЛС, внутриаптечное перемещение товара, распределение и контроль при отпуске ЛС на соответствие требованиям действующих нормативных актов, регламентирующих фармацевтическую деятельность.)
2)Анализ и систематизация поступающей в аптеку информации по качеству ЛС, а также сведений о забракованной и фальсифицированной продукции.
3)Информирование контролирующих организаций, руководителя аптеки и руководителей структурных подразделений о некачественных ЛС.
4)Организация возврата поставщику недоброкачественных ЛС и передача изымаемых из обращения ЛС организации, осуществляющей их уничтожение.
5)Проведение внутренних проверок.
6)Разработка мероприятий, направленных на повышение эффективности системы управления качеством в организации.
7)Анализ результатов внутренних проверок и формирование программы корректирующих действий по устранению выявленных недостатков.
8)Проведение мероприятий по систематическому повышению квалификации и профессиональной компетентности специалистов.
9)Контроль за соблюдением санитарного режима в соответствии с действующими нормативными документами и своевременное прохождение ежегодных медицинских осмотров.
5.Как в аптеке должно быть организовано изготовление внутриаптечной заготовки в соответствии с ФЗ-61? Из каких элементов складывается розничная цена концентратов, полуфабрикатов? Привести примеры концентратов, полуфабрикатов аптечного изготовления.
Изготовление ЛП аптечными организациями, имеющими лицензию на фарм деятельность, осуществляется по рецептам на ЛП, по требованиям мед организаций в соответствии с правилами изготовления и отпуска ЛП, утвержденными уполномоченным федеральным органом исполнительной власти.
Используются фарм субстанции, включенные в гос реестр ЛС для мед применения в установленном порядке.
Маркировка ЛП, изготовленных аптечными организациями, имеющими лицензию на фарм деятельность, и оформление таких препаратов должны соответствовать правилам приказа 751н "Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, индивидуальными предпринимателями, имеющими лицензию на фармацевтическую деятельность".
Концентраты - заранее изготовленные растворы лекарственных веществ более высокой концентрации, чем концентрация, в которой эти вещества выписываются в рецептах. Концентраты предназначены для быстрого и качественного изготовления жидких ЛФ. Рекомендуется их изготавливать из веществ гигроскопичных, выветривающихся, содержащих значительное количество кристаллизационной воды. Концентраты изготавливают по мере необходимости с учетом срока их годности (30 суток). Концентрированные растворы изготавливают массообъемным методом в мерной посуде (колбы, цилиндры) в асептических условиях в соответствии с требованиями действующей инструкции, используя свежеполученную воду очищенную.
Полуфабрикаты — это недозированный вид заготовки, применяемый в смеси с другими ингредиентами, являющийся составной частью сложной ЛФ.
Цена ЛП аптечного изготовления состоит из стоимости:
1)лекарственных веществ, в т.ч. воды;
2)аптечной посуды (тары);
3)вспомогательных материалов (пробок, колпачков, этикеток и т.п.);
4)тарифа за изготовление (т.е. стоимости работ по изготовлению заготовки).

Стоимость цен на ЛВ, посуду, вспомогательные материалы и величина тарифов определяется руководителем аптечной организации.
Лабораторные и фасовочные работы учитываются в журналах учета лабораторных и фасовочных работ. Эти журналы должны быть постранично пронумерованы, прошнурованы, скреплены печатью аптеки и подписями директора и главного бухгалтера. Записи в журнал вносятся немедленно, после окончания соответствующей работы. Журналы учета лабораторных и фасовочных работ ведутся не только для регистрации их работ, но и для оприходования или списания сумм по размерам округления цен за единицу фасовки.
Ассортимент концентратов можно найти в приказе МЗ РФ №751н: к ним относится кальция хлорид, глюкоза безводная, магния сульфат, кислота аскорбиновая, калия бромид, натрия салицилат, Калия хлорид, Натрия хлорид, Натрия йодид, Натрия бромид, Калия йодид.
6. Какие требования предъявляются к воде очищенной? В чем отличие воды очищенной от воды для инъекций? Приведите классификацию примесей в воде очищенной в зависимости от степени допустимости.
Вода очищенная получается методом дистилляции, обратным осмосом, ионным обменом и другими методами. Вода очищенная должна соответствовать определенным требованиям ФС.2.2.0020.18
Описание - Бесцветная прозрачная жидкость без запаха.
Вода очищенная ежедневно проверяется на отсутствие хлоридов, сульфатов и солей кальция. Результаты фиксируются в журнале регистрации результатов контроля воды очищенной. ФС.2.2.0020.18
Вода для инъекций, кроме указанных выше испытаний, должна быть проверена на отсутствие восстанавливающих веществ, аммиака и углекислоты в соответствии с требованиями ГФ. ФС.2.2.0019.18
Ежеквартально вода направляется в контрольно-аналитическую лабораторию для полного химического анализа.
При проведении химического контроля очищенной воды и воды для инъекций в журнале регистрации результатов контроля воды очищенной, воды для инъекций в обязательном порядке указываются:
1)дата получения (отгонки) воды;
2)дата контроля воды;
3)номер проведенного химического анализа;
4)номер баллона /бюретки, из которых взята на анализ вода;
5)результаты контроля на отсутствие примесей;
6)показатели рН среды;
7)заключение о результатах анализа воды (удовлетворяет/не удовлетворяет);
8)подпись лица, проводившего анализ.
9)Журнал пронумерован, прошнурован и скреплен подписью руководителя учреждения и печатью вышестоящей организации.
Вода должна быть бесцветная, прозрачная жидкость без запаха и вкуса, рН в пределах 5-7.
1. В воде очищенной не должно быть восстанавливающих веществ.
Определение: 100 мл воды очищенной доводят до кипения, прибавляют раствор калия перманганата и 2 мл серной кислоты разведенной, кипятят 10 мин. Розовая окраска раствора должна сохраниться:
MnO4 + 8H+ +5ē → Mn2+ + 4H2O
2. В воде очищенной не должно быть углекислого газа.
Обнаруживают его по помутнению в присутствии известковой воды Са(ОН)2
CO2 + Ca(OH)2 → CaCO3 + H2O
3. В воде очищенной должны отсутствовать нитраты и нитриты
К 5 мл воды очищенной осторожно прибавляют 1 мл свежеприготовленного раствора дифениламина; не должно появляться голубое окрашивание.
4. В воде очищенной допускается содержание иона аммония в пределах не более
0,00002%.
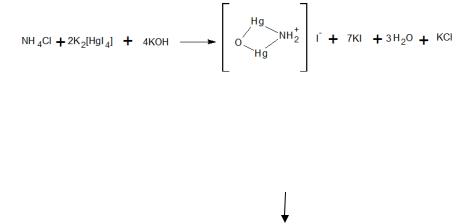
В испытуемой воде и в эталонном растворе проводят реакцию с реактивом Несслера (раствор K2HgI4 в КОН). Окраска в испытуемой воде не должна быть интенсивнее, чем в эталонном растворе:
В воде очищенной должны отсутствовать:
5.Хлорид-ионы открывают по реакции с раствором AgNО3 в присутствии HNO3. Не должно быть помутнения или опалесценции. Cl¯ + AgNO3 → AgCl белый + NO3¯
белый + NO3¯
*Опалесценция-резкое усиление рассеяния света чистыми веществами
6.Сульфаты обнаруживают по реакции с раствором ВаСl2 в присутствии НСl. Не должно
быть помутнения. SO42-+ BaCl2 → BaSO4 белый + 2Cl-
7.Ионы кальция обнаруживают по реакции с раствором оксалата аммония в присутствии аммиачного буфера. Не должно быть помутнения. Ca2+ + (NH4)2C2O4 → CaC2O4 + 2NH4+
8.Ионы тяжелых металлов обнаруживают по реакции с раствором натрия сульфида в среде кислоты уксусной. Pb2+ + Na2S → PbS черный + 2Na+. (метод 1 из ссылки)
черный + 2Na+. (метод 1 из ссылки)
Микробиологическая чистота. Не более 100 микроорганизмов в 1 мл при отсутствии бактерий сем. Enterobacteriaceae, Staphylococcus aureus, Pseudomonas aeruginosa. Проверка осуществляется в Центре контроля качества ежеквартально.
Хранение. Вода очищенная хранится в закрытых емкостях, изготовленных из материалов, не изменяющих свойства воды и защищающих ее от инородных частиц и микробиологических загрязнений.
Воду для инъекций получают из воды очищенной методом дистилляции. Вода для инъекций должна быть стерильной, апирогенной. Подвергается тем же испытаниям, что и вода очищенная, более жесткие требования к определению микробиологической чистоты. При определении микробиологической чистоты: общее число аэробных микроорганизмов (бактерий и грибов) не более 10 КОЕ в 100 мл. Не допускается наличие Еscherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa в 100 мл. Для анализа микробиологической чистоты воды для инъекций отбирают образец в объеме не менее 1000 мл.
