
С 32
.pdf
Ситуационная задача № 32
В производственный отдел аптеки поступил рецепт на рецептурном бланке формы № 148-1/у-88 ребенку 9 лет с пометкой Cito! состава:
Rp.: Pyridoxini hydrochloride ………………0,004
Rutini …………………………………….0,01
Riboflavini …………………………….... 0,006
Acidi nicotinici
Acidi ascorbinici
Acidi glutaminici ana ……………………0,05
Dextrosi ……………………………….0,25
Misce fiat pulvis.
Da tales doses № 6.
Signа. По 1 порошку 2 раза в день.
После изготовления провизор-аналитик аптеки провел анализ порошков данного состава. Для обнаружения рибофлавина к порошку прибавил 2 капли концентрированной серной кислоты, появилось красное окрашивание. Наличие кислоты аскорбиновой определялось по обесцвечиванию раствора йода, кислоты глутаминовой - нингидриновой пробой. Содержание рибофлавина в порошке провизор-аналитик определял методом спектрофотометрии, а сумму кислот - титрованием 0,1 М раствором натрия гидроксида
Большое внимание уделяется и промышленному производству порошков. Для получения сырья с целью производства витаминных порошков в фармацевтической практике широко используется витаминоносное лекарственное растительное сырье.
Задание (вопросы):
1. Проведите фармацевтическую экспертизу рецепта. Что означает требование врача Сito! в свете вступившего в силу с 1 марта 2022 года нового НПА, регламентирующего порядок отпуска ЛП? Какое решение в ходе фармацевтической экспертизы может быть принято по рецепту в зависимости от формы бланка рецепта? Обоснуйте условия и технологию изготовления порошков.
Если лекарство нужно пациенту срочно или немедленно, то врач ставит в верхней части рецепта пометку «cito» (срочно), рецепт обслуживается в срок, не превышающий 2 дней. Приказ 1093н.
Рецепт выписан не верно. Рецепт должен быть выписан на бланке формы №107-1/у, заверенный личной печатью и подписью врача.
Неправильно выписанные рецепты погашаются штампом "Рецепт недействителен" и регистрируются в журнале и возвращаются больному на руки. Информация о них передается руководителю соответствующего ЛПУ для принятия мер дисциплинарного воздействия к работникам, нарушающим правила выписывания рецептов. Компоненты совместимы Проверка доз для никотиновой кислоты
ВРД 0,03 РД=0,05 РД испр. 0,03* 1\2 = 0,015 ВСД 0,09 СД=0,1
Дозы завышены, врач должен написать дозу этого средства или вещества прописью и поставить восклицательный знак. В данном рецепте такого нет, порошки готовят из расчета на один прием ½ дозы указанной в ГФ как ВРД.

Лицевая сторона |
Обратная |
|
|
Дата № рецепта |
Пиридоксина гидрохлорида |
Glucosi 1,5 |
0,004*6=0,024 Рутина 0,01*6=0,06 |
Pyridoxini hydrochloridi 0,024 |
Рибофлавина 0,006*6=0,036 |
Rutini 0,06 |
Кислоты никотиновой 0,015*6=0,09 |
Acidi nicotinici 0,09 |
Кислоты аскорбиновой 0,05*6=0,3 |
Acidi ascorbinici 0,3 |
Кислоты глутаминовой 0,05*6=0,3 |
Acidi glutaminici 0,3 |
Глюкозы 0,25*6=1,5 |
Riboflavini 0,036 |
Масса общая 2,31 |
По 0,39 № 6 mобщ= 2,31 |
Масса 1 порошка 2,31:6=0,39 |
Изготовил |
|
Проверил |
|
|
|
Рабочее место оборудуется и подготавливается в соответствии с требованиями постановления главного государственного санитарного врача РФ №44 (сан. Режим). Изготовление порошков ведут в соответствии с требованиями общей статьи ГФ 14 изд. «Порошки». Паспорт письменного контроля оформляется в соответствии с приказом МЗ РФ № 249н.
Т.к. рибофлавин – красящее вещество. Изготавливают в ступке для красящих веществ (красящее вещество добавляется в последнюю очередь между слоями некрасящих веществ по правилу пирожка). Учитывая общую массу порошков (2,31 г) выбирают ступку № 4. Затирают ступку наиболее индифферентным веществом (в данном случае это глюкоза). На электронных весах отвешивают 1,5 г глюкозы, затирают поры, и выкладывают на капсулу, оставляя в ступке количество примерно равное массе пиридоксина, (далее действуют по принципу от меньшего к большему) добавляют пиридоксин и перемешивают, затем добавляем рутин,перемешиваем, кислоту никотитновую, перемешиваем, кислоту аскорбиновую, перемешиваем, глутаминовую, перемешиваем, и затем по частям при постоянном перемешивании добавляем глюкозу с капсулы. Затем из ступки на капсулу выгружается часть смеси, в порошке в центре ступки делается углубление, и туда помещают рибофлавин, сверху засыпают порошком с капсулы и перемешивают до однородности.
Порошки упаковываем в парафинированные или вощеные капсулы и помещаем в бумажный пакет. Лекарственную форму оформляем этикеткой «Внутреннее» с указанием номера аптеки, Ф.И.О. больного, способа применения, даты изготовления, цены, предупредительными надписями, сигнатурой.
2. Из трех групп ЛС (фармацевтические субстанции, ЛП для медицинского применения промышленного производства, ЛП экстемпорального изготовления) выберите те, которые должны проходить государственную регистрацию в установленном порядке. Поясните значение Государственного реестра ЛС. Какой документ свидетельствует о результате завершения регистрации ЛС, кто его получает?
Государственную регистрацию должны проходить ЛП для медицинского применения. Также регистрируются субстанции входящие в ЛП, могут регистрироваться субстанции произведенные для реализации. ЛП экстемпорального изготовления не регистрируются.
Государственный реестр лекарственных средств (Гос реестр лекарственных средств) — перечень отечественных и зарубежных лекарств, медико-профилактических и диагностических средств, зарегистрированных Минздравом России.
При положительном заключении эксперты Минздрава России вносят препарат в государственный реестр лекарственных средств и выписывают Регистрационное удостоверение. При первой регистрации препарата в России регистрационное удостоверение выдается на 5 лет. По истечении данного срока производитель подает документы для подтверждения регистрации препарата и тогда уже регистрационное удостоверение выдается бессрочно.
При регистрации фарм субстанции выдается «Решение о включении фармацевтической субстанции в Государственный реестр лекарственных средств».
3. Дайте оценку действиям провизора-аналитика аптеки при контроле качества лекарственного препарата по прописи.
Правильно ли выбраны реакции для обнаружения компонентов смеси? Какими реакциями можно обнаружить в данном препарате декстрозу (глюкозу) и пиридоксина гидрохлорид? Способы количественного определения компонентов смеси. Как можно определить содержание кислоты аскорбиновой в данной прописи?
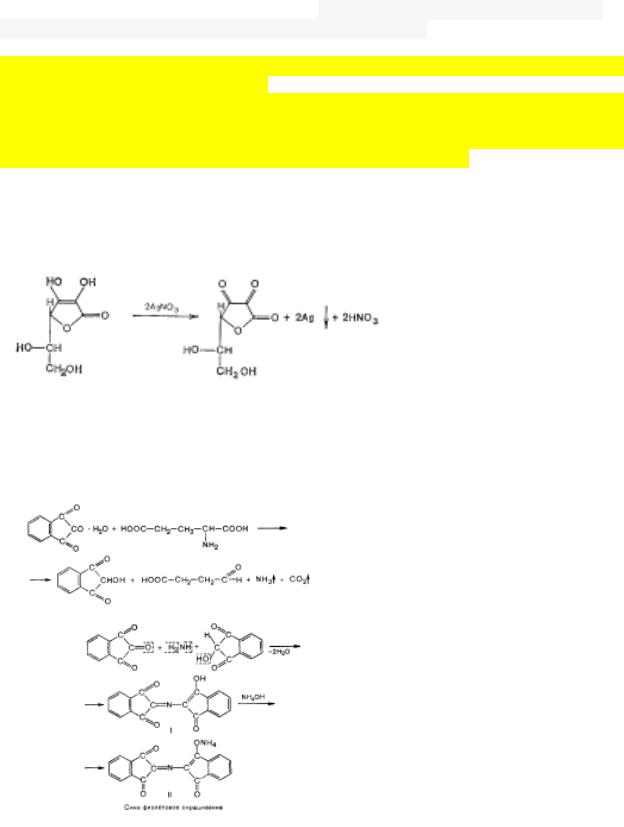
Для рибофлавина реакция подлинности правильная. При окислении препарата концентрированной серной кислотой образуется продукт красного цвета.
Для определения аскорбиновой кислоты - реакция серебряного зеркала
Для обнаружения грутаминовой кислоты – верная реакция. Групповой реакцией на альфааминокислоты является нингидриновая проба. Реакция проходит в несколько стадий. Вначале аминокислота разрушается (при нагревании в присутствии гидроксида натрия) с образованием альдегида, аммиака и углекислоты. Выделившийся аммиак сразу же вступает в реакцию с нингидрином и дикетогидрином. В результате реакции образуется аммонийная соль енольной формы, имеющая сине-фиолетовую окраску.
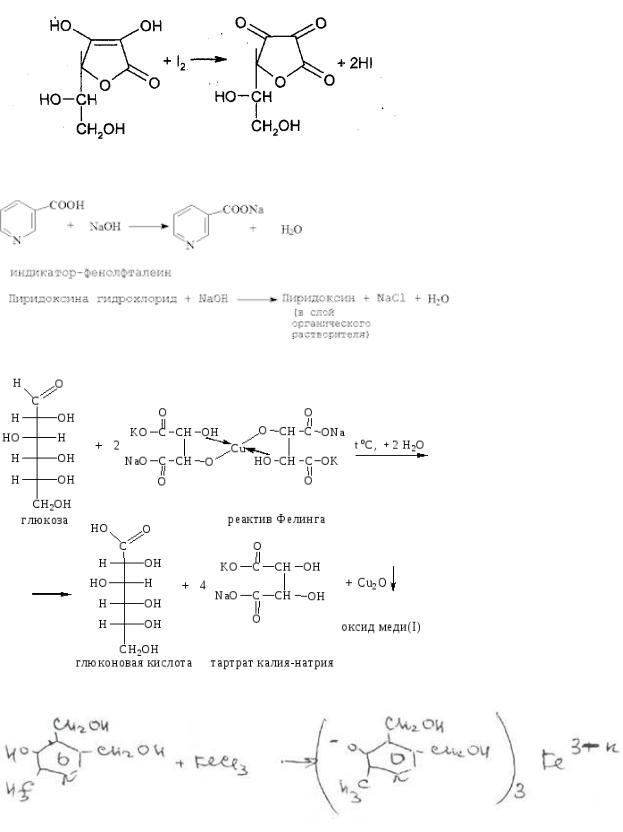
Содержание рибофлавина в порошке провизор-аналитик определял методом спектрофотометрииправильно.
Кислоту аскорбиновую можно определить отдельно (не в сумме) методом йодометрии.
КIO+5KI+6HCl=I2 +6 KCl+3H2O
Алкалиметрически определяется сумма: кислоты аскорбиновой, пиридоксина гидрохлорида, кислота глутаминовая и кислота никотиновая.
Глюкоза обнаруживается при нагревании с реактивом Фелинга, образуется кирпичнокрасный осадок оксида меди (I)
Пиридоксина гидрохлорид обнаруживают по красному окрашиванию после прибавления
FeCl3.
Рибофлавин окрашенный поэтому можно использовать спектрофотометрию. Кислота аскорбиная в отличие от других препаратов окисляется, поэтому используют, например,

метод йодометрии. Глюкозурефрактометрия, для определения глютаминовой кислоты навеску растворяют в холодной воде и она выпадает в осадок.
4. Вам необходимо, опираясь на общую технологическую схему промышленного производства порошков, объяснить принципы работы аппаратурного оснащения данного производства.
Процесс производства данной лекарственной формы состоит из следующих стадий:
1.Измельчение исходных материалов.
2.Разделение частиц порошка по размерам.
3.Смешивание отдельных компонентов.
4.Фасовка и упаковка.
Отвешивание компонетов – весы напольные Измельчение исходных материалов с помощью мельницы
Просеиваниевибрационное сито. При получении сложных порошков в заводских условиях каждое вещество, входящее в состав смеси, измельчают отдельно и просеивают сквозь соответствующее сито. Контролируют размер частиц.
Смешивание отдельных компонентов. Смешивание порошков производят в смесителях. Все компоненты засыпают в смеситель и перемешивают до получения однородной смеси. Если при указанных равных условиях удельная масса смешиваемых порошков различна, то тогда продолжительность перемешивания увеличивается.
Повторное просеивание – вибросито. При просеивании смесей через отверстия сита прежде всего проходят частицы более мелкие и обладающие большей удельной массой. Потом отсеиваются более легкие и более крупные частицы. В результате этого отсев представляет собой массу из слоев разного качества. Поэтому ингредиенты после просеивания необходимо смешать. (контролируют размер частиц смеси)
Повторное смешивание – смеситель (контролируют равномерность смешения). Смесители есть 1)барабанные ( для непрерывного и периодического смешивания сухих порошкообразных материалов), смешение в барабанах достигается путем вращения, для увеличения эффективности внутри барабанов устанавливают различные перегородки и насадки.2)шнековые – одновальные и двухвальные. Состоит из горизонтального корыта, в котором вращаются два параллельных вала с лопатками с разной скоростью. 3) лопастные – перемешивание массы путем ее перетирания между лопастями и стенками корыта.
Фасовка и упаковка – фасовка с помощью дозаторов. Элементы весового дозатора: объемный дозатор, служащий питателем, грузоприемное и измерительное устройство, системы регистрации и регулирования, исполнительное устройство.
5. Охарактеризуйте софору японскую как один из основных источников сырья для получения рутина: приведите латинские названия сырья, производящего растения, семейства; укажите сырьевую базу, применение в медицине.
Sophorae japonicae Alabastra (софорэ японикэ алябастра)— бутоны софоры японской Sophorae japonicae Fructus (софорэ японикэ фруктус)— плоды софоры японской Собранные и высушенные бутоны и зрелые плоды культивируемого дерева софоры японскойSophora japonica (софора японика) из сем. бобовых — Fabaceae. (фабацэ) Фармакологическая группа - Препарат с противомикробным, противовоспалительным и улучшающим регенерацию тканей действием для наружного применения.
Средство растительного происхождения, Содержит рутин, кемпферол-3-софорозид, кверцетин-3-рутинозид, флавоновые гликозиды.
Рутин укрепляет сердечную мышку, восстанавливает и сохраняет эластичность сосудов, препятствует отложению холестериновых бляшек и защищает от развития атеросклероза, понижает общее содержание холестерина в крови, уровень сахара и давления, а также

принимает участие в процессах кроветворения. Рутин применяется для профилактики и лечения анемии.
Распространение софоры японской: Япония, Китай, юг Европейской части (Кавказ и Крым). В России софора японская в диком виде почти не встречается, но широко культивируется на юге европейской части. Растение хорошо развивается на свежих суглинистых и супесчаных почвах, может расти на засоленных почвах, засухоустойчива, теневынослива, но страдает от холодных ветров и больших морозов.
6. Раскройте понятие «Ввоз ЛС в Российскую Федерацию». Назовите нормативные правовые акты, регулирующие ввоз ЛС в РФ. Кому разрешено ввозить ЛС в РФ? Каким требованиям должны соответствовать ЛС, ввозимые в РФ, для последующей их реализации?
Ввоз – фактическое пересечение товарами и транспортными средствами таможенной границы, и все последующие предусмотренные таможенным кодексом действия с товарами и транспортными средствами до их выпуска таможенными органами.
Федеральный закон "Об основах государственного регулирования внешнеторговой деятельности" от 08.12.2003 N 164-ФЗ
Федеральный закон "О таможенном регулировании в Российской Федерации"
от 27.11.2010 N 311-ФЗ
Федеральный закон "Об обращении лекарственных средств" от 12.04.2010 N 61-ФЗ
Федеральный закон "О наркотических средствах и психотропных веществах"
от 08.01.1998 N 3-Фз
Таможенный кодекс таможенного союза.
Договор о евразийском экономическом союзе.
Решение коллегии евразийской экономической комиссии.
Приказы Федеральной таможенной службы РФ.
Ввоз лекарственных средств в Российскую Федерацию осуществляется в порядке, установленном Правительством Российской Федерации, в соответствии с таможенным законодательством Таможенного союза в рамках ЕврАзЭС (далее - Таможенный союз) и (или) законодательством Российской Федерации о таможенном деле. Ввозимые в
Российскую Федерацию лекарственные средства должны быть включены в государственный реестр лекарственных средств. В Российскую Федерацию можно ввозить лекарственные средства, качество которых подтверждено сертификатом производителя лекарственных средств, удостоверяющим соответствие ввозимых лекарственных средств требованиям фармакопейных статей либо в случае их отсутствия нормативной документации или нормативного документа.
Лекарственные средства в Российскую Федерацию могут ввозить:
1)производители лекарственных средств
2)иностранные разработчики лекарственных средств и иностранные производители лекарственных средств или другие юридические лица по поручению разработчика лекарственного средства
3)организации оптовой торговли лекарственными средствами;
4)научно-исследовательские организации,
5)медицинские организации
Допускается ввоз в РФ конкретной партии зарегистрированных и (или) незарегистрированных ЛС, предназначенных для проведения клинических исследований ЛП, проведения экспертизы ЛС для осуществления государственной регистрации ЛП или для оказания медицинской помощи по жизненным показаниям конкретного пациента на основании разрешения, выданного уполномоченным ФОИВ.
