
С 22
.pdf
Ситуационная задача № 22
Фармацевтическое предприятие закупило фармацевтические субстанции сульфокамфорную кислоту и новокаин для производства раствора Сульфокамфокаина 10% в ампулах по 2 мл № 10 следующего состава:
Кислоты сульфокамфорной |
......49,6 (в пересчете на безводную) |
Новокаина - основания ............... |
50,4 |
Воды для инъекций .................. |
до 1 л |
Производство ЛП осуществлялось в соответствии с требованиями промышленного регламента (ПР) на данный лекарственный препарат. Готовый раствор Сульфокамфокаина 10% в ампулах поступил в ОТК фармацевтического предприятия для проведения аналитического контроля и подготовки заключения о качестве.
В аптеке для изготовления глазных капель используется концентрат состава Sol. Ac. Ascorbinici 2%. Провизор-технолог обсудил вопрос изготовления данного раствора с провизором-аналитиком.
На фармацевтическую фабрику для получения настойки поступило сырье аралии маньчжурской корни. Специалист ОТК отобрал пробу и провел контроль качества сырья.
Специалисты государственного унитарного предприятия «Фармация», имеющего свою розничную аптечную сеть, провели закупку ЛП путем открытого электронного аукциона. Одним из закупаемых ЛП был раствор Сульфокамфокаина 10% в ампулах по 2 мл № 10. Победителем аукциона оказалась организация оптовой торговли ЛС, предложившая самые низкие цены на ЛП. С ней был заключен договор. Приемочная комиссия ГУП «Фармация» при приемке товара от поставщика обнаружила, что одна из серий раствора Сульфокамфокаина 10% в ампулах по данным Росздравнадзора является контрафактной, другая серия этого ЛП – недоброкачественной.
Задание (вопросы):
1. Дайте сравнительную характеристику растворам для инъекций. Какие требования предъявляются к организации производства ЛП для инъекций на фармацевтическом предприятии? Как влияет на качество и стабильность растворов материал упаковки (например, стекло) и как учитывается это влияние при производстве ЛП для инъекций?
ОФС.1.4.1.0007.15 «Лекарственные формы для парентерального применения». Раствор для инъекций– водный или неводный раствор лекарственного
вещества/веществ в соответствующем растворителе, предназначенный для инъекционного введения.
Все ЛФ для парентерального применения должны выдерживать испытание ОФС «Стерильность», «Бактериальные эндотоксины» или «Пирогенность», «Механические включения»
В жидких ЛФ контролируют показатель «рН» в соответствии с требованиями ОФС «Ионометрия».
Растворы для инъекций дополнительно проверяют по показателям: «Прозрачность», «Цветность».
Вода, используемая при производстве ЛФ для парентерального применения, должна соответствовать требованиям ФС «Вода для инъекций».
В качестве водных растворителей̆, кроме воды для инъекций, можно использовать изотонический раствор натрия хлорида, раствор Рингера, раствор глюкозы 5 % и др., неводных – жирные растительные масла или другие органические растворители.
Всостав лекарственных форм для парентерального применения могут быть добавлены антимикробные консерванты, стабилизаторы, эмульгаторы, солюбилизаторы и другие вспомогательные вещества, указанные в ФС.
Вкачестве вспомогательных веществ, повышающих стабильность действующих веществ, используют аскорбиновую, хлористоводородную, винную, лимонную, уксусную кислоты, натрия карбонат и гидрокарбонат, натрия тиосульфат, натрия цитрат, антимикробные консерванты, хлорбутанол, крезол, фенол и другие.
Стерильные ЛС должны производиться в асептических условиях. Таким образом, основываясь на правилах GMP основным требованием к организации изготовления инъекционных лекарственных форм на производстве и в условиях аптеки, являются асептические условия.
При производстве стерильных лекарственных средств используются помещения разных классов чистоты. Всего 4 класса чистоты. На каждой стадии технологического процесса класс чистоты строго регламентируется.
А |
В |
С |
D |
|
|
|
|
- разлив растворов |
- стерилизующую |
- приготовление и |
- просмотр, |
в ампулы, флаконы; |
фильтрацию |
предварительную |
маркировку, |
- фасовку |
растворов, |
фильтрацию |
упаковку |
стерильных |
- сушку и упаковку |
растворов; |
готовой |
порошков во |
технологической |
- хранение |
продукции; |
флаконы; |
одежды и др. |
лекарственных |
- хранение |
- запайку ампул; |
|
средств и |
готовой |
и др. |
|
вспомогательных |
продукции |
|
|
материалов и др. |
|
|
|
|
|
Помещения должны быть: |
|
|
|
-без деревянных поверхностей;
-стыки между стенами и потолками должны быть закругленной формы;
-подвесные потолки и фильтры тонкой очистки должны быть герметизированы;
-между помещениями различных классов чистоты должны быть переговорные устройства;
-вход персонала в "чистые" помещения должен осуществляться через воздушные шлюзы.
-его поверхности должны быть гладкими, изготовленными из нетоксичного, стойкого к коррозии металла;
-доступными для мойки и обработки дезинфицирующими средствами или стерилизации;
-оборудование должно иметь регистрирующие устройства для контроля параметров процесса;
-должно быть снабжено устройствами сигнализации, извещающими о неисправности.
Для изготовления материалов первичной упаковки (ампулы, флаконы, банки, колпачки, пробки и т.д.) должны применяться материалы, не влияющие на стабильность и фармакотерапевтические свойства укупоренных лекарственных средств.
На поверхности стекла ампул или флаконов при контакте с водными инъекционными растворами во время хранения, и особенно при тепловой стерилизации, в зависимости от его марки и значения рН раствора может происходить процесс выщелачивания или растворения верхнего слоя стекла. Выщелачивание из стекла компонентов и их гидролиз ведут к увеличению или уменьшению величины рН раствора. Это приводит к изменениям свойств лекарственных веществ, в основе которых лежат различные химические
процессы: гидролиз, окисление, восстановление, омыление, декарбоксилирование, изомеризация и др.
2. Дайте характеристику физическим, физико-химическим и химическим свойствам сульфокамфокаина. Предложите реакции подлинности и методы количественного анализа сульфокамфокаина. Напишите уравнения реакций.
Описание. Прозрачная бесцветная или слегка желтоватая жидкость. Растворимость. Это водорастворимое производное камфоры, представляющее собой
соль органической кислоты (сульфокамфорной) и органического основания (новокаина).
рН 4,2 – 5,8
Температура плавления. 192 – 195 °С. Удельное вращение от -20° до -24° (5%
водный раствор).
Химические свойства: обусловлены химическими свойствами новокаина и сульфокамфорной кислоты.
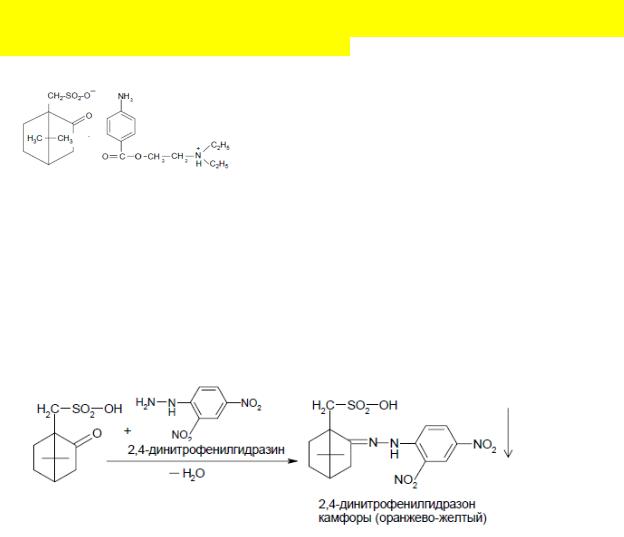
Качественные реакции:
1) При определении подлинности препарата доказывают наличие в структуре кетогруппы по реакции образования 2,4,-динитрофенилгидразона:
2) Для определения сульфогруппы в соединении используют окислительную минерализацию. Проводится путём нагревания сухого вещества с концентрированной азотной кислотой (или сплавлением с окислительной смесью нитрат калия и карбонат калия). При этом ковалентно связанная сера окисляется до сульфид-иона, который доказывают по реакции с бария сульфатом:
 Белый осадок, не растворимый в кислотах
Белый осадок, не растворимый в кислотах
3) Новокаин открывают после экстрагирования его в хлороформ. Далее хлороформ отгоняют и новокаин обнаруживают по реакции образования азокрасителя (ароматическая аминогруппа).

Количественное определение.
1) Алкалиметрия в водной среде для сульфокамфорной кислоты.
Индикатор – фенолфталеин. УЧ=1
2) Количественное определение содержания новокаина в препарате методом нитритометрии (индикатор тропеолин 00 плюс метиленовый синий) и определение кислоты сульфокамфорной алкалиметрическим методом в присутствии смеси из спирта и хлороформа, предварительно нейтрализованной по фенолфталеину (для экстрагирования новокаина):
Впроцессе титрования выделяется основание новокаина, которое экстрагируется в спирто-хлороформный слой.
3.На примере раствора кислоты аскорбиновой объясните, в чем особенность технологии изготовления концентратов для изготовления глазных капель в условиях аптеки?
Всоответствии с Приказом Минздрава 249н:
Концентрированные растворы (концентраты) – заранее изготовленные растворы лекарственных веществ более высокой концентрации, чем концентрация, в которой эти

вещества выписываются в рецептах. К концентратам относят также концентрированные экстракты из некоторых лекарственных растений, изготовленные на фармацевтических производственных предприятиях: экстракты (концентраты) валерианы, горицвета, пустырника и др. Концентраты предназначены для быстрого и качественного изготовления жидких лекарственных форм.
Рекомендуется изготавливать концентраты из веществ гигроскопичных, выветривающихся, содержащих значительное количество кристаллизационной воды. Концентрированные растворы изготавливают массо-объемным методом в мерной посуде
васептических условиях, используя свежеполученную воду очищенную.
Вслучае отсутствия мерной посуды объем воды очищенной рассчитывают, используя значение плотности концентрата или КУО (коэффициент, соответствующий увеличению его объема при растворении 1 г ЛВ). Изготовленные растворы фильтруют, подвергают полному химическому контролю и проверяют на отсутствие механических включений.
При изготовлении концентрированных растворов следует избегать концентраций, близких к насыщенным, т.к. при понижении температуры возможна кристаллизация растворенного вещества.
Отклонение в концентрации растворов допускается в пределах:
- до 20% концентрации раствора (включительно) - не более +-2%; - более 20% концентрации раствора - не более +-1%.
Вслучае превышения нормы допустимого отклонения производят исправление концентрации раствора.
Емкости с концентрированными растворами оформляют этикетками с указанием наименования и концентрации раствора, номера серии и анализа, даты изготовления, срока годности. Концентрированные растворы хранят в соответствии с физикохимическими свойствами лекарственных веществ, входящих в их состав, в простерилизованных, плотно укупоренных емкостях (баллонах, штангласах), в защищенном от света месте, при температуре 3-5° C или не выше 25° C. Изменение цвета, помутнение, появление хлопьев, налетов ранее установленного срока годности являются признаками непригодности растворов.
4.Приведите латинские названия аралии маньчжурской, семейства, сырья. Охарактеризуйте сырьевую базу, особенности сбора и условия хранения сырья. Укажите применение сырья и противопоказания к применению.
ARALIAE MANDSHURICAE RADICES (аралиэ манджурикэ радицес) - АРАЛИИ МАНЬЧЖУРСКОЙ КОРНИ (ГФ 14, ФС 2.5.0058.18)
Аралия маньчжурская– Aralia mandshurica (аралиа манджурика) Сем.аралиевые – Araliaceae (аралиацэ)
Собранные весной или поздней осенью, тщательно очищенные от земли, разрубленные на куски и высушенные корни дикорастущего дерева аралии высокой (аралии маньчжурской) - сем.Аралиевых.
Химический состав. Тритерпеновые САПОНИНЫ, производные кислоты олеаноловой
— тритерпеновые гликозиды аралозиды А, В и С. Корни содержат также эфирное масло, алкалоид аралин, смолы, микроэлементы.
Использование. Общетонизирующее средство. Настойка аралии и очищенная сумма сапонинов из коры ствола обладают андрогенным свойством. Учитывая положительное влияние на эндокринную систему и обмен веществ, настойку аралии применяют при кожных заболеваниях. Препараты из аралии не рекомендуется принимать в вечернее время.
ЛП:
1. Аралии маньчжурской корни, сырье. Сырье для получения настойки и препаратов «Сапарал» и «Сафинор».

2.В составе противодиабетического сбора «Арфазетин».
3.Аралии настойка (настойка (1:5) на 70 % этаноле). Тонизирующее, адаптогенное средство.
Корни добывают осенью, предпочтительно в сентябре, а также весной, до появления листьев. Рекомендуемый возраст растения – 5-15 лет. Для приготовления ЛП подходят корни 1-3см в диаметре. Срезанные корни тщательно промываются о почвы. Затем сырье сушат под навесом, на открытом воздухе либо в сушилке при температуре не более 60 С. Заготовленные корни хранятся 2 года.
5. Обоснуйте логистический канал товародвижения ЛП Сульфокамфокаина раствор для инъекций 10% по 2,0 мл № 10 в ампулах от предприятия - производителя до аптеки и конечного потребителя. Укажите возможные причины появления недоброкачественных ЛП. Назовите основные правила перевозки ЛП согласно правилам надлежащей практики.
Логистический канал распределения или канал товародвижения состоит из рыночных посредников, доводящих товар от производителя до конечного потребителя. На фармацевтическом рынке к числу таких посредников относят: предприятия оптовой торговли - оптовое звено (дистрибьюторы);аптечные организации - розничное звено.
Недоброкачественное ЛС–ЛС, не соответствующее требованиям фармакопейной статьи либо в случае ее отсутствия требованиям нормативной документации или нормативного документа. Причины:
•нарушение технологии производства,
•плохая очистка исходного сырья,
•побочные продукты синтеза,
•механические загрязнения (остатки фильтрующих материалов - ткань, фильтровальная бумага, асбест и т. п.),
•остатки растворителей (спирт, вода и др.),
•примеси материалов, из которых сделана аппаратура, применяемая для изготовления препарата. Металлическая аппаратура может служить источником таких опасных примесей в лекарственном веществе, как свинец (из посуды), железо, медь, иногда цинк и самая опасная примесь - мышьяк.
•нарушение необходимых условий хранения лекарств
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ПРИКАЗ от 31 августа 2016 г. N 646н «ОБ УТВЕРЖДЕНИИ ПРАВИЛ НАДЛЕЖАЩЕЙ ПРАКТИКИ ХРАНЕНИЯ И ПЕРЕВОЗКИ ЛП ДЛЯ МЕД ПРИМЕНЕНИЯ»
Перевозка ЛП сопровождается документами в соответствии с требованиями законодательства РФ. Информация о перевозке ЛП должна фиксироваться таким образом, чтобы обеспечить контроль их перемещения.
В процессе перевозки ЛП независимо от ее способа субъектом обращения ЛП должна обеспечиваться возможность подтверждения качества, подлинности и целостности ЛП.
Информация о выявленных в процессе перевозки ЛП случаях нарушения температурного режима хранения и (или) повреждения упаковки доводится субъектом обращения ЛП до отправителя и (или) получателя.
По запросу получателя ЛП субъектом обращения ЛП должны быть предоставлены сведения о соблюдении температурного режима при перевозке лекарственных препаратов.
Для перевозки ЛП используются транспортные средства и оборудование, обеспечивающие соблюдение их качества, эффективности и безопасности. При перевозке термолабильных лекарственных препаратов используется специализированное оборудование, обеспечивающее поддержание требуемых температурных режимов хранения лекарственных препаратов. Хладоэлементы в изотермических контейнерах

размещаются таким образом, чтобы отсутствовал прямой контакт с лекарственными препаратами. Повторное использования недостаточно охлажденных и (или) поврежденных хладоэлементов не допускается. Руководитель субъекта обращения лекарственных препаратов обеспечивает проведение инструктажа о порядке подготовки изотермических контейнеров к перевозке лекарственных препаратов (с учетом сезонных особенностей), а также о возможности повторного использования хладоэлементов.
Лекарственные препараты доставляются по адресу, указанному в товаросопроводительных документах.
6. Перечислите необходимые действия ГУП «Фармация» в отношении контрафактной серии ЛП. Раскройте понятия «фальсифицированное лекарственное средство», «контрафактное лекарственное средство», «недоброкачественное лекарственное средство». Представьте алгоритм работы по проверке указанного ЛП на предмет отнесения к ФЛС, контрафактным или недоброкачественным ЛП.
фальсифицированное ЛС - лекарственное средство, сопровождаемое ложной информацией о его составе и (или) производителе;
недоброкачественное ЛС - лекарственное средство, не соответствующее требованиям фармакопейной статьи либо в случае ее отсутствия требованиям нормативной документации или нормативного документа;
контрафактное ЛС - лекарственное средство, находящееся в обороте с нарушением гражданского законодательства;
НПБ:
•ФЗ от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств"
•ФЗ от 21 ноября 2011 г. N 323-ФЗ"Об основах охраны здоровья граждан в Российской Федерации"
•ПП РФ от 15.09.2020 N 1447 "Об утверждении Правил уничтожения изъятых фальсифицированных лекарственных средств, недоброкачественных лекарственных средств и контрафактных лекарственных средств".
Уголовная ответственность предусмотрена на поставки более 100тыс. руб., административная – менее 100тыс. руб.
КоАП: Наложение административного штрафа на граждан в размере от 70 000 до 100 000 рублей; на должностных лиц - от 100 000 до 600 000 рублей; на индивидуальных предпринимателей - от 100 000 до 600 000 рублей или административное приостановление деятельности на срок до 90 суток; на юридических лиц - от одного миллиона до пяти миллионов рублей или административное приостановление деятельности на срок до девяноста суток.
УК: наказываются принудительными работами на срок от 3 до 5 лет с лишением права занимать определенные должности или заниматься определенной деятельностью на срок до 3 лет или без такового либо лишением свободы на срок от трех до пяти лет со штрафом в размере от пятисот тысяч до двух миллионов рублей или в размере заработной платы или иного дохода осужденного за период от шести месяцев до двух лет или без такового и с лишением права занимать определенные должности или заниматься определенной деятельностью на срок до трех лет или без такового.
1. Согласно Инструкции о порядке приемки продукции производственнотехнического назначения и товаров народного потребления по качеству П-7 Продукция, не прошедшая в установленном порядке проверку по качеству, а также продукция, отгрузка которой была запрещена органами, осуществляющими контроль за качеством продукции, и другими уполномоченными на то органами, поставляться не должна.
2. Если полученная серия лекарственных средств значится в перечне фальсифицированных или контрафактных лекарственных препаратов, следует поместить полученную партию лекарственного средства в карантинную зону, направить информацию о факте поставки в территориальное Управление Росздравнадзора для принятия согласованных действий по предотвращению возможного причинения вреда здоровью и жизни граждан. Дальнейшие действия проводятся в соответствии со статьей 38 Федерального закона № 184-ФЗ. В течение десяти дней с момента получения информации о несоответствии продукции требованиям технических регламентов, изготовитель обязан провести проверку достоверности полученной информации. По требованию органа государственного контроля (надзора) изготовитель обязан представить материалы указанной проверки в орган государственного контроля (надзора).
3.В случае получения информации о несоответствии продукции требованиям технических регламентов изготовитель обязан принять необходимые меры для того, чтобы до завершения проверки, возможный вред, связанный с обращением данной продукции, не увеличился.
4.При подтверждении достоверности информации о несоответствии продукции требованиям технических регламентов изготовитель в течение десяти дней с момента подтверждения достоверности такой информации обязан разработать программу мероприятий по предотвращению причинения вреда и согласовать ее с органом государственного контроля (надзора) в соответствии с его компетенцией.
5.Затем составляется акт списания с объяснением причины.
6.Препараты передаются организации-ликвидатору по договору. По факту уничтожения лекарственных средств оформляется акт об уничтожении.
7.В соответствии со статьей 57 Федерального закона № 61-ФЗ продажа фальсифицированных, недоброкачественных и контрафактных лекарственных средств запрещается.
