
Задачи+для+подготовки+к+экзамену+по+фармхимии+3+курс+очное+отделение
.pdf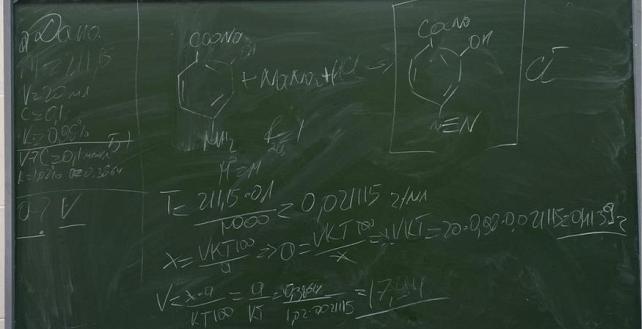
21.Приведите уравнения химических реакций для количественного определения натрия пара-аминосалицилата (Mr 211,15) методом нитритометрии. Укажите индикатор (название, формулу, переход окраски в точке конца титрования) и особенности установления точки конца титрования с его помощью. Объясните причину использования данного индикатора.
Рассчитайте молярную массу эквивалента, титр по определяемому веществу, навеску натрия пара-аминосалицилата, чтобы на титрование пошло 20,0 мл 0,1 моль/л раствора натрия нитрита (К=0,98).
Рассчитайте объем 0,1 моль/л раствора натрия нитрита (К=1,02), который пойдет на титрование навески натрия пара-аминосалицилата массой 0,3864 г.
Титрование проводят в кислой среде (соляная кислота). Индикатор – внешний (йодкрахмальная бумажка). Если эта капля вызывает посинение индикаторной полоски, то титрование законченно.
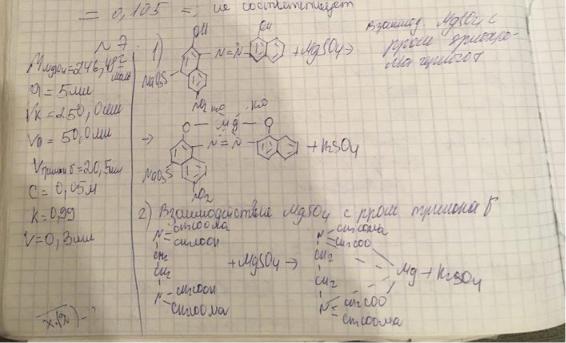
22.Приведите уравнения химических реакций для количественного определения магния сульфата (Mr 246,48) в растворе для инъекций методом комплексонометрии.
Рассчитайте содержание магния сульфата в 25% растворе для инъекций, если 5,0 мл лекарственного препарата довели водой до метки в мерной колбе вместимостью 250,0 мл. На титрование 50,0 мл аликвоты в основном опыте израсходовано 20,5 мл 0,05 моль/л раствора трилона Б (К=0,99), в контрольном опыте – 0,3 мл того же титранта. Соответствует ли лекарственный препарат требованиям ФС, если пределы содержания магния сульфата в растворе для инъекций указанной концентрации 0,242 – 0,258 г/мл.

23.Приведите уравнения химических реакций для количественного определения калия иодида (Mr 166,01) методом аргентометрии по Фаянсу. Укажите индикатор (название, формулу, механизм его действия, переход окраски в точке конца титрования).
Рассчитайте содержание калия иодида в пересчете на сухое вещество (%), если на титрование навески массой 0,3046 г пошло 18,2 мл 0,1 моль/л раствора серебра нитрата (К=0,99). Потеря в массе при высушивании – 0,8%.
 до перехода окраски осадка от желтой до розовой
до перехода окраски осадка от желтой до розовой

24.При стандартизации раствора 0,1 моль/л натрия гидроксида на титрование 0,49846 г калия гидрофталата (Мг 204,23) пошло 23,7 мл приготовленного раствора. Приведите уравнения происходящих реакций. Рассчитайте поправочный коэффициент (К) приготовленного титрованного раствора и при необходимости приведите расчет доведения его до нормы, если для приготовления 2-х л этого титрованного раствора использована навеска натрия гидроксида массой 32,0 г.
25.Приведите уравнения химических реакций для количественного определения кальция глюконата (Mr 448,4) методом комплексонометрии.
Соответствует ли количественное содержание кальция глюконата в таблетках по 0,5 г требованиям ФС (должно быть 0,475-0,525 г, считая на среднюю массу таблетки), если навеску порошка растертых таблеток массой 2,40365 г поместили в мерную колбу вместимостью 100 мл, растворили в воде при нагревании, охладили, довели водой до метки, перемешали, отфильтровали. На титрование 20 мл фильтрата израсходовано 20,4 мл 0,05 моль/л раствора трилона Б (К=1,01). Средняя масса таблетки 0,532 г.

26.Приведите уравнения химических реакций для количественного определения анестезина (бензокаина) (Mr 165,19) методом нитритометрии. Укажите переход окраски индикатора тропеолина ОО в смеси с метиленовым синим в точке конца титрования.
Рассчитайте молярную массу эквивалента, титр по определяемому веществу, навеску анестезина, чтобы на титрование пошло 10,0 мл 0,1 моль/л раствора натрия нитрита (К=0,98).
Рассчитайте объем 0,1 моль/л раствора натрия нитрита (К=0,99), который пойдет на титрование навески анестезина массой 0,1936 г.
X=VKT100/a; V=a/KT; V=0.1936/0.99*0.0082595=23.67 мл

27.Приведите уравнения химических реакций для количественного определения меди сульфата (Mr [CuSO4 5H2O] 249,68) методом заместительной иодиметрии, индикатор (название, переход окраски в точке конца титрования).
Рассчитайте содержание меди сульфата в анализируемом образце (%), если на титрование навески массой 0,5244 г пошло 20,8 мл 0,1 моль/л раствора натрия тиосульфата
(К=1,01).
28.Приведите уравнения химических реакций для количественного определения натрия тиосульфата (Mr 248,18) в растворе для инъекций методом иодиметрии.
Рассчитайте содержание натрия тиосульфата в растворе для инъекций, если 10,0 мл лекарственного препарата довели водой до метки в мерной колбе вместимостью 250,0 мл. На титрование аликвоты объемом 25,0 мл пошло 11,95 мл 0,1 моль/л (УЧ 1/2 I2) раствора иода
(К=1,01).

29.Приведите уравнения химических реакций для количественного определения пероксида водорода (Mr 34,01) методом перманганатометрии. Укажите индикатор, переход его окраски в точке конца титрования.
Рассчитайте содержание пероксида водорода в препарате (%), если 10,0 мл анализируемого образца довели водой до метки в мерной колбе вместимостью 100,0 мл. На титрование 10,0 мл аликвоты полученного раствора пошло 18,9 мл 0,1 моль/л (УЧ 1/5 КМnO4) раствора калия перманганата (К=0,98).

30.Оцените анализируемый образец кальция лактата по показателю «Потеря в массе при высушивании» (согласно требованиям ФС должна быть не менее 20,0% и не более 30,0%), если после высушивания до постоянной массы при 120 С масса бюкса с навеской вещества равна 18,34574 г. Масса пустого бюкса 17,92358 г, бюкса с навеской кальция лактата до высушивания –18,43282 г. Поясните причину возможного заниженного содержания воды в кальция лактате.

31.Приведите уравнения химических реакций для количественного определения натрия нитрита (Mr 69,0) методом перманганатометрии. Укажите индикатор, переход его окраски в точке конца титрования.
Рассчитайте содержание натрия нитрита (%), если навеску массой 0,9874 г довели водой до метки в мерной колбе вместимостью 100,0 мл. К аликвоте объемом 10,0 мл добавлено 40,0 мл 0,1 моль/л (УЧ 1/5 КМnO4) раствора калия перманганата (К=1,0), на титрование избытка которого израсходовано 11,5 мл 0,1 моль/л раствора натрия тиосульфата (К=0,98). На титрование контрольного опыта пошло 40,8 мл того же титранта.
