
Физика / 1 семестр / РАЗДЕЛ №2. МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА / 3 МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО РЕШЕНИЮ ЗАДАЧ НА ТЕМУ ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
.pdfQ U , т.е. подведенное к газу тепло целиком идет на изменение внутренней энергии газа. Интенсивность теплового движения молекул газа увеличивается, внутренняя энергия газа увеличивается.
Рассмотрим процесс АВ2. это процесс изобарический, т.е. идущий при постоянном давлении p=Const.
Записываем первое начало термодинамики Q U A . При p=Const газ совершает работу A p V , где V - изменение объема газа, но и внутренняя энергия газа тоже увеличивается.
Изменение внутренней энергии газа U |
m |
|
i |
R T , где ∆Т – |
изменение |
|||
2 |
||||||||
|
|
|
|
|
||||
температуры газа. Запишем уравнение Менделеева - Клапейрона |
pV |
m |
RT . |
|||||
|
||||||||
|
|
|
|
|
|
|
||
При процессе АВ2 |
увеличивается объем, а при увеличении объема V |
увеличивается температура Т, следовательно, увеличивается внутренняя |
|
энергия газа. |
|
Рассмотрим процесс АВ3. Это изотермический процесс, т.е. процесс, идущий |
|
при постоянной |
температуре, Т=Const. Запишем первое начало |
термодинамики Q U A . |
Изменение |
внутренней |
энергии газа |
||||
выражается формулой U |
m |
|
i |
R T , ∆U=0, |
так как при |
изотермическом |
|
2 |
|||||||
|
|
|
|
||||
процессе равно нулю изменение температуры, ∆T=0. Тогда ∆Q=∆A, т.е. все количество теплоты, подведенное к газу, идет на совершение газом работы.
Внутренняя энергия газа, выражается формулой U |
m |
|
i |
R T , остается при |
|
2 |
|||||
|
|
||||
этом постоянной. |
|
||||
Ответ: Процесс АВ1: нет, увеличивается; |
|
||||
Процесс АВ2: да, увеличивается; |
|
||||
Процесс АВ3: да, остается постоянной. |
|
||||
Задача 7
Молярная теплоемкость идеального газа при некотором процессе изменяется по закону C T , где α – постоянная величина.
Найти: а) работу А, совершаемую киломолем газа при его нагревании от температуры Т1 до температуры Т2=2Т1; б) уравнение, связывающие параметры p и V при этом процессе. Коэффициент Пуассона для данного газа равен γ.
Дано: |
|
|
|
|
Решение: |
|
|||||
|
m |
1кмоль |
|
|
а) |
|
запишем |
первое |
начало |
||
|
|
|
|
термодинамики в дифференциальной |
|||||||
|
|
|
|
|
|
||||||
|
|
|
|
|
форме dQ dU dA . |
|
|||||
С Т |
|
|
dQ |
- |
бесконечно |
малое |
количество |
||||
Const |
|
|
теплоты, подведенное к данной массе |
||||||||
T2 2T1 |
|
|
газа; |
|
|
|
|||||
А=? |
|
|
dU -бесконечно малое изменение |
||||||||
внутренней энергии данной массы газа; |
|
|
|
|
|||||||
dA - бесконечно малая работа, совершаемая газом при его нагревании. |
|||||||||||
dA dQ dU , dQ |
m |
CdT , где |
m |
1кмоль |
по |
условию |
задачи, |
молярная |
|||
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||
теплоемкость C T , dT – бесконечно малое изменение температуры. Для одного кмоля газа dU 2i RdT , где i – число степеней свободы данного
идеального |
газа. |
Тогда |
dA CdT |
i |
RdT |
dT |
|
i |
RdT , R – |
универсальная |
|||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
T |
2 |
|
|
|
|
|
|
|
||
газовая постоянная. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
Вся работа А, совершаемая газом при его нагревании от температуры T1 до |
|||||||||||||||||||||||||||||||||||
температуры Т2, выражается формулой |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
T2 |
dT |
|
|
i |
|
T2 |
|
|
T |
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
2 |
|
|
|
|
T |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
A |
|
dA |
|
|
|
|
|
|
R |
|
dT ln |
2 |
|
|
|
R(T T ) . Учитывая, что Т =2Т |
, получим |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
1 |
|
|
|
2 |
1 |
|
|
|
|
||||
|
|
|
|
|
|
T |
|
|
|
|
|
T |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A ln 2 |
i |
RT |
. Число степеней свободы i в данной задаче не указано, но |
||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
2 |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
коэффициент Пуассона γ дан. Коэффициент Пуассона |
i 2 |
или 1 |
2 |
, |
|||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
i |
|
отсюда |
|
i |
|
1 |
|
. Тогда работа |
|
A ln 2 |
RT1 |
. |
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
2 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
||||||
б) запишем первое начало |
термодинамики в |
дифференциальной |
форме |
||||||||||||||||||||||||||||||||
dQ dU dA. |
Учитывая, |
что |
|
m |
1кмоль по |
условию |
задачи, |
имеем |
|||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dQ CdT T dT , dU 2i RdT . Бесконечно малую работу dA при бесконечно
малом изменении объема ∆V газа можно находить по формуле dA pdV , считая, что давлеение газа р не успеет измениться за то бесконечно малое время, в течении которого изменяется объем газа. Теперь, учитывая, что
C T , первое начало термодинамики можно записать так dTT 2i RdT pdV ,
но в этом уравнении три переменные величины T, p и V. Пользуясь уравнением Менделеева-Клапейрона для одного киломоля pV=RT, выражаем
р через переменные Т и V: p RTV . Тогда первое начало термодинамики будет
выглядеть |
так |
|
|
dT |
|
|
i |
|
RdT |
|
|
RT |
dV . |
Делим на |
RT все |
члены |
уравнения |
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
2 |
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
dT |
|
|
i |
|
dT |
|
|
dV |
|
. Берем |
интеграл |
от |
|
левой |
и |
правой |
частей |
уравнения |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
RT |
T |
|
|
|
2 T |
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
T2 |
dT |
|
|
|
i |
|
T2 |
dT |
|
|
V2 |
dV 1 |
|
|
|
1 i |
ln T2 |
ln T1 ln V2 ln V1 |
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
; |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
R T1 T |
|
|
|
|
2 T1 |
T |
|
|
V1 |
V R |
T2 |
|
|
|
T1 |
2 |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
или |
|
|
|
|
|
|
|
|
i |
ln T |
|
ln V |
|
|
|
|
|
|
|
|
i |
ln T |
|
ln V |
|
. |
Как |
видно |
из |
вышесказанного |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
RT1 |
|
|
|
2 |
|
1 |
|
|
1 |
|
|
|
RT2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
ln T ln V |
|
|
является |
|
постоянной |
величиной. |
По |
условию задачи, |
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
RT1 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
требуется найти уравнение, связывающие параметры p и V, поэтому параметр Т надо исключить. Из уравнения Менделеева-Клапейрона pV=RT. Находим
T |
pV |
. Тогда |
|
|
i |
ln |
|
pV |
ln V C |
, где С |
|
– постоянная величина. Находим |
|||||||||||||||
|
|
|
|
|
|
1 |
|||||||||||||||||||||
|
|
|
R |
|
|
|
pV |
2 |
|
|
R |
1 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
число степеней свободы i. Коэффициент Пуассона |
i 2 |
, отсюда |
i |
|
1 |
. |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
2 |
|
1 |
|||
|
|
|
1 |
|
ln |
pV |
ln V C |
. Так как |
|
логарифм произведения |
равен |
сумме |
|||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
pV |
|
1 |
|
R |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
логарифмов |
|
сомножителей, |
|
то |
||||||||||
|
|
|
1 |
|
ln |
1 |
|
1 |
|
|
ln( pV ) ln V C |
. Или |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
pV |
|
1 |
|
R |
1 |
1 |
|
|
pV |
||||
|
|
|
|
|
|
|||||||||
|
|
ln |
pV |
ln |
1 |
ln( pV ) |
|
|
|
и |
||||
|
|
R |
R |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
1 |
|
ln( pV ) ln V C |
|
|
1 |
|
ln |
1 |
. |
||||
|
|
|
|
|
|
|||||||||
|
1 |
|
|
|
1 |
|
1 |
|
R |
|||||
|
|
|
|
|
|
|
||||||||
Выражение C |
|
1 |
|
ln |
1 |
является постоянной величиной. C |
1 |
|
ln |
1 |
Const |
|||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
1 |
|
|
1 R |
|
1 |
1 |
|
R |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
. Тогда |
|
|
|
|
|
1 |
|
ln( pV ) ln V Const , |
или |
( 1) ln( pV ) ( 1) ln V Const , |
||||||||||
|
|
|
1 |
|||||||||||||||||
|
|
|
pV |
|
|
|
|
|
|
pV |
|
|
|
|
|
|||||
или |
( 1) |
ln( pV ) ln V 1 Const , |
( 1) ln( pV ) Const . |
Потенцируем |
||||||||||||||||
|
|
pV |
|
|
|
|
|
|
|
|
|
pV |
|
|
|
|
|
|
||
( 1)
pV e pV
Const . Получим уравнение, связывающие параметры p и V в
данном процессе, е – основание натурального логарифма.
|
RT1 |
|
|
( 1) |
|
Ответ: A ln 2 |
, |
pV e pV |
|||
1 |
|||||
|
|
|
|||
Const .
Задача 8
Один киломоль идеального одноатомного газа расширяется по политропе с показателем n=1,5, причем его температура уменьшается на один градус. Определить:
а) молярную теплоемкость С газа при этом процессе; б) количество тепла ∆Q, полученного газом;
в) работу А, совершаемую газом. За счет, каких источников энергии совершается эта работа?

Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Решение: |
|
|||||||||
|
m |
1кмоль |
|
|
|
|
|
|
|
|
|
а) так как газ одноатомный, то число |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
степеней свободы для i=3, что можно |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
n 1,5 |
|
|
|
|
|
|
|
|
|
вписать в данные задачи. Молярная |
||||||||||||||||
T 1K |
|
|
|
|
|
|
|
|
|
теплоемкость С идеального |
газа в |
|||||||||||||||
|
|
|
|
|
|
|
|
|
политропическом |
процессе |
||||||||||||||||
|
R 8,3 103 Дж |
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
выражается |
|
|
|
формулой |
||||||||||||||
|
|
|
|
|
кмоль К |
|
|
|
|
|
|
|
||||||||||||||
i 3 |
|
|
|
|
|
|
|
|
|
C R |
n |
, |
|
|
|
|||||||||||
C= ? А=? Q=? |
|
|
|
|
|
|
|
( 1)(n 1) |
|
|
|
|||||||||||||||
где R-универсальная газовая постоянная, n-показатель политропы, γ- |
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
i 2 |
|
|
|
|||
коэффициент Пуассона. Так как |
i 2 |
, то C R |
i |
. Подставим |
||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||
i |
( |
i 2 |
1)(n 1) |
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
||
|
|
|
|
|
1,5 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
i=3. C R |
|
|
3 |
|
0,5R, C 0,5R . Подставляя численное значение |
|||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||
( |
5 |
1)(1,5 1) |
||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
универсальной газовой постоянной R, получим |
|
|
|
|
|
|||||||||||||||||||||
C 0,5 8,3 103 |
|
Дж |
4,15 103 |
|
Дж |
|
|
; |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
кмоль К |
кмоль |
К |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
б) количество теплоты Q, полученное одним киломолем идеального газа, |
||||||||||||||||||||||||||
подсчитывается по формуле Q=C T, |
где C-молярная теплоемкость газа. |
|||||||||||||||||||||||||
Так как |
C 0,5R , |
то Q 0,5R T . |
|
Подставлим |
|
численные |
данные |
|||||||||||||||||||
Q 0,5 8,3 103 ( 1) кмольДж 4,15 103 кмольДж ;
в) запишем первое начало термодинамики Q U A . Отсюда A Q U
Изменение внутренней энергии для одного киломоля газа U |
i |
R T , так как |
|
|
|||
|
2 |
|
|
i=3, то U 1,5R T . Подставляя U и |
Q в формулу для работы, получим |
||
A 0,5R T 1,5R T 2,0R T, A 2,0R T . |
Знак «минус» имеет |
физический |
|
смысл. Работа совершается за счет поглощения тепла и за счет уменьшения
внутренней |
|
энергии |
|
газа. |
|
Подставим |
|
|
численные |
значения |
||||||||||
A 2,0 8,3 103 ( 1) |
Дж |
|
16,6 103 |
|
Дж |
. |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
кмоль |
|
|
|
кмоль |
|
|
|
|
|
|
|
|
||||
Ответ: 4,15 10 |
3 |
|
|
Дж |
|
, 4,15 10 |
3 |
|
Дж |
, 16,6 |
10 |
3 |
|
Дж |
. |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
кмоль К |
|
|
кмоль |
|
|
|
кмоль |
|
|
||||||||
Задача 9
Некоторое количество идеального газа расширяется так, что процесс на диаграмме p,V изображается прямой линией, проходящей через начало координат.
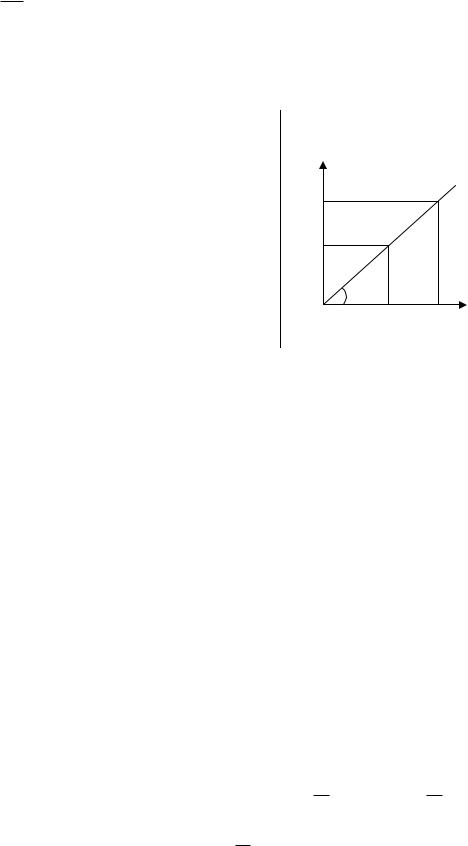
Известны: начальный объём газа V1, начальное давление p1 и отношениеСрСv . В результате расширения объём газа увеличился в три раза.
Найти: а) показатель политропы n,
б) приращение внутренней энергии ∆U газа, в) работу A, совершаемую газом,
г) молярную теплоемкость C газа при этом процессе. Дано:
V1
p1 |
p |
|
|
γ |
p2 |
|
|
V2=3V1 |
|
|
|
|
|
|
|
n=? |
p1 |
|
|
∆U=? |
|
|
|
|
|
|
|
A=? |
|
|
|
C=? |
α |
|
|
|
рис.9 |
V1 V2 |
V |
|
|
|
Уравнение политропического процесса записывается формулой pVn=const или p1V1n= p2V2n, где n –показатель полиропы. Согласно условию задачи зависимость p от V изображается прямой линей. Уравнение прямой линии p=αV, где коэффициент α равнее тангенсу угла наклона прямой к оси V. a=tgα. Соответственно p1=aV1 и p2=aV2. Подставив значение p1 и p2 в
уравнение политропы: aV1 V1n aV2V2 n , получаем V1n 1 V2 n 1 .
По условию задачи V2 3V1 . Тогда V1n 1 3V1 n 1 или 1 3n 1 . Приравниваем показатели степеней 0=n+1. Отсюда показатель политропы n=-1. Уравнение рассматриваемого процесса теперь можно записать так: pV1 const или
|
p |
const . |
|
|
|
|
||||
|
|
|
|
|
|
|||||
V |
|
|
|
|
|
|
|
|||
б) Приращение внутренней энергии газа |
|
|
|
|
||||||
U |
m |
|
i |
R T , где i- число степеней свободы, |
m |
- число кмолей, |
|
|
||
|
|
|
|
|
||||||
|
|
|
2 |
|
1 |
|
|
|||
R – универсальная газовая постоянная, рассчитанная на кмоль газа, |
|
|
||||||||
- изменение температуры газа в данном |
процессе. Величину |
m |
R T |
|||||||
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
можно найти, записав уравнение Менделеева-Клапейрона для начального и конечного состояния газа, а именно p1V1 m RT1 , p2V2 m RT2 . вычитая одно
уравнение из другого ,получим m R(T2 T1 ) p2V2 p1V1 . Объем V2 3V1 по условию задачи. Находим соотношение между р1 и р2.
Для рассматриваемого процесса |
|
p1 |
|
p2 |
. Отсюда |
p |
|
|
p1V2 |
|
p1 3V1 |
3 p . |
||||||||||||
|
|
|
2 |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
V1 |
|
V2 |
|
|
|
|
|
|
V1 |
|
V1 |
|
1 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Давление |
p |
|
3 p . Тогда |
m |
R(T T ) 3 p 3V p V 9 p V p V 8 p V и |
|||||||||||||||||||
|
|
|||||||||||||||||||||||
|
|
|
|
2 |
1 |
|
2 |
|
1 |
1 |
1 |
1 |
1 |
|
|
|
1 |
1 |
1 |
1 |
1 |
1 |
||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
U |
i |
8 p V |
|
. Находим i. Коэффициент Пуассона |
C p |
равен отношению |
||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||
|
2 |
1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
CV |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
теплоемкостей газа (удельных или молярных соответственно) при постоянном давлении и при постоянном объеме. Учитывая, что удельные
|
|
|
|
|
C p |
|
|
C |
|
|
|
|
|
|
|
|
i 2 |
|
|||
теплоемкости c |
p |
|
|
|
и c |
V |
, и что молярные теплоемкости C |
p |
|
|
R и |
||||||||||
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
2 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
C |
i |
R , имеем |
i 2 |
. Отсюда |
i |
|
1 |
|
и U |
8 p1V1 |
. |
|
|
|
|
||||||
V |
2 |
|
|
|
|
|
i |
2 |
|
1 |
|
1 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
в) бесконечно малая работа dA, совершаемая газом, выражается формулой dA=pdV. Вся работа А газа равна сумме элементарных работ, т.е. A dA pdV . Но под знаком интеграла стоят две переменные величины p
и V. Находим зависимость давления p от объема V.
Рассматриваемый процесс изображается на диаграмме p, V прямой линией,
т.е. p=aV, |
где a=tgα (см. рис.9). Из чертежа видно, |
|
что |
tg |
p1 |
. |
Тогда |
||||||||||||
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
p1 |
|
|
p1V2 |
|
p1 |
2 |
2 |
|
|
p1 |
2 |
2 |
|
|
||||
p |
|
V . |
Теперь |
A pdV |
|
VdV |
|
|
|
(V2 |
V1 ) |
|
|
|
(9V1 V1 ) |
4 p1V1 . |
|||
V |
V |
2V |
|
2V |
|||||||||||||||
1 |
|
|
|
1 V |
|
1 |
|
|
|
1 |
|
|
|
|
|||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
A=4p1V1. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
г) количество тепла, сообщенного газу, |
Q |
m |
C T . Из этой формулы можно |
||||||||||||||||
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
найти молярную теплоемкость С газа, но для этого надо знать, чему равны
величины |
Q и |
m |
T . |
m |
R T было уже найдено в данной задаче в пункте б). |
|||||||||||||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
m |
R T 8 p V . Отсюда |
|
m |
T |
8 p1V1 |
. Находим |
|
|
Q. |
|
|
Запишем первое начало |
|||||||||||||||||||||||||
|
|
1 |
1 |
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
термодинамики |
Q U A . |
В |
данной |
задаче |
уже было |
найдено, что |
||||||||||||||||||||||||||||||||
U |
8 p1V1 |
|
и |
A=4p1V1. |
Тогда |
Q |
8 p1V1 |
4 p V |
4 p V |
1 |
. |
Подставляем |
||||||||||||||||||||||||||
1 |
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
1 1 |
|
|
1 1 1 |
|
|||||||||||
найденные |
|
значения |
|
|
|
Q |
и |
|
|
m |
T |
в |
формулу |
Q |
m |
C T , получим |
||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
4 p V |
1 |
C |
8 p1V1 |
. Отсюда |
C |
R |
|
1 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
1 1 1 |
|
R |
|
|
|
|
|
|
|
|
|
|
|
2 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Ответ: а)n=-1; б) U |
8 p1V1 |
|
; в) A=4p1V1; г) C |
R |
|
1 |
. |
|
||||||||||||||||||||||||||||||
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
2 1 |
|
|
|
|
|
|
||||||||
