Коллоквиум 1 - Коллоидная Химия
.docx1. Предмет изучения, цели и задачи коллоидной химии.
Коллоидная химия – наука, изучающая дисперсные системы и происходящие в них поверхностные явления. В других химических дисциплинах свойства вещества преимущественно рассматриваются на двух уровнях организации материи: макроскопическом (свойства гомогенных фаз) и молекулярном (строение и свойства отдельных молекул).
Объекты изучения – дисперсные системы с размером частиц дисперсной фазы 10-2 - 10-7 см. Коллоидная химия – наука о дисперсных системах и поверхностных явлениях «коллоид» - клееподобный, от греческого ϰόλλα - клей
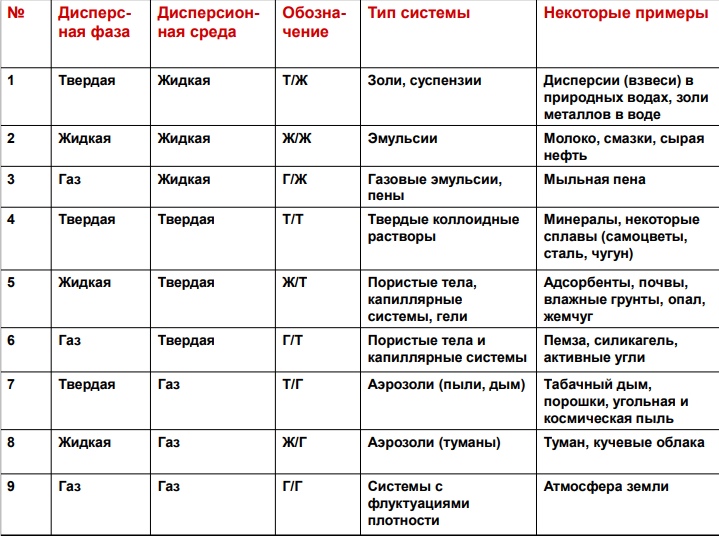
2. Классификация дисперсных систем по агрегатному состоянию.
Необходимое условие образования дисперсной системы – ограниченная растворимость вещества дисперсной фазы в дисперсионной среде • Основной признак дисперсионной среды – непрерывность • Каждая из фаз может быть в одном из трех агрегатных состояниях (жидком, твердом, газообразном)
3. Лиофильные и лиофобные системы.
а) лиофильные (от греческого «лио» - жидкость, «филео» - любить). - Сильное межмолекулярное взаимодействие вещества дисперсной фазы со средой; - Термодинамическая устойчивость; - Самопроизвольное диспергирование (ΔG≤0). Примеры: мыла, СМС,бентонитовые глины, растворы полимеров в «хорошем» растворителе.
б) лиофобные (от греческого «лио» - жидкость, «фобос» - страх). - Слабое межмолекулярное взаимодействие вещества дисперсной фазы со средой; - Термодинамическая неустойчивость; - Самопроизвольное не образуются (ΔG>0). Большинство дисперсных систем.
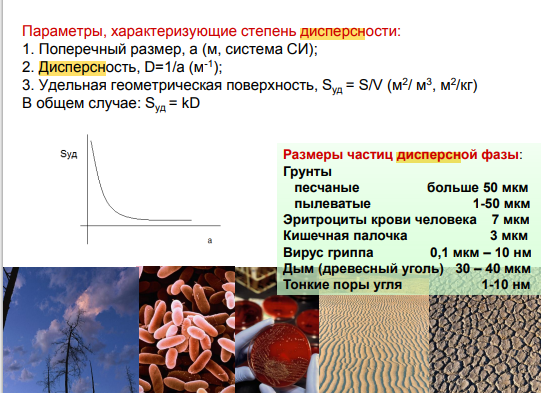
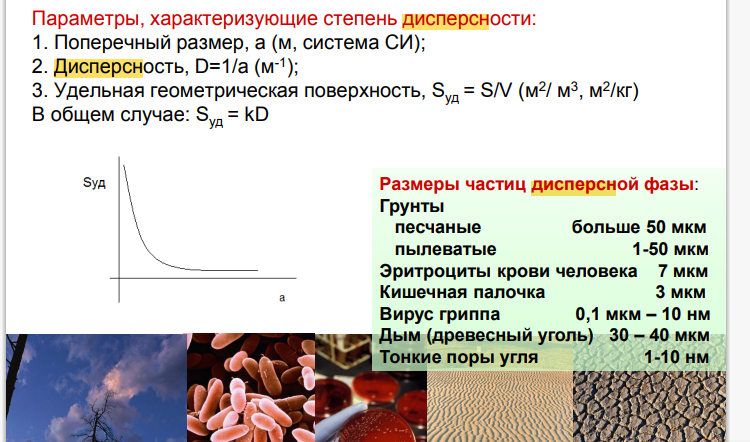
4. Дисперсность систем и параметры, ее характеризующие. Высокодисперсные и грубодисперсные системы.
а) грубо- и б) высокодисперсные.
а)
оседают в гравитационном поле, не
проходят через бумажные фильтры, видны
в оптический микроскоп
б) не оседают
в гравитационном поле, проходят через
бумажные фильтры, но задерживаются
ультрафильтрами, видны в электронный
микроскоп
5. В чем особенность коллоидных растворов как высокодисперсных систем?
1) Все коллоидные растворы способны рассеивать свет – опалесценция («конус Тиндаля»); 2) Диффузия в коллоидных растворах протекает медленно; 3) Коллоидные растворы имеют малое осмотическое давление; 4) Способность к диализу - это очистка коллоидных растворов и субстанций высокомолекулярных веществ от растворённых в них низкомолекулярных соединений при помощи полупроницаемой мембраны.; 5) Коллоидные растворы агрегативно неустойчивы и могут легко выделяться из раствора (способность к коагуляции); 6) Электрофорез - это движение заряженных дисперсных частиц или растворенных заряженных молекул относительно жидкости под воздействием пространственно однородного электрического поля..
6. Основы термодинамики поверхностного слоя.
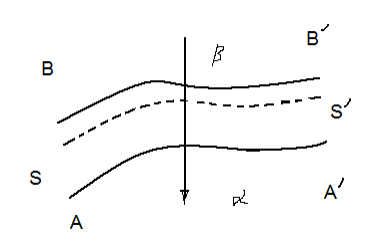
Рассмотрим две объемные соприкасающиеся фазы α и β. Между фазами существует неоднородный слой, в котором осуществляется переход от свойств фазы α к фазе β. Какова его толщина δ? Гиббс предложил систему построения термодинамики поверхностного слоя, основанную на исключении неопределенности значения δ. SŚ –разделяющая поверхность – «геометрическая поверхность, воспроизводящая форму поверхности разрыва и располагающаяся параллельно последней».
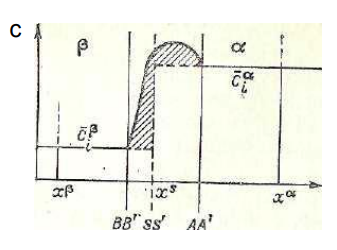
Представим себе идеализированную систему, в которой каждая из интенсивных величин имеет характерные для данной фазы значения вплоть до SŚ и сравним ее с реальной системой. Тогда разности между соответствующими экстенсивными величинами в реальной и идеализированной системах – это поверхностные избытки. Посредством таких избытков выражаются все экстенсивные параметры в методе Гиббса. Так, например, состав поверхностного слоя определяется избыточным числом молей компонентов.

7. Поверхностное натяжение с точки зрения энергетического и силового подходов. Зависимость поверхностного натяжения от температуры.
Энергетический подход
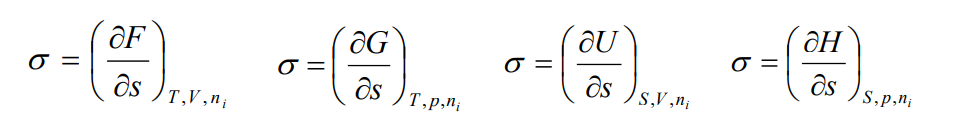 σ=
ΔW/ΔS – работа образования единицы
площади поверхности, она численно равна
поверхностному натяжению
σ=
ΔW/ΔS – работа образования единицы
площади поверхности, она численно равна
поверхностному натяжению
поверхностное натяжение (σ) есть частная производная от любого термодинамического потенциала по площади межфазной поверхности при постоянных значениях соответствующих параметров. (ед. изм. Дж/м2 )
Силовой подход
σ – сила, стягивающая гипотетическую пленку на поверхности жидкости и противодействующая ее растяжению. σ=Р/l, (ед. измерения Н/м)
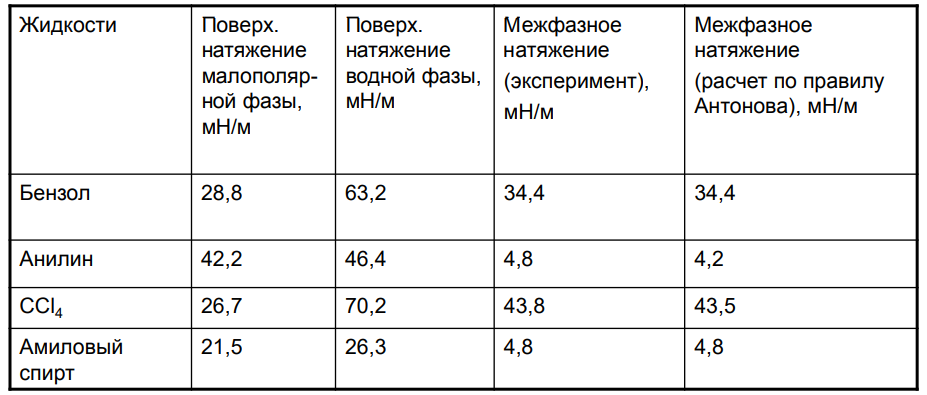
8. Межфазное натяжение на границе раздела несмешивающихся жидкостей. Правило Антонова.
Для границы двух несмешивающихся жидкостей силовое поле второй фазы необходимо всегда учитывать. Действие силовых полей обычно является аддитивным и значение σ для границы двух жидкостей, называемое пограничным или межфазным натяжением, определяется разностью их интенсивностей. Существование аддитивности действия молекулярных сил выражается правилом Антонова, согласно которому пограничное натяжение равно разности поверхностных натяжений этих жидкостей ( на границах с воздухом) в условиях взаимного насыщения.
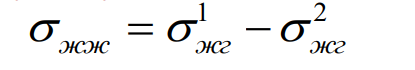
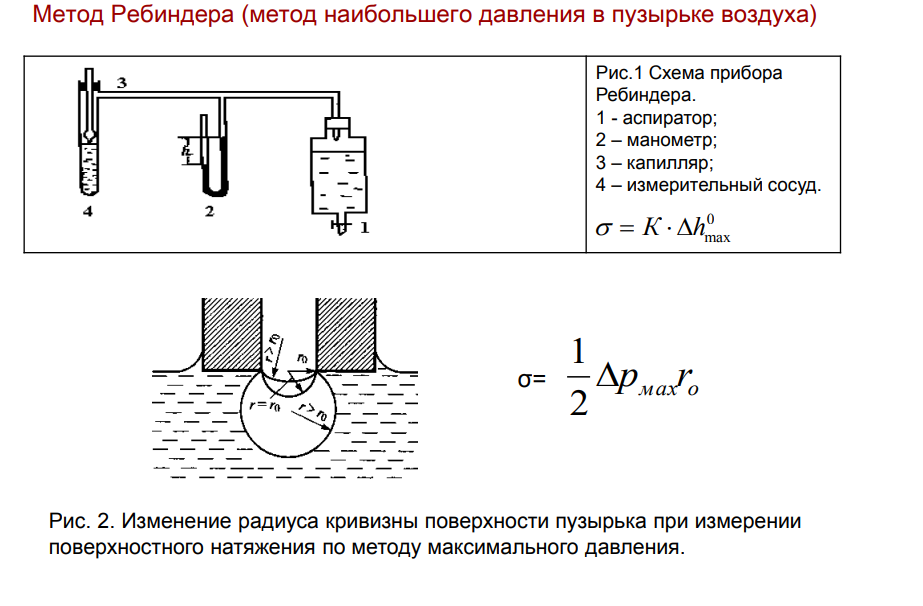
9. Методы измерения поверхностного натяжения на легкоподвижных границах раздела фаз (жидкость-газ, жидкость-жидкость). Метод Ребиндера (наибольшего давления в пузырьке воздуха) и метод Дю Нуи (отрыва кольца).

10.Явление смачивания. Гидрофильные и гидрофобные поверхности.
Линия пересечения всех трех поверхностей называется линией смачивания. Замкнутая линия смачивания образует периметр смачивания.
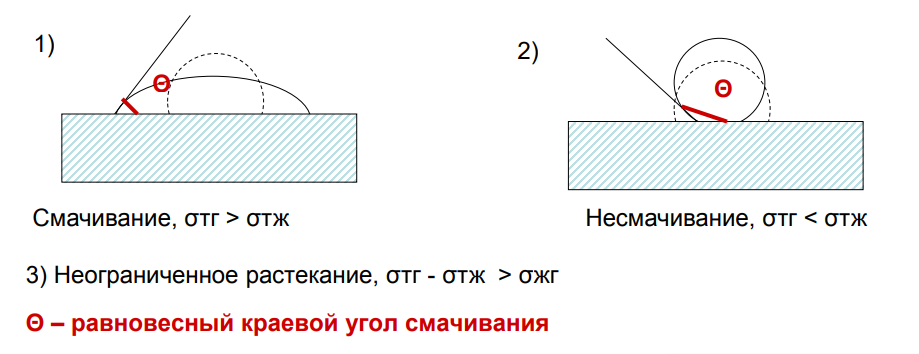
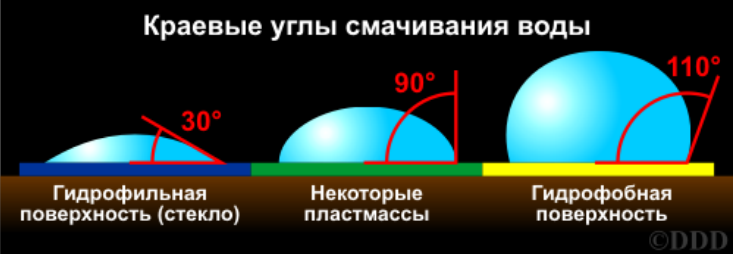
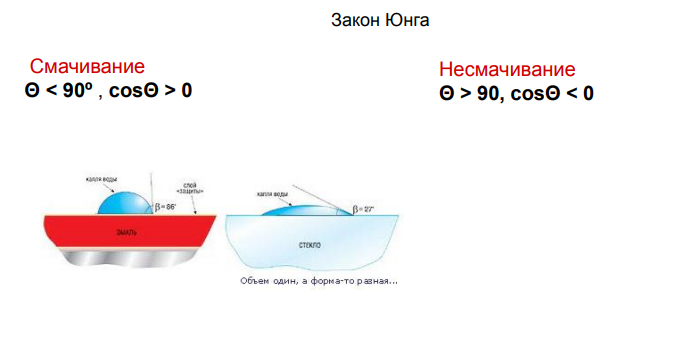
11.Количественные характеристики смачивания: краевой угол смачивания, закон Юнга.
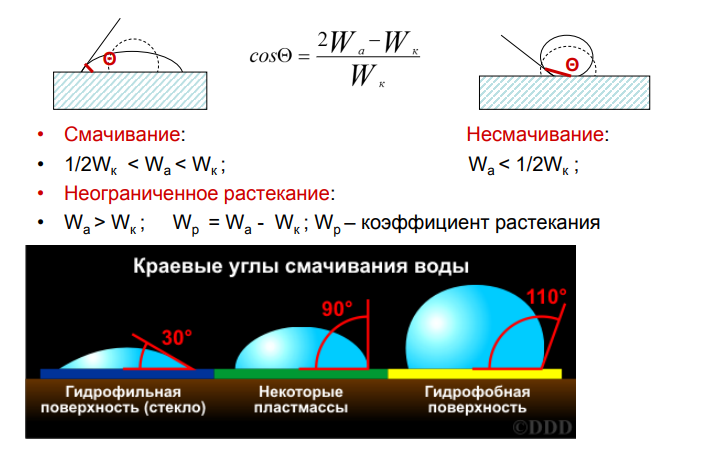
12.Работа адгезии и когезии. Выражение краевого угла смачивания через работы адгезии и когезии.

13.Влияние шероховатости поверхности на смачивание. Гистерезис смачивания.

Гистерезис смачивания — это способность жидкости образовывать при контакте с твёрдым телом несколько устойчивых (метастабильных) краевых углов, отличных по значению от равновесного. Иными словами, это задержка в установлении равновесного угла.
14.Удельная теплота смачивания. Коэффициент гидрофильности.
Удельная теплота смачивания — это количество энергии, выделяемой при смачивании единицы массы твердого тела.

15.Капиллярные явления: капиллярное давление (уравнения Лапласа-Юнга).

16.Капиллярные явления: опускание и поднятие жидкости в капилляре (формула Журена).

17.Зависимость давления насыщенного пара и растворимости от кривизны поверхности раздела сосуществующих фаз (уравнение ТомсонаКельвина).

18.Зависимость свойств дисперсных систем от степени дисперсности.