
- •Органика теория
- •1. Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2. Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4. Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5. Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8. Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10. Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •11. Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13. Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14. Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15. Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •16. Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •17. Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18. Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20. Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •21. Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •22. Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23. Номенклатура, классификация, изомерия диеновых углеводородов.
- •25. Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26. Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27. Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28. Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •29. Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30. Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами: присоединение воды и спиртов, образование ацеталей. Реакции карбонильных соединений с аммиаком, аминами.
- •60. Реакции енольных форм карбонильных соединений: α-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных α-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка. Реакции по карбоксильной и аминогруппе. Отношение к нагреванию.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
Ответ. К полисахаридам относят соединения, молекулы которых содержат более десяти моносахаридных звеньев, связанных о-гликозидной связью. Чаще всего полисахариды состоят из нескольких сотен и даже тысяч моносахаридных остатков, образующих линейные или разветвленные полимерные цепи. Гликозидные связи в полисахаридах, как правило, образуются за счет гликозидного гидроксила одного и спиртового гидроксила другого моносахаридных остатков. В большинстве своем эти связи возникают между С-1 и С-2, С-1 и С-3 или С-1 и С-6. На конце полисахаридной цепи находится восстанавливающий остаток моносахарида, но поскольку его доля в молекуле ничтожна, то полисахариды с большой молекулярной массой практически не обладают восстанавливающей способностью. Если в состав полисахаридов входят остатки только одного моносахарида, то их называют гомополисахаридами. Полисахариды, состоящие из разных моносахаридных единиц, называют гетерополисахаридами. Гомополисахариды, построенные из остатков пентоз, называются пентозанами, а из остатков гексоз — гексозанами. Общая формула пентозанов — (с5н8о4)n, а гексозанов — (с6н10о5)n. Подавляющее большинство природных полисахаридов — гексозаны (крахмал, целлюлоза, гликоген, декстраны и др). Крахмал служит основным источником резервной энергии в растениях; встречается главным образом в семенах, клубнях, корнях. Содержит примерно 20 % растворимой в воде фракции, называемой амилозой, и около 80 % нерастворимой фракции, называемой амилопектином. При постепенном кислотном и ферментативном гидролизе амилоза и амилопектин расщепляются до декстринов (смесь полисахаридов с меньшей молекулярной массой), дальнейший гидролиз которых приводит к мальтозе, а затем к D-глюкозе. Различие в строении амилозы и амилопектина обусловлено характером гликозидных связей. Амилоза — линейный полимер, содержащий более 1000 мономерных звеньев, в котором D-глюкопиранозные остатки связаны альфа-1,4-гликозидной связью. Молекулярная масса амилозы составляет примерно 150 000—600 000, ее молекулы обладают гибкостью и могут принимать различные пространственные формы. В присутствии комплексообразователей, например йода, она может существовать в виде спирали, в каждом витке которой содержится шесть остатков глюкозы. Размер внутренней полости спирали позволяет разместиться в ней молекуле йода, что приводит к образованию окрашенного в синий цвет комплекса. На этом свойстве основано использование крахмала в фармацевтическом анализе в качестве индикатора. Амилопектин — полимер разветвленной структуры, который может содержать приблизительно 600—5000 остатков D-глюкозы в молекуле. Молекулярная масса амилопектина достигает 1—6 млн. Все цепи полисахарида — основная и боковые — построены однотипно: остатки глюкозы в них соединены альфа-1,4-гликозидной связью, боковые ответвления связаны с основной цепью альфа-1,6-гликозидной связью. Между двумя соседними точками ветвления основная цепь содержит 20—25 моносахаридных остатков. В связи с наличием большого числа ответвлений молекула амилопектина не способна принимать конформацию спирали и связывает йод лишь в незначительном количестве с образованием красного окрашивания. Крахмал служит основным источником углеводов в пищевом рационе человека. фермент амилаза, содержащийся в слюне, расщепляет альфа-гликозидные связи крахмала до декстринов и частично — до мальтозы, дальнейший распад которых до глюкозы происходит в кишечнике. в фармации крахмал используется в производстве таблеток, а также для приготовления присыпок и паст. Гликоген (животный крахмал). если у большинства растений резервным полисахаридом является крахмал, то в животных организмах эту функцию выполняет гликоген. Этот полисахарид снабжает организм глюкозой при повышенных физических нагрузках и в промежутках между приемами пищи. Гликоген построен аналогично амилопектину, но представляет собой еще более разветвленную структуру. Связь глюкопиранозных остатков в основной и боковых цепях альфа-1,4, а в местах разветвления — альфа-1,6. Между точками разветвления содержится 10—12, реже — 2—4 моносахаридных остатков. Молекулярная масса гликогена может достигать 100 млн и выше. в отличие от большинства других резервных полисахаридов гликоген хорошо растворим в воде. Сильная разветвленность цепей гликогена способствует атаке его ферментами с разных сторон одновременно. Это обстоятельство приводит к чрезвычайно высокой скорости расщепления полисахарида и, следовательно, возможности почти мгновенной мобилизации заключенных в нем энергетических запасов. Наиболее богаты гликогеном печень и мышцы. Целлюлоза — широко распространенный в природе полисахарид, являющийся составной частью оболочек растительных клеток. в состав древесины входит от 50 до 70 %, а в состав хлопка — до 98 % целлюлозы. Молекула целлюлозы представляет собой линейную цепь, состоящую из остатков D-глюкопиранозы, связанных между собой бета-1,4-гликозидной связью. Молекулярная масса целлюлозы колеблется от 250 000 до 1 000 000 при содержании не менее 1500 остатков глюкозы. Целлюлоза не растворяется в воде и обычных органических растворителях, но растворяется в аммиачном растворе меди (II) гидроксида (реактив Швейцера) и концентрированном растворе цинка хлорида. Гидролиз целлюлозы осуществляется при нагревании в присутствии серной кислоты. Человек и высшие животные не имеют фермента, гидролизующего бета-гликозидные связи целлюлозы, но она является необходимым балластным компонентом пищи, улучшающим пищеварение. Молекула целлюлозы имеет строго упорядоченную конформацию «жесткий стержень», в которой глюкопиранозные остатки расположены линейно. Такое расположение остатков в пространстве обусловлено тем, что гликозидный атом кислорода и атом кислорода при С-4 связаны с пиранозным циклом экваториально. Линейная конформация молекулы закрепляется внутримолекулярными водородными связями. Параллельно уложенные цепи полисахарида удерживаются за счет образования межмолекулярных водородных связей. благодаря такому строению целлюлоза химически сравнительно инертна (нерастворима в воде, с трудом гидролизуется) и обладает высокой механической прочностью. Важное практическое значение имеют производные целлюлозы, наличие трех свободных спиртовых групп в каждом глюкозидном остатке целлюлозы дает возможность получать ее сложные эфиры. так, при обработке целлюлозы смесью азотной и серной кислот образуются нитраты целлюлозы. Свойства и возможности применения этих продуктов зависят от степени нитрования. смесь моно- и динитратов называют коллодийной ватой, или коллоксилином. ее используют для изготовления коллодия, применяющегося в медицине для фиксации повязок. Продукт полного нитрования целлюлозы (целлюлозы тринитрат, тринитроклетчатка, пироксилин) является взрывчатым веществом, используемым в производстве бездымного пороха. большое народнохозяйственное значение имеет целлюлозы диацетат, используемый в производстве ацетатного шелка, а также целлюлозы ксантогенат, применяемый для получения вискозного волокна и целлофана. натриевая соль карбоксиметилцеллюлозы применяется в производстве лекарственных препаратов. Хитин (C8H13NO5)n — природное соединение из группы азотсодержащих полисахаридов, полимер из остатков N-ацетилглюкозамина, связанных между собой β-(1→4)-гликозидными связям. Основной компонент экзоскелета (кутикулы) членистоногих и ряда других беспозвоночных животных, входит в состав клеточных стенок грибов, ряда бактерий и сине-зелёных водорослей, являясь в них аналогом целлюлозы. Распространённость хитина в природе — на втором месте среди биополимеров после целлюлозы. Представляет собой твёрдое бесцветное либо полупрозрачное вещество (жёсткое на ощупь), не растворимое в воде и полярных органических растворителях (этаноле, диэтиловом эфире, ацетоне), растворяется в растворе хлорида лития в диметилацетамиде (при отсутствии следов воды), в концентрированных растворах некоторых солей (хлорид цинка, тиоцианат лития, соли кальция) и в ионных жидкостях. При нагревании с концентрированными растворами минеральных кислот (соляной или серной) происходит гидролиз, в результате образуются мономеры N-Ацетилглюкозамина. При длительном нагревании хитина с концентрированными растворами щелочей происходит N-деацетилирование и образуется хитозан.
74. Гидроксикарбоновые кислоты: молочная, яблочная, лимонная, винные кислоты. Стереохимия α-гидроксикарбоновых кислот. Лактиды. Лактоны. Фенолокарбоновые кислоты. Салициловая кислота и ее производные. Ацетилсалициловая кислота.
Ответ.
Гидроксикислотами
называют производные карбоновых кислот,
содержащие в углеводородном радикале
одну или несколько гидроксильных групп.
В зависимости от природы углеводородного
радикала различают алифатические
гидроксикислоты (спиртокислоты) и
ароматические гидроксикислоты
(фенолокислоты). Алифатические
гидроксикислоты по взаимному расположению
карбоксильной и гидроксильной групп
подразделяют на α-, β-, γ- и другие
гидроксикислоты. Число карбоксильных
групп в молекуле гидроксикислоты
определяет основность, а число
гидроксильных групп, включая и гидроксилы,
входящие в состав карбоксильных групп,
характеризует атомность. так, гликолевая
кислота является одноосновной двухатомной
кислотой, а яблочная кислота — двухосновной
трехатомной кислотой.
Молочная кислота CH3CH(OH)COOH.
Впервые выделена из кислого молока.
Молочная кислота образуется в результате
молочнокислого брожения углеводов,
содержится в кислом молоке, кефире,
моченых яблоках, квашеной капусте,
различных солениях и др. Имеет в своей
структуре один асимметрический атом
углерода и поэтому существует в виде
двух оптически активных энантиомеров
и оптически неактивной рацемической
формы.
 L-(+)-Молочная
кислота образуется в живых организмах
в процессе расщепления углеводов. При
интенсивной физической работе она
накапливается в мышцах, вызывая
характерную боль. Соли и сложные эфиры
молочной кислоты называют лактатами.
Кальция и железа (II) лактаты применяются
в медицине в качестве лекарственных
препаратов. Кальция лактат используют
при заболеваниях, связанных с недостатком
кальция в организме. Железа (II) лактат
[CH3CH(OH)COO]2Fe применяется при хронических
анемиях. Яблочная
кислота
(гидроксиянтарная кислота) - бесцветное
кристаллическое вещество, кислое на
вкус, хорошо растворимое в воде, содержит
один асимметрический атом углерода,
поэтому она существует в виде двух
оптически активных энантиомеров и
оптически неактивной рацемической
формы. в природе встречается L-(–)-яблочная
кислота, содержится в незрелых яблоках,
ягодах рябины, клюквы, малины, барбариса
и др. Образуется в живых организмах в
процессе обмена углеводов, принимает
участие в цикле трикарбоновых кислот
(цикл кребса). В промышленности широко
используют L-(–)-яблочную кислоту в
производстве вина, фруктовых вод и
кондитерских изделий, а также в синтезе
лекарственных средств. Лимонная кислота
(2-гидрокси-1,2,3-пропантрикарбоновая
кислота) - бесцветное кристаллическое
вещество, в больших количествах содержится
в цитрусовых (лимоны, апельсины), а также
в смородине, малине и др. Как и яблочная
— один из важнейших продуктов обмена
веществ, участвующих в цикле трикарбоновых
кислот. Под действием концентрированной
серной кислоты лимонная кислота, являясь
α-гидроксикислотой, расщепляется с
образованием ацетондикарбоновой и
муравьиной кислот, дальнейшее разложение
приводит к образованию ацетона, воды,
углерода (II) и углерода (IV) оксидов. Соли
и сложные эфиры лимонной кислоты называют
цитратами. Тринатриевая соль лимонной
кислоты (натрия цитрат) применяется в
медицине для консервирования донорской
крови. Винная кислота
- молекула содержит два асимметрических
атома углерода с одинаковым набором
заместителей. Поэтому для нее известны
три стереоизомера — два оптически
активных (D-(+)-винная и L-(–)-винная
кислоты) и один — оптически неактивный
(мезовинная кислота):
L-(+)-Молочная
кислота образуется в живых организмах
в процессе расщепления углеводов. При
интенсивной физической работе она
накапливается в мышцах, вызывая
характерную боль. Соли и сложные эфиры
молочной кислоты называют лактатами.
Кальция и железа (II) лактаты применяются
в медицине в качестве лекарственных
препаратов. Кальция лактат используют
при заболеваниях, связанных с недостатком
кальция в организме. Железа (II) лактат
[CH3CH(OH)COO]2Fe применяется при хронических
анемиях. Яблочная
кислота
(гидроксиянтарная кислота) - бесцветное
кристаллическое вещество, кислое на
вкус, хорошо растворимое в воде, содержит
один асимметрический атом углерода,
поэтому она существует в виде двух
оптически активных энантиомеров и
оптически неактивной рацемической
формы. в природе встречается L-(–)-яблочная
кислота, содержится в незрелых яблоках,
ягодах рябины, клюквы, малины, барбариса
и др. Образуется в живых организмах в
процессе обмена углеводов, принимает
участие в цикле трикарбоновых кислот
(цикл кребса). В промышленности широко
используют L-(–)-яблочную кислоту в
производстве вина, фруктовых вод и
кондитерских изделий, а также в синтезе
лекарственных средств. Лимонная кислота
(2-гидрокси-1,2,3-пропантрикарбоновая
кислота) - бесцветное кристаллическое
вещество, в больших количествах содержится
в цитрусовых (лимоны, апельсины), а также
в смородине, малине и др. Как и яблочная
— один из важнейших продуктов обмена
веществ, участвующих в цикле трикарбоновых
кислот. Под действием концентрированной
серной кислоты лимонная кислота, являясь
α-гидроксикислотой, расщепляется с
образованием ацетондикарбоновой и
муравьиной кислот, дальнейшее разложение
приводит к образованию ацетона, воды,
углерода (II) и углерода (IV) оксидов. Соли
и сложные эфиры лимонной кислоты называют
цитратами. Тринатриевая соль лимонной
кислоты (натрия цитрат) применяется в
медицине для консервирования донорской
крови. Винная кислота
- молекула содержит два асимметрических
атома углерода с одинаковым набором
заместителей. Поэтому для нее известны
три стереоизомера — два оптически
активных (D-(+)-винная и L-(–)-винная
кислоты) и один — оптически неактивный
(мезовинная кислота):
 Рацемическая
форма D- и L-винных кислот называется
виноградной кислотой. В природе
встречается только D-(+)-винная кислота,
особенно высоко содержание в винограде,
который является исходным сырьем для
ее получения. Образует кислые и средние
соли. Кислые соли называют гидротартратами,
средние — тартратами. Калий-натриевая
соль винной кислоты называется сегнетовой
(сеньетовой) солью. При взаимодействии
с меди (II) гидроксидом в щелочной среде
сегнетова соль образует комплекс
ярко-синего цвета, получивший название
«реактив Фелинга», который используют
для качественного обнаружения альдегидной
группы. При нагревании в присутствии
калия гидросульфата винная кислота
отщепляет углерода (IV) оксид и воду,
превращаясь в пировиноградную кислоту.
α-гидроксикислоты,
представляют собой класс химических
соединений, которые состоят из карбоновой
кислоты, замещенной гидроксильной
группой на соседнем атоме углерода. Они
могут быть естественными или синтетическими.
AHA широко известны своим использованием
в косметической промышленности. Их
часто можно найти в продуктах, которые
помогают уменьшить морщины, смягчают
сильные четкие линии и улучшают общий
вид и ощущение кожи. α-Гидроксикислоты
являются полезными строительными
блоками в органическом синтезе. Например,
α-гидроксикислоты обычно используются
в качестве предшественников при получении
альдегидов посредством окислительного
расщепления. Рацемические α-гидроксикислоты
классически получают добавлением
цианистый водород в кетон или альдегид
с последующим кислотным гидролизом
нитрильной функциональной группы
полученного продукта циангидрина.
Лактиды,
циклические сложные эфиры a-гидроксикарбоновых
кислот, содержащие две и более группировки
—С(О)—О. Называют их как гетероциклические
соединения или в тривиальном названии
гидроксикислоты окончание преобразуют
в окончание "ид". Умножающий префикс
("ди", "три" и т.д.) указывает
на число молекул кислоты, образующих
лактид. По химическим свойствам лактиды
подобны эфиром сложным. При взаимодействии
с NH3 или аминами образуют амиды
гидроксикислот, со спиртами - их эфиры;
при кипячении с водой или щелочами легко
гидролизуются в гидроксикислоты.
Полимеризация дигликолидов приводит
к образованию линейных полиэфиров общей
формулы [—OC(RR')C(O)—]m. Основной метод
синтеза лактидов - циклизация гидрокси-
и галогенкарбоновых кислот или их
щелочных солей в присутствии триэтиламина,
ZnO, Zn-пыли, Sb2O3 или др. Реакцию проводят
при высокой температуре в вакууме и
получают циклический олигоэфир,
деполимеризация которого приводит к
смеси лактидов, разделяемой перегонкой
в вакууме. Несимметричные лактиды
получают обычно дегидратацией смеси
различных гидроксикислот. Гликолид и
лактид используют главным образом для
получения полигликолида и полилактида,
применяемых в медицине. Лактоны,
внутренние сложные эфиры гидроксикислот.
В зависимости от числа атомов в цикле
различают b-лактоны (4 атома), g-лактоны
(5 атомов) и т. д. По номенклатуре ИЮПАК,
лактоны, образованные из алифатических
кислот, называют, добавляя окончание
"олид" к названию соединения-основы;
место замыкания цикла указывают цифрой
(начало нумерации - карбоксильный атом
С). Допускаются также наименования,
основанные на тривиальных назв. карбоновых
кислот с тем же числом атомов С. В этом
случае место замыкания цикла указывается
греческой буквой. Лактоны, содержащие
в цикле более 8 атомов, относятся к
макролидам. Лактоны-жидкости или
легкоплавкие твердые вещества, хорошо
растворяются в полярных органических
растворителях и в воде. Низшие
лактоны-лакриматоры. По химическим
свойствам лактоны - эфиры сложные. При
нагревании с растворами щелочей, а в
некоторых случаях с водой, гидролизуются
с образованием соответствующих
гидроксикислот. Наиболее устойчивы к
гидролизу g-лактоны. Под действием
различных восстановителей лактоны
превращаются в карбоновые кислоты,
диолы, лактолы или простые циклические
эфиры енолов. Все лактоны, за исключением
g-лактонов легко полимеризуются в
присутствии катионных и анионных
катализаторов с образованием полиэфиров
общей формулылы [—OCHR:(CRR')nCO—]m, где R, R',
R: - H, Alk или др. Лактоны содержатся в
молоке и молочных продуктах, в растительных
мускусах. Некоторые лактоны - исходные
вещества в биосинтезе терпенов, в синтезе
биологически инертных гидрофильных
полиуретанов, используемых в хирургии;
входят в состав теплочувствительных
материалов, применяемых в копировальной
технике. Фенолокислотами
называют производные аренкарбоновых
кислот, у которых один или несколько
атомов водорода в ароматическом кольце
замещены на гидроксильные группы.
Наиболее важными представителями
фенолокислот являются
Рацемическая
форма D- и L-винных кислот называется
виноградной кислотой. В природе
встречается только D-(+)-винная кислота,
особенно высоко содержание в винограде,
который является исходным сырьем для
ее получения. Образует кислые и средние
соли. Кислые соли называют гидротартратами,
средние — тартратами. Калий-натриевая
соль винной кислоты называется сегнетовой
(сеньетовой) солью. При взаимодействии
с меди (II) гидроксидом в щелочной среде
сегнетова соль образует комплекс
ярко-синего цвета, получивший название
«реактив Фелинга», который используют
для качественного обнаружения альдегидной
группы. При нагревании в присутствии
калия гидросульфата винная кислота
отщепляет углерода (IV) оксид и воду,
превращаясь в пировиноградную кислоту.
α-гидроксикислоты,
представляют собой класс химических
соединений, которые состоят из карбоновой
кислоты, замещенной гидроксильной
группой на соседнем атоме углерода. Они
могут быть естественными или синтетическими.
AHA широко известны своим использованием
в косметической промышленности. Их
часто можно найти в продуктах, которые
помогают уменьшить морщины, смягчают
сильные четкие линии и улучшают общий
вид и ощущение кожи. α-Гидроксикислоты
являются полезными строительными
блоками в органическом синтезе. Например,
α-гидроксикислоты обычно используются
в качестве предшественников при получении
альдегидов посредством окислительного
расщепления. Рацемические α-гидроксикислоты
классически получают добавлением
цианистый водород в кетон или альдегид
с последующим кислотным гидролизом
нитрильной функциональной группы
полученного продукта циангидрина.
Лактиды,
циклические сложные эфиры a-гидроксикарбоновых
кислот, содержащие две и более группировки
—С(О)—О. Называют их как гетероциклические
соединения или в тривиальном названии
гидроксикислоты окончание преобразуют
в окончание "ид". Умножающий префикс
("ди", "три" и т.д.) указывает
на число молекул кислоты, образующих
лактид. По химическим свойствам лактиды
подобны эфиром сложным. При взаимодействии
с NH3 или аминами образуют амиды
гидроксикислот, со спиртами - их эфиры;
при кипячении с водой или щелочами легко
гидролизуются в гидроксикислоты.
Полимеризация дигликолидов приводит
к образованию линейных полиэфиров общей
формулы [—OC(RR')C(O)—]m. Основной метод
синтеза лактидов - циклизация гидрокси-
и галогенкарбоновых кислот или их
щелочных солей в присутствии триэтиламина,
ZnO, Zn-пыли, Sb2O3 или др. Реакцию проводят
при высокой температуре в вакууме и
получают циклический олигоэфир,
деполимеризация которого приводит к
смеси лактидов, разделяемой перегонкой
в вакууме. Несимметричные лактиды
получают обычно дегидратацией смеси
различных гидроксикислот. Гликолид и
лактид используют главным образом для
получения полигликолида и полилактида,
применяемых в медицине. Лактоны,
внутренние сложные эфиры гидроксикислот.
В зависимости от числа атомов в цикле
различают b-лактоны (4 атома), g-лактоны
(5 атомов) и т. д. По номенклатуре ИЮПАК,
лактоны, образованные из алифатических
кислот, называют, добавляя окончание
"олид" к названию соединения-основы;
место замыкания цикла указывают цифрой
(начало нумерации - карбоксильный атом
С). Допускаются также наименования,
основанные на тривиальных назв. карбоновых
кислот с тем же числом атомов С. В этом
случае место замыкания цикла указывается
греческой буквой. Лактоны, содержащие
в цикле более 8 атомов, относятся к
макролидам. Лактоны-жидкости или
легкоплавкие твердые вещества, хорошо
растворяются в полярных органических
растворителях и в воде. Низшие
лактоны-лакриматоры. По химическим
свойствам лактоны - эфиры сложные. При
нагревании с растворами щелочей, а в
некоторых случаях с водой, гидролизуются
с образованием соответствующих
гидроксикислот. Наиболее устойчивы к
гидролизу g-лактоны. Под действием
различных восстановителей лактоны
превращаются в карбоновые кислоты,
диолы, лактолы или простые циклические
эфиры енолов. Все лактоны, за исключением
g-лактонов легко полимеризуются в
присутствии катионных и анионных
катализаторов с образованием полиэфиров
общей формулылы [—OCHR:(CRR')nCO—]m, где R, R',
R: - H, Alk или др. Лактоны содержатся в
молоке и молочных продуктах, в растительных
мускусах. Некоторые лактоны - исходные
вещества в биосинтезе терпенов, в синтезе
биологически инертных гидрофильных
полиуретанов, используемых в хирургии;
входят в состав теплочувствительных
материалов, применяемых в копировальной
технике. Фенолокислотами
называют производные аренкарбоновых
кислот, у которых один или несколько
атомов водорода в ароматическом кольце
замещены на гидроксильные группы.
Наиболее важными представителями
фенолокислот являются
 Многие
фенолокислоты содержатся в свободном
состоянии и или в виде сложных эфиров
в растениях, из которых могут быть
выделены в индивидуальном виде.
Салициловая
кислота
(о-гидроксибензойная кислота) - белое
кристаллическое вещество (т. пл. 159 °с),
легко возгоняется, при сильном быстром
нагревании декарбоксилируется, растворима
в горячей воде. Обладает большей
кислотностью (ркa = 2,98), чем бензойная
кислота (рKa = 4,17), а также мета- или
пара-гидроксибензойные кислоты.
Повышенная кислотность салициловой
кислоты обусловлена дополнительной
стабилизацией аниона за счет образования
внутримолекулярной водородной связи.
Применяется в медицине в виде спиртовых
растворов и мазей как антисептическое
лекарственное средство, также служит
сырьем для синтеза других ЛС, таких как
натрия салицилат, метилсалицилат,
фенилсалицилат (салол), салициламид,
оксафенамид, ацетилсалициловая кислота
(аспирин). Химические превращения:
Многие
фенолокислоты содержатся в свободном
состоянии и или в виде сложных эфиров
в растениях, из которых могут быть
выделены в индивидуальном виде.
Салициловая
кислота
(о-гидроксибензойная кислота) - белое
кристаллическое вещество (т. пл. 159 °с),
легко возгоняется, при сильном быстром
нагревании декарбоксилируется, растворима
в горячей воде. Обладает большей
кислотностью (ркa = 2,98), чем бензойная
кислота (рKa = 4,17), а также мета- или
пара-гидроксибензойные кислоты.
Повышенная кислотность салициловой
кислоты обусловлена дополнительной
стабилизацией аниона за счет образования
внутримолекулярной водородной связи.
Применяется в медицине в виде спиртовых
растворов и мазей как антисептическое
лекарственное средство, также служит
сырьем для синтеза других ЛС, таких как
натрия салицилат, метилсалицилат,
фенилсалицилат (салол), салициламид,
оксафенамид, ацетилсалициловая кислота
(аспирин). Химические превращения:
 Ацетилсалициловая
кислота, натрия салицилат, метилсалицилат
и салициламид применяются в медицине
в качестве анальгетических,
противовоспалительных и жаропонижающих
средств. фенилсалицилат используется
как антисептическое средство при
заболеваниях кишечника. Оксафенамид
оказывает желчегонное действие.
Ацетилсалициловая
(2-(ацетилокси)-бензойная) кислота
– белое кристаллическое вещество,
малорастворимое в воде, хорошо растворимо
в спирте, в растворах щелочей. Это
вещество получают взаимодействием
салициловой кислоты с уксусным
ангидридом:
Ацетилсалициловая
кислота, натрия салицилат, метилсалицилат
и салициламид применяются в медицине
в качестве анальгетических,
противовоспалительных и жаропонижающих
средств. фенилсалицилат используется
как антисептическое средство при
заболеваниях кишечника. Оксафенамид
оказывает желчегонное действие.
Ацетилсалициловая
(2-(ацетилокси)-бензойная) кислота
– белое кристаллическое вещество,
малорастворимое в воде, хорошо растворимо
в спирте, в растворах щелочей. Это
вещество получают взаимодействием
салициловой кислоты с уксусным
ангидридом: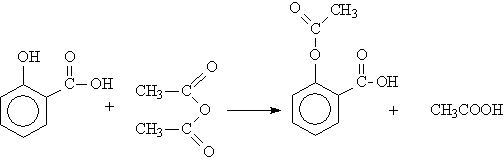 АСК
уже более 100 лет широко применяется как
лекарственное средство – жаропонижающее,
обезболивающее и противовоспалительное.
Еще одна особенность ацетилсалициловой
кислоты – это первое синтетическое
лекарственное вещество. Ацетилсалициловая
кислота понижает температуру, уменьшает
местные воспалительные процессы,
обезболивает. А еще разжижает кровь и
поэтому применяется при опасности
возникновения кровяных тромбов.
АСК
уже более 100 лет широко применяется как
лекарственное средство – жаропонижающее,
обезболивающее и противовоспалительное.
Еще одна особенность ацетилсалициловой
кислоты – это первое синтетическое
лекарственное вещество. Ацетилсалициловая
кислота понижает температуру, уменьшает
местные воспалительные процессы,
обезболивает. А еще разжижает кровь и
поэтому применяется при опасности
возникновения кровяных тромбов.
