
- •Органика теория
- •1. Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •2. Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •4. Основные признаки классификации органических веществ. Основные классы органических веществ.
- •5. Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •7. Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •8. Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •9. Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •10. Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •11. Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •13. Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •14. Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •15. Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •16. Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •17. Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •18. Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •20. Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •21. Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •22. Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •23. Номенклатура, классификация, изомерия диеновых углеводородов.
- •25. Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •26. Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •27. Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •28. Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •29. Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •30. Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •32. Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •33. Ароматичность, критерии ароматичности. Правило Хюккеля.
- •35. Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •36. Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов.
- •37. Классификация, номенклатура, изомерия галогенуглеводородов.
- •40. Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •41. Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •42. Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •43. Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •44. Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •45. Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •47. Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •48. Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •49. Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •50. Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •51. Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
- •52. Оксираны: получение, взаимодействие с водой, аммиаком и аминами, магнийорганическими соединениями. Краун-эфиры: комплексообразование с ионами металлов, применение.
- •53. Кислотность тиолов. Нуклеофильные свойства тиолов, тиолятов и органических сульфидов. Окисление тиолов. Образование дисульфидов и их роль в биохимических процессах.
- •54. Классификация, номенклатура и изомерия аминов. Алифатические и ароматические амины, первичные, вторичные и третичные амины.
- •57. Классификация, номенклатура и изомерия карбонильных соединений.
- •58. Строение карбонильной группы в альдегидах и кетонах и реакции нуклеофильного присоединения (реактивами Гриньяра, циановодородом). Механизм реакций.
- •59. Реакции карбонильных соединений с гетеронуклеофилами: присоединение воды и спиртов, образование ацеталей. Реакции карбонильных соединений с аммиаком, аминами.
- •60. Реакции енольных форм карбонильных соединений: α-галогенирование, галоформное расщепление, изотопный обмен водорода. Альдольно-кротоновая конденсация, кислотный и основный катализ.
- •61. Взаимодействие неенолизирующихся альдегидов со щелочами (реакция Канниццаро). Реакции окисления и восстановления карбонильных соединений.
- •62. Монокарбоновые кислоты. Номенклатура. Строение карбоксильной группы и карбоксилат-иона. Кислотность карбоновых кислот.
- •63. Производные карбоновых кислот: сложные эфиры и тиоэфиры (s-эфиры карбоновых кислот), галогенангидриды, ангидриды, амиды, нитрилы, их получение и взаимопревращения.
- •64. Кислотный и щелочной гидролиз сложных эфиров и амидов.
- •65. Реакции ацилирования, этерификации, аминирования и восстановления карбоновых кислот и их производных.
- •66. Жирные кислоты, важнейшие представители (пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Жиры, сложные липиды (фосфатидовая кислота и ее производные), мыла.
- •67. Ненасыщенные карбоновые кислоты: акриловая, метакриловая, полимеры на их основе.
- •68. Дикарбоновые кислоты. Основные представители: щавелевая, малоновая, адипиновая, фталевые кислоты. Фумаровая и малеиновая кислоты. Полиэфирные волокна на основе терефталевой и адипиновой кислот.
- •69. Классификация углеводов. Биологическая роль и распространенность углеводов.
- •72. Дисахариды и их типы (восстанавливающие и невосстанавливающие). Сахароза, лактоза, мальтоза, целлобиоза.
- •73. Полисахариды (крахмал, целлюлоза, хитин, гликоген).
- •75. Классификация аминокислот. Основные представители природных α-аминокислот, их стереохимия.
- •76. Свойства аминокислот: амфотерность, изоэлектрическая точка. Реакции по карбоксильной и аминогруппе. Отношение к нагреванию.
- •77. Пептидная связь. Синтез пептидов: активация и защита функциональных групп аминокислот. Белки, их строение и биологическая роль
- •79. Шестичленные гетероциклы с одним гетероатомом: пиридин, хинолин, изохинолин. Ароматичность пиридина и особенности проведения реакций электрофильного замещения. Пиридин как основание.
30. Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
Ответ.
Алициклические углеводороды классифицируют
в зависимости от числа циклов, их величины
и способа соединения. По числу циклов,
входящих в состав молекулы, алициклические
углеводороды подразделяют на моно- и
полициклические (би-, трициклические и
др.). В ряду моноциклических алициклических
соединений выделяют малые циклы (С3 и
С4), обычные (С5—С7), средние (С8—С11) и
макроциклы (12 и более атомов углерода).
Наиболее многочисленная группа в ряду
алициклических углеводородов —
моноциклические соединения. С целью
упрощения написания структурных формул
алициклические соединения условно
изображают в виде геометрических
структур (многоугольников). В соответствии
с правилами IUPAC названия
моноциклических алициклических
углеводородов образуют от названий
алканов с соответствующим количеством
атомов углерода, прибавляя префикс
цикло-. Положение заместителей в кольце
обозначают с помощью цифровых локантов.
Нумерацию углеродных атомов цикла
начинают с атома, имеющего заместитель;
далее проводят таким образом, чтобы
остальные атомы углерода цикла, связанные
с заместителями, получили возможно
меньшие номера. При наличии в цикле
кратной связи нумерацию начинают с
атомов углерода, образующих кратную
связь. Структуры, состоящие из двух и
более циклов, относят к полициклическим
(многоядерным) углеводородам. В зависимости
от взаимного расположения циклов
многоядерные алициклические углеводороды
подразделяют на следующие основные
группы: (СH2)n с изолированными циклами,
разделенными углерод-углеродной цепью;
с циклами, непосредственно связанными
простой (или двойной) углерод-углеродной
связью; с циклами, имеющими один общий
атом (спираны); с циклами, имеющими два
общих атома (конденсированные системы);
с числом общих атомов в цикле больше
двух (мостиковые системы). Для первых
двух групп углеводородов в названиях
используют преимущественно рациональную
номенклатуру:
![]() Название
спирановой системы составляют, прибавляя
префикс спиро- к названию углеводорода
с соответствующим числом атомов углерода.
Между префиксом и названием в квадратных
скобках указывают (в порядке возрастания)
число атомов углерода, исключая общий,
в каждом из циклов. Нумерацию углеродных
атомов спирановой системы начинают с
меньшего цикла, причем узловой атом
нумеруют последним. Названия
конденсированных и мостиковых
алициклических соединений образуют,
прибавляя префикс бицикло- к названию
углеводорода с соответствующим числом
атомов углерода. Между префиксом и
названием углеводорода в квадратных
скобках указывают (в порядке убывания)
число атомов углерода в каждой из трех
цепей, соединяющих два третичных
(узловых) углеродных атома (последние
при этом не учитывают). Нумерацию атомов
углерода начинают с одного из узловых
атомов и осуществляют таким образом,
чтобы вначале была пронумерована самая
длинная цепь, соединяющая узловые атомы,
затем более короткая, а в случае мостиковых
систем — в заключение нумеруют самую
короткую углеродную цепь — мостик.
Систематические названия полициклических
соединений сложны, поэтому чаще используют
тривиальные названия. Циклоалканы
(циклопарафины, полиметины, цикланы) —
одноядерные насыщенные алициклические
углеводороды. Общая формула циклоалканов
CnH2n (n 3). Для циклоалканов характерна
структурная, геометрическая и оптическая
изомерия.
Структурная изомерия обусловлена:
размером цикла; положением заместителей
в цикле; структурой боковых цепей.
Геометрическая изомерия циклоалканов
связана с различным расположением
заместителей относительно плоскости
цикла. Оптическая изомерия характерна
для циклоалканов, молекулы которых не
имеют плоскости симметрии. Она неразрывно
связана с геометрической изомерией.
Так, транс-1,2-диметилциклопропан
существует в виде пары энантиомеров.
Название
спирановой системы составляют, прибавляя
префикс спиро- к названию углеводорода
с соответствующим числом атомов углерода.
Между префиксом и названием в квадратных
скобках указывают (в порядке возрастания)
число атомов углерода, исключая общий,
в каждом из циклов. Нумерацию углеродных
атомов спирановой системы начинают с
меньшего цикла, причем узловой атом
нумеруют последним. Названия
конденсированных и мостиковых
алициклических соединений образуют,
прибавляя префикс бицикло- к названию
углеводорода с соответствующим числом
атомов углерода. Между префиксом и
названием углеводорода в квадратных
скобках указывают (в порядке убывания)
число атомов углерода в каждой из трех
цепей, соединяющих два третичных
(узловых) углеродных атома (последние
при этом не учитывают). Нумерацию атомов
углерода начинают с одного из узловых
атомов и осуществляют таким образом,
чтобы вначале была пронумерована самая
длинная цепь, соединяющая узловые атомы,
затем более короткая, а в случае мостиковых
систем — в заключение нумеруют самую
короткую углеродную цепь — мостик.
Систематические названия полициклических
соединений сложны, поэтому чаще используют
тривиальные названия. Циклоалканы
(циклопарафины, полиметины, цикланы) —
одноядерные насыщенные алициклические
углеводороды. Общая формула циклоалканов
CnH2n (n 3). Для циклоалканов характерна
структурная, геометрическая и оптическая
изомерия.
Структурная изомерия обусловлена:
размером цикла; положением заместителей
в цикле; структурой боковых цепей.
Геометрическая изомерия циклоалканов
связана с различным расположением
заместителей относительно плоскости
цикла. Оптическая изомерия характерна
для циклоалканов, молекулы которых не
имеют плоскости симметрии. Она неразрывно
связана с геометрической изомерией.
Так, транс-1,2-диметилциклопропан
существует в виде пары энантиомеров.
31. Конформации циклогексана и его производных, пространственная изомерия производных циклогексана. Типы напряжений в молекулах циклоалканов. Химические свойства циклоалканов (циклобутана, циклопентана и циклогексана, циклопропана).
Ответ. Для циклоалканов характерна структурная, геометрическая и оптическая изомерия. Структурная изомерия обусловлена: размером цикла; положением заместителей в цикле; структурой боковых цепей. Геометрическая изомерия циклоалканов связана с различным расположением
заместителей
относительно плоскости цикла:
 Оптическая
изомерия характерна для циклоалканов,
молекулы которых не имеют плоскости
симметрии. Она неразрывно связана с
геометрической изомерией. Так,
транс-1,2-диметилциклопропан существует
в виде пары энантиомеров:
В
молекулах циклоалканов атомы углерода
находятся в состоянии sр3-гибридизации.
Но если молекулы алканов обладают
значительной гибкостью за счет свободного
вращения вокруг углерод-углеродных
связей, то молекулы циклоалканов,
несмотря на возможные конформационные
повороты, представляют собой в определенной
степени жесткие образования. Для молекул
циклоалканов, как и для алканов, характерны
торсионное напряжение
(напряжение Питцера), связанное со
взаимодействием химических связей в
заслоненной или частично заслоненной
конформациях, и напряжение Ван-дер-Ваальса,
обусловленное взаимным отталкиванием
заместителей при сближении на расстояние,
близкое к сумме их вандерваальсовых
радиусов. Для некоторых циклоалканов
также характерно напряжение, связанное
с отклонением валентных углов между
углерод-углеродными связями в цикле от
нормального (тетраэдрического) значения.
Это напряжение получило название
«угловое», или «напряжение Байера». По
этой теории циклоалканы рассматривались
в форме плоских многоугольников.
Фактором, определяющим прочность цикла,
считалось напряжение, вызванное
отклонением внутренних валентных углов
между атомами углерода в цикле от угла
109°28' в метане. Чем больше такое отклонение,
тем выше напряжение и менее устойчив
цикл. Напряжение Байера оценивают
посредством валентного отклонения (α),
приходящегося на одну связь (сторона
угла). Для циклопропана валентное
отклонение составляет α = (109° 28' – 60°)/2
= 24° 44', циклобутана — α4 = (109° 28' – 90°)/2 =
9° 44', циклопентана — α5 = (109° 28' – 108°)/2 =
0° 44' и т. д. Трехчленный цикл менее
устойчив, чем четырехчленный, а тот, в
свою очередь, менее устойчив, чем
пятичленный цикл. Пространственное
строение циклоалканов определяется
разной конформационной подвижностью
углеродных атомов, зависящей от числа
звеньев в цикле. Молекула любого
циклоалкана стремится принять в
пространстве такую форму (конформацию),
в которой сумма углового, торсионного
и вандерваальсового напряжений была
бы минимальной. Из всех циклоалканов
наиболее жесткую структуру имеют
соединения, содержащие трехчленный
цикл. Поскольку в соответствии с правилами
геометрии три точки всегда лежат в одной
плоскости, трехчленный цикл может иметь
только плоское строение. Атомы водорода
в таком цикле находятся в заслоненной
конформации, что создает сильное
торсионное напряжение. Поворот вокруг
углерод-углеродных связей невозможен.
Внутренние валентные углы между связями
С—С в трехчленном цикле сильно отклонены
от тетраэдрического значения (109° 28'), в
результате чего возникает большое
угловое напряжение. Молекула циклогексана
существует в виде двух крайних конформаций
— «кресло» и «ванна» («лодка»), которые
легко переходят друг в друга. В указанных
конформациях все валентные углы
тетраэдрические, а следовательно,
отсутствует угловое напряжение. Более
устойчивой является конформация
«кресло», поскольку в ней все атомы
водорода и углерода находятся в
заторможенной конформации, что исключает
торсионное напряжение. В конформации
«ванна» при атомах углерода, расположенных
в «основании», водородные атомы находятся
в заслоненной конформации, создающей
определенное торсионное напряжение.
Эта конформация, являясь гибкой
структурой, может переходить в несколько
более устойчивую форму (с меньшим
заслонением), называемую твист-конформацией
(искаженная «ванна»). Энергия конформации
«кресло» примерно на 33 кДж/моль ниже
энергии конформации «ванна» и на 21
кДж/моль — энергии твист-конформации.
Поэтому при обычных условиях преобладающая
часть молекул циклогексана (99,9 %)
существуют в конформации «кресло»,
причем кольцо претерпевает непрерывную
инверсию, то есть в результате вращения
вокруг углерод-углеродных связей одна
конформация «кресло» переходит в другую
с промежуточным образованием конформации
«ванна» и твист-конформации. В химическом
отношении циклоалканы во многом ведут
себя подобно алканам. Для них характерны
реакции замещения, протекающие по
радикальному механизму (SR):
Оптическая
изомерия характерна для циклоалканов,
молекулы которых не имеют плоскости
симметрии. Она неразрывно связана с
геометрической изомерией. Так,
транс-1,2-диметилциклопропан существует
в виде пары энантиомеров:
В
молекулах циклоалканов атомы углерода
находятся в состоянии sр3-гибридизации.
Но если молекулы алканов обладают
значительной гибкостью за счет свободного
вращения вокруг углерод-углеродных
связей, то молекулы циклоалканов,
несмотря на возможные конформационные
повороты, представляют собой в определенной
степени жесткие образования. Для молекул
циклоалканов, как и для алканов, характерны
торсионное напряжение
(напряжение Питцера), связанное со
взаимодействием химических связей в
заслоненной или частично заслоненной
конформациях, и напряжение Ван-дер-Ваальса,
обусловленное взаимным отталкиванием
заместителей при сближении на расстояние,
близкое к сумме их вандерваальсовых
радиусов. Для некоторых циклоалканов
также характерно напряжение, связанное
с отклонением валентных углов между
углерод-углеродными связями в цикле от
нормального (тетраэдрического) значения.
Это напряжение получило название
«угловое», или «напряжение Байера». По
этой теории циклоалканы рассматривались
в форме плоских многоугольников.
Фактором, определяющим прочность цикла,
считалось напряжение, вызванное
отклонением внутренних валентных углов
между атомами углерода в цикле от угла
109°28' в метане. Чем больше такое отклонение,
тем выше напряжение и менее устойчив
цикл. Напряжение Байера оценивают
посредством валентного отклонения (α),
приходящегося на одну связь (сторона
угла). Для циклопропана валентное
отклонение составляет α = (109° 28' – 60°)/2
= 24° 44', циклобутана — α4 = (109° 28' – 90°)/2 =
9° 44', циклопентана — α5 = (109° 28' – 108°)/2 =
0° 44' и т. д. Трехчленный цикл менее
устойчив, чем четырехчленный, а тот, в
свою очередь, менее устойчив, чем
пятичленный цикл. Пространственное
строение циклоалканов определяется
разной конформационной подвижностью
углеродных атомов, зависящей от числа
звеньев в цикле. Молекула любого
циклоалкана стремится принять в
пространстве такую форму (конформацию),
в которой сумма углового, торсионного
и вандерваальсового напряжений была
бы минимальной. Из всех циклоалканов
наиболее жесткую структуру имеют
соединения, содержащие трехчленный
цикл. Поскольку в соответствии с правилами
геометрии три точки всегда лежат в одной
плоскости, трехчленный цикл может иметь
только плоское строение. Атомы водорода
в таком цикле находятся в заслоненной
конформации, что создает сильное
торсионное напряжение. Поворот вокруг
углерод-углеродных связей невозможен.
Внутренние валентные углы между связями
С—С в трехчленном цикле сильно отклонены
от тетраэдрического значения (109° 28'), в
результате чего возникает большое
угловое напряжение. Молекула циклогексана
существует в виде двух крайних конформаций
— «кресло» и «ванна» («лодка»), которые
легко переходят друг в друга. В указанных
конформациях все валентные углы
тетраэдрические, а следовательно,
отсутствует угловое напряжение. Более
устойчивой является конформация
«кресло», поскольку в ней все атомы
водорода и углерода находятся в
заторможенной конформации, что исключает
торсионное напряжение. В конформации
«ванна» при атомах углерода, расположенных
в «основании», водородные атомы находятся
в заслоненной конформации, создающей
определенное торсионное напряжение.
Эта конформация, являясь гибкой
структурой, может переходить в несколько
более устойчивую форму (с меньшим
заслонением), называемую твист-конформацией
(искаженная «ванна»). Энергия конформации
«кресло» примерно на 33 кДж/моль ниже
энергии конформации «ванна» и на 21
кДж/моль — энергии твист-конформации.
Поэтому при обычных условиях преобладающая
часть молекул циклогексана (99,9 %)
существуют в конформации «кресло»,
причем кольцо претерпевает непрерывную
инверсию, то есть в результате вращения
вокруг углерод-углеродных связей одна
конформация «кресло» переходит в другую
с промежуточным образованием конформации
«ванна» и твист-конформации. В химическом
отношении циклоалканы во многом ведут
себя подобно алканам. Для них характерны
реакции замещения, протекающие по
радикальному механизму (SR):
 Циклопропан
и циклобутан проявляют химические
свойства, связанные с особенностью их
строения. Из-за большого углового и
торсионного напряжений трехчленный
цикл и, в меньшей степени, четырехчленный
— являются неустойчивыми. Поэтому
соединения содержащие трех- и четырехчленные
циклы, наряду с реакциями замещения
вступают также в реакции присоединения,
сопровождающиеся раскрытием цикла.
Циклопропан в присутствии катализаторов
Ni, Рt и нагревании до 50 °С легко присоединяют
водород. Циклобутан присоединяет водород
при более высокой температуре (200 °С).
Аналогично протекает реакция циклопропана
с галогенами и галогеноводородами:
Циклопропан
и циклобутан проявляют химические
свойства, связанные с особенностью их
строения. Из-за большого углового и
торсионного напряжений трехчленный
цикл и, в меньшей степени, четырехчленный
— являются неустойчивыми. Поэтому
соединения содержащие трех- и четырехчленные
циклы, наряду с реакциями замещения
вступают также в реакции присоединения,
сопровождающиеся раскрытием цикла.
Циклопропан в присутствии катализаторов
Ni, Рt и нагревании до 50 °С легко присоединяют
водород. Циклобутан присоединяет водород
при более высокой температуре (200 °С).
Аналогично протекает реакция циклопропана
с галогенами и галогеноводородами:
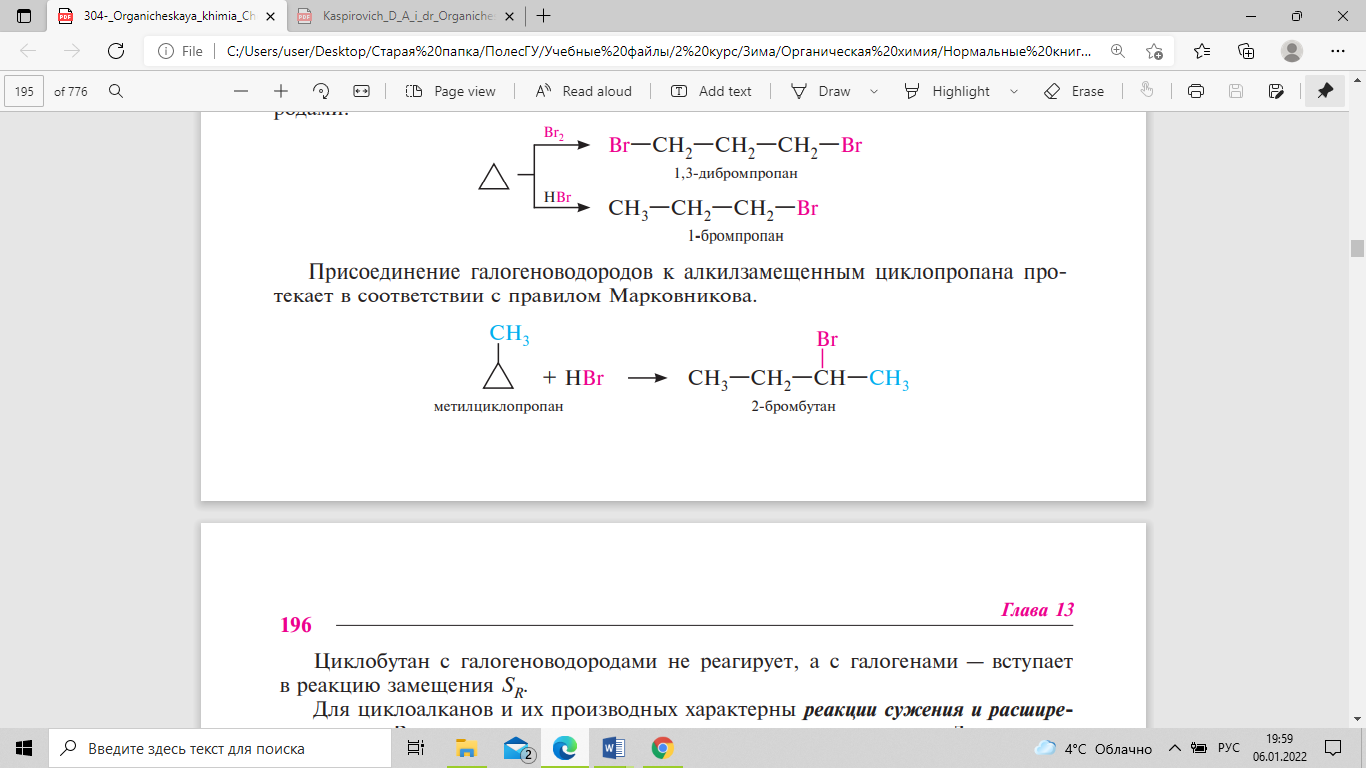 Присоединение
галогеноводородов к алкилзамещенным
циклопропана протекает в соответствии
с правилом Марковникова. Циклобутан с
галогеноводородами не реагирует, а с
галогенами — вступает в реакцию замещения
SR. Для циклоалканов и их производных
характерны реакции сужения и расширения
циклов. Реакции протекают в присутствии
катализаторов кислот Льюиса:
Присоединение
галогеноводородов к алкилзамещенным
циклопропана протекает в соответствии
с правилом Марковникова. Циклобутан с
галогеноводородами не реагирует, а с
галогенами — вступает в реакцию замещения
SR. Для циклоалканов и их производных
характерны реакции сужения и расширения
циклов. Реакции протекают в присутствии
катализаторов кислот Льюиса:
![]()
