
- •Органическая химия
- •Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •Основные признаки классификации органических веществ. Основные классы органических веществ.
- •Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основые равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •Номенклатура, классификация, изомерия диеновых углеводородов.
- •Классификация диенов:
- •Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •Ароматичность, критерии ароматичности. Правило Хюккеля.
- •Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •Классификация, номенклатура, изомерия галогенуглеводородов.
- •Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
Энергетический профиль реакции – это графическая зависимость энергии системы от сложной функции расстояния между реагирующими веществами, которую обычно называют «координатой реакции» или «ходом реакции».
Разница между средней энергией молекул А и Б и средней энергией переходных состояний (которые тоже рассматриваются как молекулы), называется энергетическим барьером или энергией активации Еа этой реакции. Итак, мы видим, что начальное и конечное состояние вещества в химической реакции разделены неким энергетическим барьером. Его величину обычно выражают в кДж на моль А (или на моль Б). Этот барьер называется энергией активации реакции и обозначается символом Еа.
Энергия активации Еа - это та дополнительная энергия (к средней энергии Е сталкивающихся частиц), которая необходима, чтобы столкновение привело к химической реакции.
Переходное состояние — состояние системы, при котором уравновешены разрушенные и созданные связи. В переходном состоянии система находится в течение небольшого времени. Энергия, которую необходимо затратить, чтобы привести систему в переходное состояние, называется энергией активации.
Тепловой эффект реакции — это энергия, которая выделяется или поглощается, когда химические вещества претерпевают превращения в процессе химической реакции. Этот параметр отражает изменение содержания энергии при превращении реактантов в продукты.
Кинетический и термодинамический контроль:
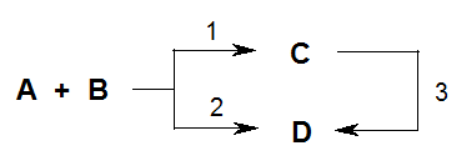
В ряде случаев могут образовываться 2 продукта, один из которых может превращаться в другой. При низкой температуре, когда энергия реагирующих молекул невелика, основное направление реакции – образование соединения С. Этот процесс контролируется скоростью и называется кинетически контролируемой реакцией, а соединение С – продуктов кинетического контроля. Образование соединения D требует большей энергии, однако продукт D более устойчив, чем С. Поэтому с ростом температуры наблюдается преобладание соединения D. Процесс образования соединения D контролируется энергетическими факторами и называется термодинамически контролируемой реакцией, а соединение D – продукт термодинамического контроля.
Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основые равновесия. Константа кислотной ионизации и ее показатель (рКа).
Теория Бренстеда:
Кислота – всякое вещество, молекулярные частицы которого способны отдавать протон, т.е. быть донором протонов.
Основание – всякое вещество, способное присоединять протоны, т.е. быть акцептором протонов.




Теория Льюиса:
Кислота – вещество, принимающее электронные пары – акцептор электронов. (Кислоты Льюиса AlCl3, ZnCl2 и др.)
Основание – вещество, поставляющее электроны для образования химической связи – донор электронов.
Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
В органических соединениях различают два вида электронных смещений: смещение электронной плотности по цепи σ-связей — индуктивный эффект; смещение по системе π-связей — мезомерный эффект.
Индуктивный эффект связан с различными электроотрицательностями функциональных групп и реакционного центра. В зависимости от направления электронного влияния заместителя различают положительный (+І) и отрицательный (–І) индуктивный эффект. Заместители, притягивающие к себе электроны σсвязи в большей степени, чем атом водорода, проявляют отрицательный индуктивный эффект (–І), а заместители, отталкивающие от себя электроны σсвязи сильнее атома водорода, проявляют положительный индуктивный эффект (+І ).
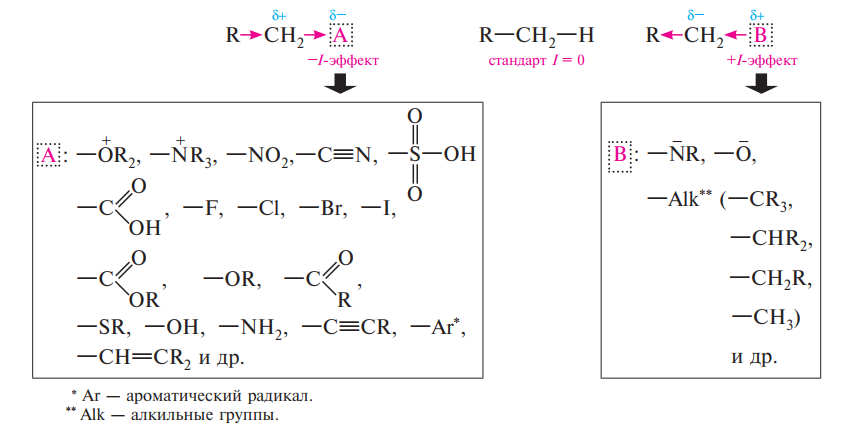
Таким образом, на основании вышеизложенного можно сделать следующие выводы: 1. Индуктивный эффект проявляется всегда при наличии в молекуле атомов с различной электроотрицательностью.
2. Индуктивный эффект распространяется только через σ-связи и всегда в одном направлении.
3. Индуктивный эффект затухает в цепи через 3—4 σ-связи.
Мезомерный эффект – только те молекулы, где есть возможность сопряжения заместителя R с остальной частью молекулы R-X.
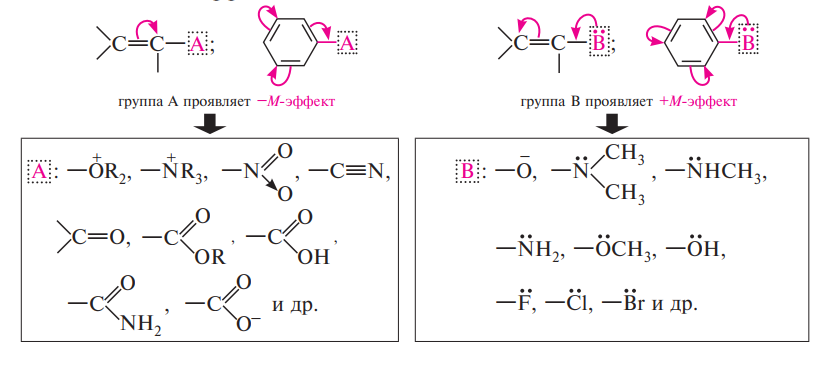
Различают положительный (+М) и отрицательный (–М) мезомерный эффект. Положительный мезомерный эффект проявляют заместители, подающие электроны в сопряженную систему.
Отрицательный мезомерный эффект проявляют заместители, смещающие на себя электронную плотность сопряженной системы.
Сверхсопряжение (гиперконъюгация) — взаимодействие, возникающее в молекуле, карбокатионе или в свободном радикале в результате перекрывания σорбитали с—нсвязей с соседними π или pорбиталями и приводящее к дополнительной стабилизации системы (σ,π или σ,рсопряжения).
Сверхсопряжение характерно для соединений, в молекулах которых sp3-гибридизованный атом углерода, имеющий по крайней мере один атом водорода, расположен рядом с кратной связью, ароматической системой (σ,π-сопряжение) или фрагментом молекулы с вакантной или частично заполненной р-орбиталью (σ,р-сопряжение).
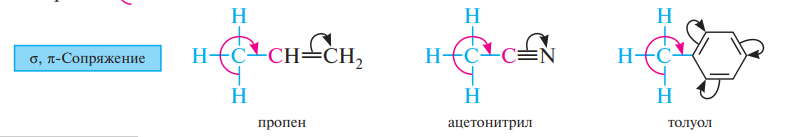
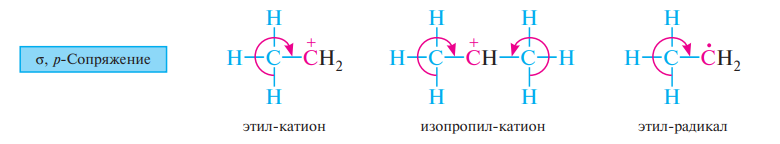
Перегонка, перекристаллизация как методы выделения и очистки органических соединений. Химические и физические методы установления структуры. Качественный функциональный анализ органических соединений.
Повторная кристаллизация (перекристаллизация) позволяет увеличить степень очистки, но при этом происходит потеря вещества в маточном растворе. Из маточных растворов и промывных жидкостей можно извлечь добавочное количество вещества, если отогнать из них часть растворителя, охладить раствор и произвести кристаллизацию. Полученные при этом кристаллы обычно бывают менее чистыми, чем первая порция, их следует перекристаллизовать еще раз. Если перекристаллизация вещества велась из воды, то маточный раствор можно упаривать до половины в фарфоровой чашке, а затем охладить для кристаллизации.
Перегонка – процесс, в ходе которого вещество нагревают до температуры кипения, образовавшийся пар отводят и конденсируют. Существует три способа перегонки жидкости:
а) при нормальном давлении (простая и фракционная перегонка) – применяют, если разница в температурах кипения веществ, входящих в состав смеси, не менее 80-100оС
б) при пониженном давлении (перегонка в вакууме) – если перегоняемые вещества полностью или частично разлагаются при температуре кипения
в) с водяным паром – используют для выделения из смеси веществ, которые кипят при высокой температуре, возможно разлагаются
Химические методы установления структуры – качественные реакции.
Физические: К важнейшим физическим методам исследования строения относятся спектральные (инфракрасная (ИК-) спектроскопия, спектроскопия комбинационного рассеяния (КР), ультрафиолетовая (УФ-) спектроскопия и спектроскопия в видимой области спектра, спектроскопия ядерного магнитного резонанса (ЯМР), масс-спектрометрия) и дифракционные методы (рентгенография, электронография, нейтронография).
