
- •3. Цели занятия.
- •3.2. Конкретные цели и задачи.
- •4. Вопросы, изученные на предшествующих дисциплинах и необходимые для освоения темы.
- •5. Задания для самостоятельной подготовки к практическому занятию:
- •7. Ориентировочная основа действия (одд) для проведения самостоятельной работы студентов в учебное время.
- •Влияние концентрации веществ на смещение равновесия
- •8. Задания для контроля сфомированности компетенций в учебное время.
- •9. Учебно-материальнное обеспечение:
- •10. Материальное обеспечение:
1. Тема: «Качественные опыты по химическому равновесию». Модуль 2.
2. Мотивация: Термодинамическая оценка химического равновесия позволяет решить теоретические и практические проблемы в:
- нормальной физиологии: оценка транспортной функции белков, дыхание, действие буферных систем в организме;
- биологической химии: каталитическое действие ферментов, процессы при их отравлении и активации; действие коферментов НАД+ и НАДФ.
3. Цели занятия.
3.1. Общая цель: изучение темы направлено на формирование компетенций УК – 1,ОПК-3 по ФГОС специальности.
3.2. Конкретные цели и задачи.
После изучения темы студент должен:
«Знать» - основные понятия термодинамики; химическое равновесие, способы расчета констант равновесия.
«Уметь» - решать типовые и ситуационные задачи, опираясь на теоретические положения; проводить наблюдения за протеканием химических реакций и делать обоснованные выводы; рассчитывать термодинамические функции состояния системы, прогнозировать результаты процессов, протекающих в окружающей среде; ориентироваться в справочных данных;
«Владеть» - техникой проведения экспериментов, навыками безопасной работы в химической лаборатории;
4. Вопросы, изученные на предшествующих дисциплинах и необходимые для освоения темы.
1. Типы химических реакций: экзотермические, эндотермические (общее среднее образование).
2. Основы термохимии (общее среднее образование).
3. Принцип Ле-Шателье (общее среднее образование).
4. Химическое равновесие. Обратимые и необратимые процессы (общее среднее образование).
6. Функции состояния систем: энтальпия, энтропия, энергия Гиббса: математическое выражение, подтверждающие их физический смысл, расчетные формулы (кафедра общей и биологической химии).
5. Задания для самостоятельной подготовки к практическому занятию:
5.1. Перечень контрольных вопросов для самоконтроля знаний.
1. Второе начало термодинамики.
2.Энтропия (Ѕ) и свободная энергия Гиббса (G) – критерии самопроизвольного протекания процесса. Их физический смысл и способы расчёта.
3. Соотношение энтальпийного и энтропийного факторов и его связь с направлением реакции.
4. Закон действующих масс (ЗДМ) для обратимых реакций. Константа равновесия (Кравн.), способы её выражения.
5. Термодинамическое обоснование принципа Ле Шателье:
- уравнение изотермы и его анализ;
- уравнение изобары и его анализ.
5.2. Задания для СРС во внеучебное время.
Задача № 1.
Вычислите стандартное изменение энергии Гиббса окисления этанола в присутствии каталазы:
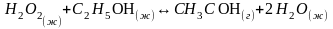
Указать направление процесса.
Ответ: ΔG0 = - 307 кДж/моль →
Задача на 1 – ое следствие из закона Гесса.
Задача № 2.
Для реакции
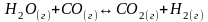 константы равновесия равны: при 8000
С К1
= 2,87, при
10000 С
К2 =
1,39. Вычислите стандартную энтальпию
этой реакции: а). по уравнению изобары;
б). по следствию из закона Гесса.
Сопоставьте полученные значения.
константы равновесия равны: при 8000
С К1
= 2,87, при
10000 С
К2 =
1,39. Вычислите стандартную энтальпию
этой реакции: а). по уравнению изобары;
б). по следствию из закона Гесса.
Сопоставьте полученные значения.
Ответ:
а)
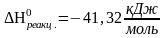
б)
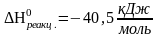
Значение ΔH0, полученные разными способами, практически одинаковы.
Задача № 3.
Константа равновесия
реакции:
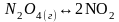
при 250 С равна 4,64·10-3. В каком направлении будет протекать реакция при следующих концентрациях веществ:
а)
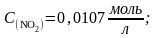
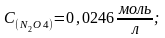
б)
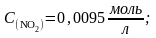
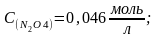
Ответ: а) Пс ≈ Кс ↔
б) Пс < Кс →
Задача решается сравнением численных величин Пс и Кс в уравнении изотермы.
5.3. Задания для самоконтроля подготовки к практическому занятию.
Вариант теста № 1.
Направление любой обратимой реакции корректнее всего определять по знаку:
а) ΔН;
б) ΔЅ;
в) ΔG;
Вариант теста № 2.
Знак ΔЅ0
для реакции
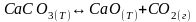 ,
,
протекающей в прямом направлении в изолированной системе,:
а) отрицателен;
б) положителен;
в) определить невозможно.
Вариант теста № 3.
При стандартной
температуре и давлении для реакции
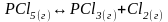
ΔG0>0, ΔS0>0.
Увеличение выхода РСl3 можно добиться:
а) уменьшением температуры, увеличением давления;
б) температура и давление не влияют на смещение химического равновесия и увеличение выхода РСl3;
в) увеличением температуры, понижением давления.
Вариант теста № 4.
Уравнение изотермы для реакции
С (т) + Н2О (г) ↔ СО (г) + Н2 (г)
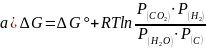
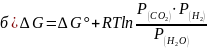
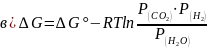
6. Этапы проведения практического занятия.
№ |
Название этапа |
Цель этапа |
Время, мин |
1 |
2 |
3 |
4 |
|
I. Вводная часть занятия. |
10 |
|
1. |
Организация занятия |
Проверка присутствующих, их внешнего вида, наличия рабочих тетрадей и лекций. |
5 |
2. |
Определение темы, мотивации, целей, задач занятия |
Формирование мотивации данного занятия, значимости его в подготовке врача. |
5 |
|
II. Основная часть занятия. |
160 |
|
3. |
Контроль исходных знаний, умений и навыков |
Выявление исходного уровня знаний, умений и навыков. |
10 |
4. |
Общие и индивидуальные задания для СРС в учебное время. |
Дифференцированное ориентирование студентов к предстоящей работе. |
40 |
5. |
Демонстрация методики лабораторной работы |
Разбор ориентировочной основы действия (ООД). |
10 |
6. |
Управляемая СРС в учебное время |
Выполнение эксперимента. Овладение общепрофессиональными и универсальными компетенциями ОПК – 3, УК-1. |
60 |
7. |
Реализация планируемой формы занятия |
Контроль результатов обучения и оценка с помощью дескрипторов. |
30 |
8. |
Итоговый контроль |
Оценивание индивидуальных достижений студента, выявление ошибок и их корректировка. |
10 |
|
III. Заключительная часть занятия. |
10 |
|
9. |
Подведение итогов занятия. |
Оценка деятельности студентов и достижения цели занятия. |
5 |
10. |
Общие и индивидуальные задания на СРС во внеучебное время. |
Указание по самоподготовке студентов к занятию «Изучение влияния различных факторов на скорость химической реакции». |
5 |
