
- •3. Цели занятия.
- •3.2. Конкретные цели и задачи.
- •4. Вопросы, изученные на предшествующих дисциплинах и необходимые для освоения темы.
- •5. Задания для самостоятельной подготовки к практическому занятию:
- •7. Ориентировочная основа действия (одд) для проведения самостоятельной работы студентов в учебное время.
- •8. Задания для контроля сфомированности компетенций в учебное время.
- •9. Учебно-материальнное обеспечение:
- •9.1. Литература:
- •10. Материальное обеспечение:
1. Тема: «Изучение влияния различных факторов на скорость химической реакции».
2. Мотивация: Кинетические исследования позволяют решить теоретические и практические проблемы в:
-биологической химии, нормальной физиологии: изучение механизмов ферментативных процессов, оценка скоростей биохимических и физиологических процессов в норме и при патологии, и др.;
- биоорганической химии: влияние различных факторов на скорость химических процессов.
- гигиене питания: оценка скоростей химического загрязнения, анализ пищевых продуктов, обеспечение требуемого качества воды в источниках водоснабжения, очистка атмосферы и т.д
3. Цели занятия.
3.1. Общая цель: изучение темы направлено на формирование компетенций УК – 1, ОПК-3 по ФГОС
3.2. Конкретные цели и задачи.
После изучения темы студент должен:
«Знать» - основные задачи кинетики. Факторы, влияющие на скорость; законы и правила их описывающие. Понятие молекулярности, порядка реакции, периода полупревращения. Кинетические уравнения 0, I, II порядков;
«Уметь» - решать типовые и ситуационные задачи, используя закон действующих масс, уравнение Аррениуса, правило Вант – Гоффа, кинетические уравнения 0, I, II порядков. Ориентироваться в справочных данных. Интерпретировать полученные экспериментальные данные, на основании чего делать выводы о порядке реакции и энергии активации;
«Владеть» - навыками экспериментального определения скорости реакции и энергии активации, пользоваться химическим оборудованием. Навыками безопасной работы в химической лаборатории.
4. Вопросы, изученные на предшествующих дисциплинах и необходимые для освоения темы.
Скорость реакции, её математическое выражение и особенности.
Факторы, влияющие на скорость.
Закон действующих масс и его математическое выражение.
Правило Вант–Гоффа и его математическое выражение. Представление об энергии активации.
Понятие о катализаторах.
Знания получены при изучении курса химии общеобразовательных учебных заведений.
5. Задания для самостоятельной подготовки к практическому занятию:
5.1. Перечень контрольных вопросов для самоконтроля знаний.
1. Основные задачи кинетики. Понятие скорости.
2. Факторы, влияющие на скорость:
природа реагирующих веществ,
концентрация; закон действующих масс и его математическое выражение,
температура; понятие температурного коэффициента скорости реакции и энергии активации. Правило Вант – Гоффа, уравнение Аррениуса.
3. Молекулярность, порядок реакции и порядок по веществу. Методы определения порядка реакции.
4. Кинетические уравнения 0, I, II порядков. Период полупревращения и его связь с константой скорости реакции.
5.2. Задания для СРС во внеучебное время.
Задача № 1
Температурный коэффициент скорости реакции составляет 2,5. При увеличении температуры с 400С до 600С скорость реакции возрастет в
а) 5,0 раз
б) 6,25 раза
в) 11,25 раза
Задача №2
Исходная концентрация диэтилового эфира составляет 0,6 моль/л; константа скорости 0, 05с-. При уменьшении концентрации до 0,2 моль/л скорость реакции уменьшилась в
а) 3·10-2раза
б) 3 раза
в) 1·10-2раза
Задача № 3
Исходная концентрация активных единиц лекарственного препарата составляет 5·105ммоль/л. Через 960 часов концентрация снизилась до
2·105ммоль/л. Для данной реакции определить:
константу скорости (час-)
а) 9,55 ·10-4
б) 9,55
в) 9,55 ·10-2
2) порядок реакции
а) 1
б) 0
в) 2
3) период полупревращения
а) 72,6
б) 7,26
в) 726
Задача № 4
Константа скорости биохимического процесса при 200С равна 0,055 мин-, при 400С – 0,165 мин-. Энергия активации этого процесса равна
а) 41,5 кДж/моль
б) 4,2 кДж/моль
в) 41,5 Дж/моль
5.3. Задания для самоконтроля подготовки к практическому занятию
Вариант теста № 1
На скорость любого процесса оказывает влияние природа реагирующих веществ. Показателем, отражающим это влияние, является:
а) общий порядок реакции
б) константа диссоциации вещества
в) концентрация
Вариант теста № 2
Значение константы скорости реакции при увеличении концентрации реагирующих веществ:
а) увеличится
б) уменьшится
в) не изменится
Вариант теста № 3
Реакция гидролиза новокаина в организме человека протекает как реакция Ӏ порядка. Это означает, что:
а) скорость гидролиза прямо пропорциональна концентрации новокаина
б) скорость гидролиза не зависит от концентрации новокаина
в) скорость гидролиза прямо пропорциональна квадрату концентрации новокаина.
Вариант теста № 4
Единицы измерения константы скорости реакции л/моль·с. Порядок реакции:
а) первый
б) второй
в) нулевой.
Вариант теста № 5
Кинетические уравнения реакции 2А → В, имеющей константу скорости 0,018 с–1, имеют вид
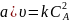 ;
;
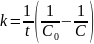
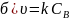 ;
;
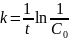
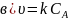 ;
;
6. Этапы проведения практического занятия.
№ п/п |
Название этапа |
Цель этапа |
Время (мин.) |
|
1 |
2 |
3 |
4 |
|
I. Вводная часть занятия |
10 |
|||
1. |
Организация занятия |
Мобилизация внимания студентов: проверка присутствующих, их внешнего вида, наличия рабочих тетрадей и лекций. |
3 |
|
2. |
Определение темы, мотивации, целей и задач занятия |
Формирование мотивации данного занятия, значимости его в подготовке врача и, как следствие, активизация познавательной деятельности студентов. |
7 |
|
II. Основная часть занятия |
160 |
|||
3. |
Контроль исходных знаний, умений, навыков (ЗУН) |
Выявление исходного уровня ЗУН. |
10 |
|
4. |
Общие и индивидуальные задания для СРС в учебное время |
Дифференцированное ориентирование студентов к предстоящей работе. |
20 |
|
5. |
Демонстрация методики лабораторной работы |
Разбор ориентировочной основы действия (ООД): изучение влияния различных факторов на скорость химической реакции, возможные ошибки эксперимента и их устранение, соблюдение правил ТБ в процессе работы. |
15 |
|
6. |
Управляемая СРС в учебное время |
Выполнение эксперимента. Овладение общепрофессиональными и универсальными компетенциями ОПК – 3, УК-1. |
75 |
|
7. |
Реализация лабораторной работы |
Расчётно – графическая работа; контроль результатов обучения и оценка с помощью дескрипторов. |
30 |
|
8. |
Итоговый контроль |
Оценивание индивидуальных достижений студента, выявление ошибок и их корректировка. |
10 |
|
III. Заключительная часть занятия |
10 |
|||
9. |
Подведение итогов занятия |
Оценка деятельности студентов и достижения цели занятия. |
8 |
|
10. |
Общие и индивидуальные задания для СРС во внеучебное время |
Указание по самоподготовке студентов к занятию «Контрольная работа №2». |
2 |
|
