
2 курс / Лекция 16. Трансляция, или биоснитез белка
.pdf
1
Лекция 16 (продолжение)
ТРАНСЛЯЦИЯ, ИЛИ БИОСИНТЕЗ БЕЛКА
Стадии:
1.Активация аминокислот (рекогниция)
2.Инициация белковой цепи
3.Элонгация
4.Терминация
1. Активация аминокислот, или рекогниция.
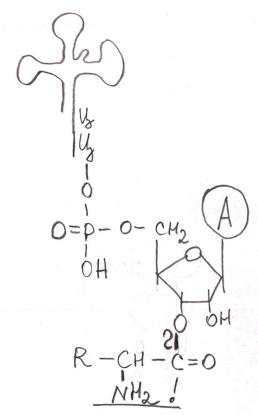
Образуются аминоацил-тРНК, т.е. аминокислота (АК) должна присоединиться к переносящей её тРНК через карбоксильную группу.
Процесс активации идёт под действием фермента аминоацил-тРНК-
синтетазы.
аминоацил-тРНК-синтетаза АК + тРНК + АТФ  Аминоацил-тРНК + АМФ + ФФн.
Аминоацил-тРНК + АМФ + ФФн.
с образованием ковалентной связи через карбоксильную группу АК
Общее количество кодирующих кодонов – 61. Но в клетке их будет меньше,
поскольку аминокислоты, кодируемые несколькими кодонами, в организме,
как правило, кодируются не всеми возможными, а лишь «любимыми» для каждого организма.

2
Е – фермент (энзим) –
аминоацил-тРНК-синтетаза
Что означает аминоацил? – От аминокислоты остаётся лишь остаток.
Аминоациладенилаты – активированная форма аминокислот.
Соединения очень реакционно-способные и в свободном виде в клетке не встречаются, всегда находятся только в комплексе с ферментами.
Далее активированная аминокислота переносится на тРНК.
3
|
У каждой тРНК своя аминоацил- |
|
-тРНК-синтетаза. Этот фермент |
|
играет важную роль в процессе |
|
биосинтеза белков. В биологическом |
|
плане именно этот фермент осуществляет |
|
перевод нуклеотидного текста |
|
на аминокислотный язык. Они |
|
подбирают аминокислоты к тРНК. |
|
Аминоацил-тРНК-синтетазы |
|
имеют три активных центра: |
|
1.узнавания радикалов |
|
аминокислот, |
|
2.узнавания тРНК, |
аминоацил-тРНК |
3.связывания АТФ. |
с образованием ковалентной связи через карбоксильную группу АК аминогруппа остается свободной
Ошибки этих ферментов далее нигде в процессе трансляции не исправляются.
Далее остальные 3 стадии идут на рибосомах – это своеобразные молекулярные машины, функционирующие в цитоплазме и осуществляющие биосинтез белковых макромолекул. Рибосомы удерживают в рабочем состоянии многокомпонентную белоксинтезирующую систему, а также обеспечивают точность считывания и реализации генетической информации.
Они обладают каталитическими свойствами, образуя пептидную связь, а
также выполняют функцию механического переноса пептидил-тРНК.

4
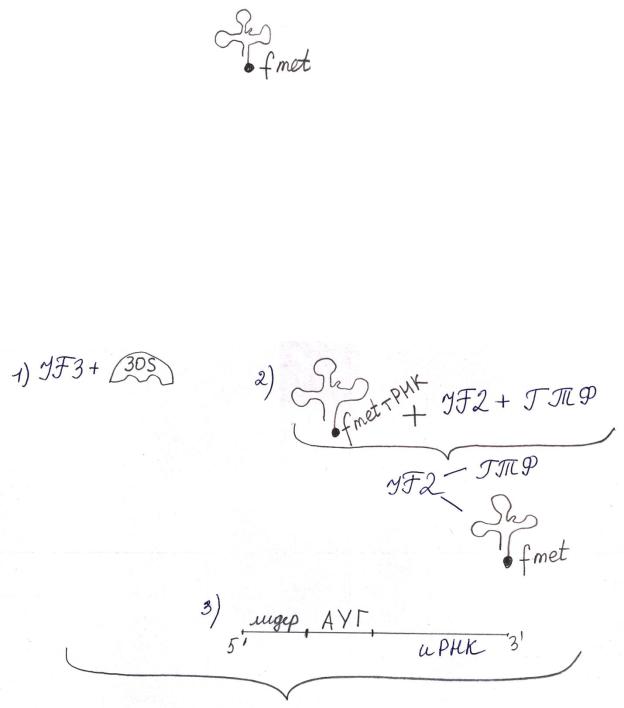
2 Инициация белковой цепи.
Задача – собрать транслирующую рибосому. Компоненты системы должны очень точно присоединиться (с точностью до одного нуклеотида),
чтобы не произошло сдвига рамки считывания.
Требуется: (на примере прокариот):
1.Рибосомы
2.иРНК
Лидер, или инициирующая область,
взаимодействует с 3`-концом
16S рРНК (малой субъединицы)
5
Стартовый кодон отвечает за точное связывание. Если происходит сдвиг рамки считывания, то образуется бессмысленный белок
3. Формилметионил-тРНК Это не та тРНК, которая кодирует метионин в составе белка, а та, у
которой антикодон комплементарен стартовому кодону АУГ.
.
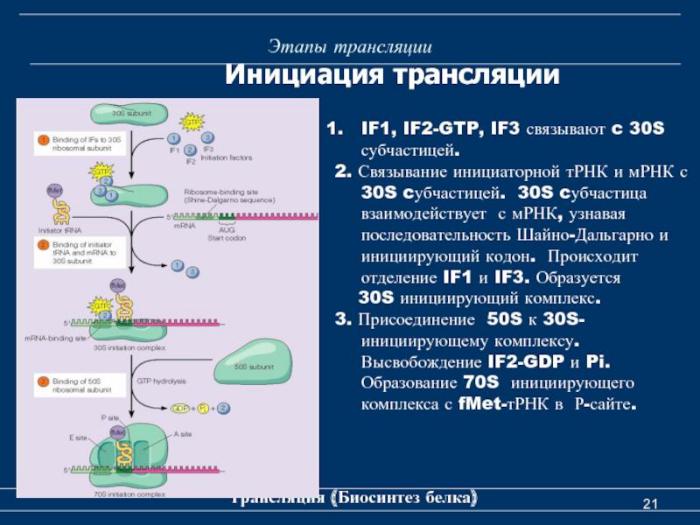
4.Белковые факторы инициации IF1, IF2, IF3.
5.Источник энергии – ГТФ. (Обращаем Ваше внимание на то, что в процессе трансляции используются не АТФ, а ГТФ).
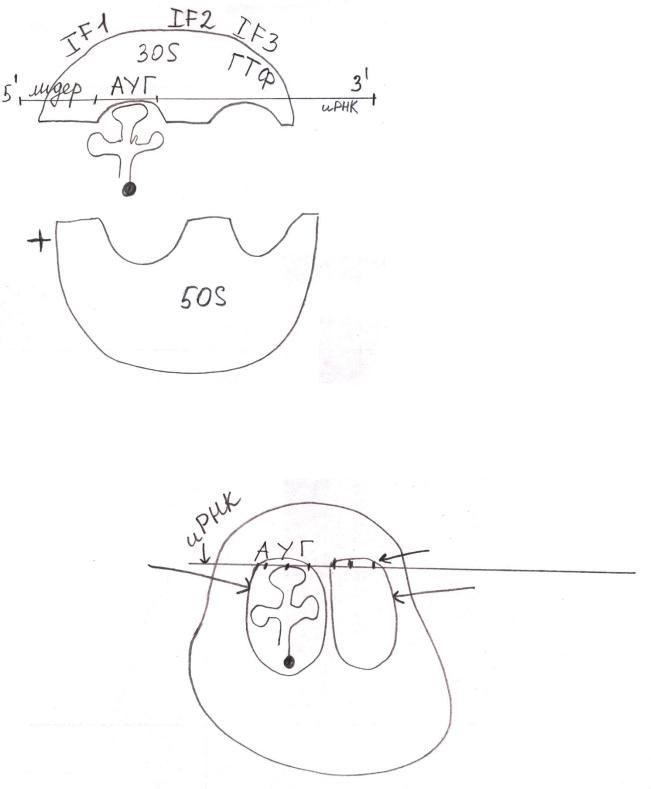
Сборка транслирующей рибосомы.
Лидер взаимодействует с 3`-концом
6
16 S рРНК рибосомы.
Это первое контролирующее положение.
Присоединяется формилметионил-
тРНК, у которой антикодон комплементарен стартовому кодону АУГ. Это вторая контролирующая система.
В этом состоит биологическая роль формилметионил-тРНК.
Это обеспечивает присоединение
иРНК с точностью до одного
нуклеотида (во избежание
сдвига рамки считывания).
Пептидильный |
первый значащий кодон |
центр |
аминоацильный центр |
Это транслирующая рибосома.
Факторы инициации и ГТФ выделяются.
7
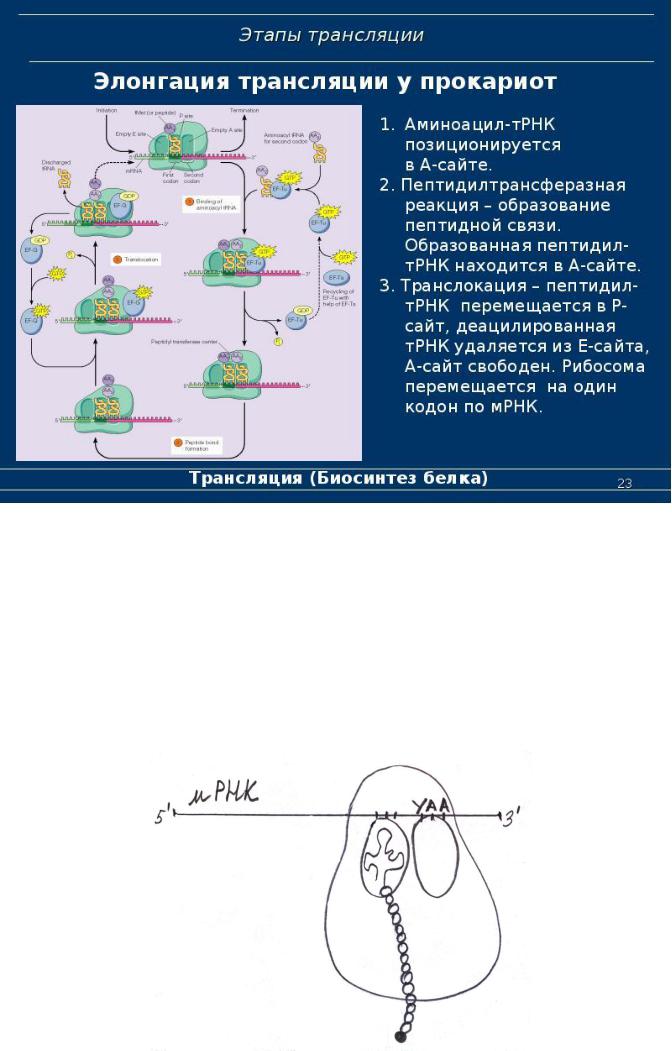
2. Элонгация белковой цепи (самая длинная стадия)
А) узнавание кодона (следующего).
Продолжение процесса требует присоединения второй аминоацил-
тРНК (уже не формилметионил-тРНК), определяемой следующим кодоном иРНК, движущейся 5`-концом вперёд. Эта аминоацил-тРНК присоединяется к аминоацильному центру. Требуется фактор элонгации EF1 (EF-Tu) и ГТФ.
Кружочек (аминокислота) на рисунке будет прозрачным,
заштрихованным кружком обозначали только формилметионил!
EF1 активирует ГТФ и тРНК. Энергия тратится на присоединение аминоацил-тРНК.
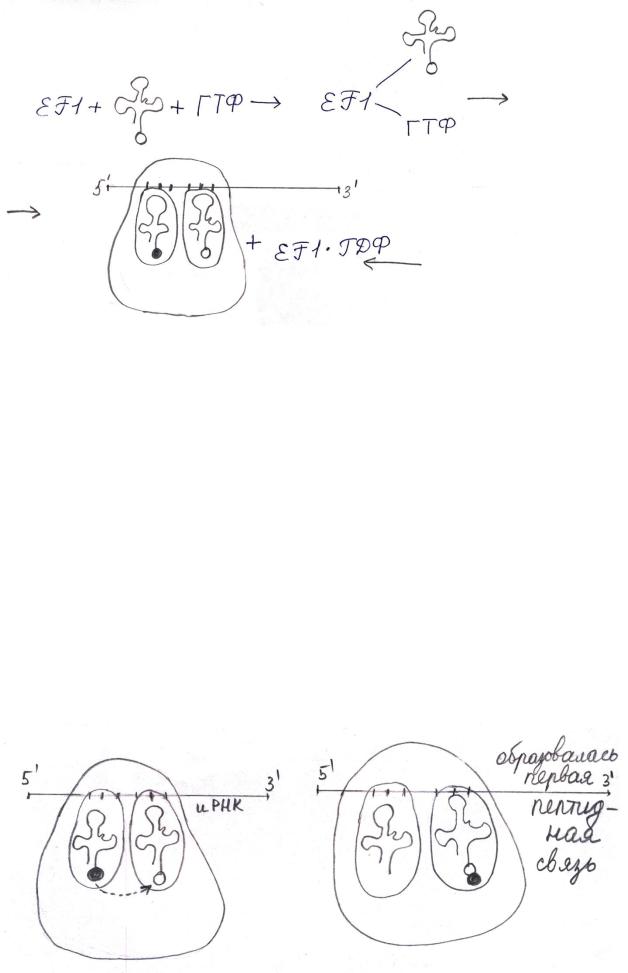
8
Это неактивная форма
(комплекс)
EF1·ГДФ реактивируется с помощью фактора элонгации EF2, или EFTs. Сначала EF-Ts замещает ГДФ в неактивном комплексе EF1-ГДФ.
Образуется комплекс EF-Tu·EF-Ts. Этот комплекс взаимодействует с ГТФ и образуется EF-Tu·ГТФ – активный комплекс.
Б) образование пептидной связи.
Впептидилтрансферазном центре, расположенном на 50S
субъединице, происходит перенос формилметионина на NH2-группу второй аминоацил-тРНК. Это реакция транспептидирования и она осуществляется при помощи фермента транспептидазы. Реакция осуществляется за счёт активности самих рибосомальных белков и не требует белковых факторов. В
аминоацильном центре образуется дипептидил-тРНК.
Дипептидил-тРНК
пептидилтрансферазный центр (стрелка).
9
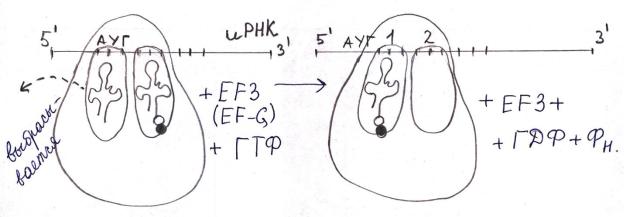
В) Транслокация
В результате транслокации рибосома передвигается вдоль иРНК на 1
кодон. При этом дипептидил-тРНК попадает в пептидильный участок, а
аминоацильный освобождается. Требуется фактор элонгации EF3 (или EF- G)
и ГТФ.
Пустая тРНК будет выброшена, вместо неё в пептидильном участке будет находится дипептидил-тРНК.
После реакции транспептидирования формилметионил всегда будет последним.
Далее начинается следующий акт элонгации и все повторяется, и так далее.
3. Терминация
Сигналом терминации являются нонсенс-кодоны УГА УАА УАГ.
Как только в аминоацильном центре в результате очередной транслокации оказывается терминирующий кодон, к нему присоединяются факторы терминации RF1 и RF2 (рилизинг-фактор, releasing), а также включаются в процесс фактор RRF (фактор рециклизации рибосом и ГТФ.
