
2 курс / Лекция 11. Структура ферментов
.pdf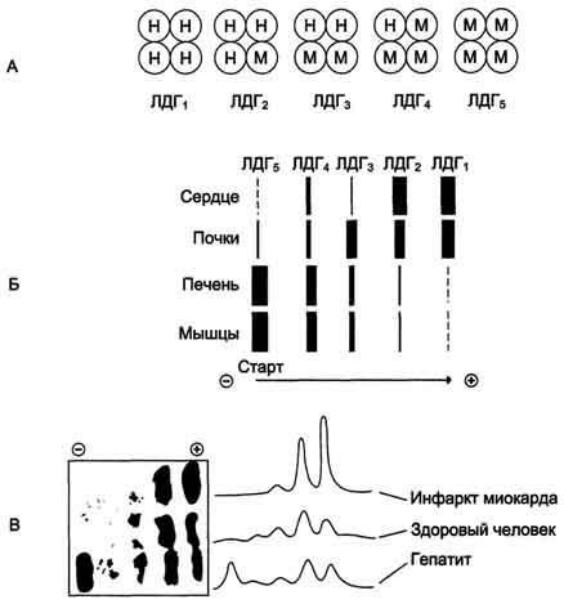
11
Изоферменты являются маркерами, позволяющими изучать онтогенез и дифференциальную активность генов. При дифференцировке клеток появляются новые виды изоферментов. Наличие изоферментов позволяет клеткам более тонко регулировать обмен веществ. Например, субъединицы типов Н встречаются в сердце и обладают слабым сродством к пирувату.
Мультиферменты.
Это крупные комплексы ферментов, катализирующих разные реакции. В
мультиферментах субстрат подвергается превращению, не покидая мультиферментного комплекса, и отсутствует стадия диффузии от одного
12
фермента к другому. Мультиферментные комплексы состоят из нескольких видов ферментов. Классическим примером является пируватдегидрогеназный комплекс.
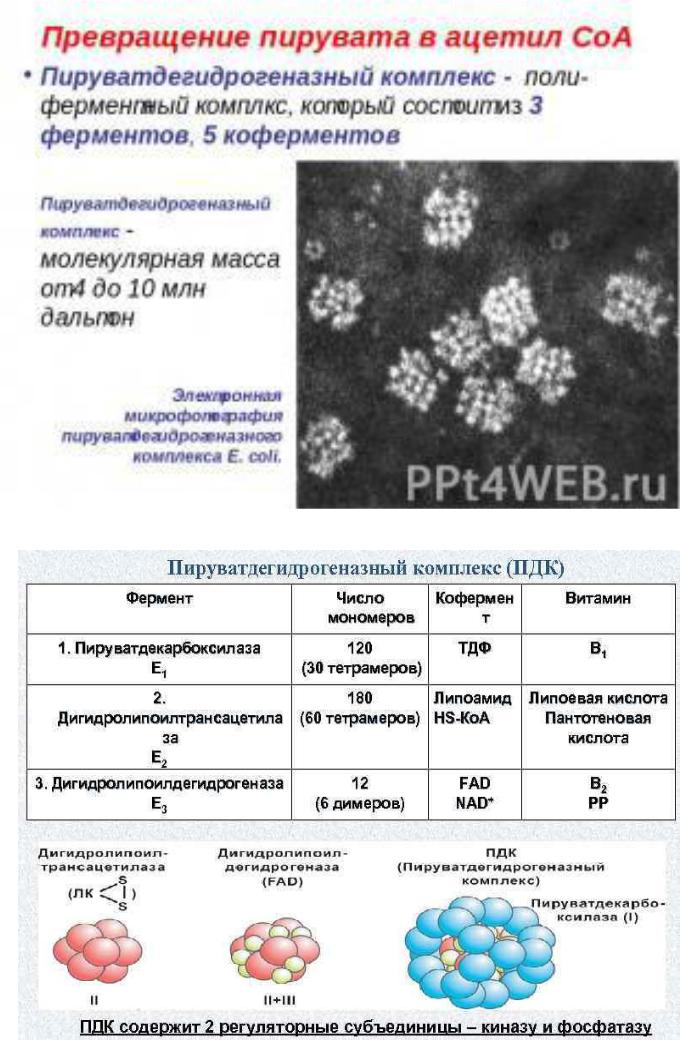
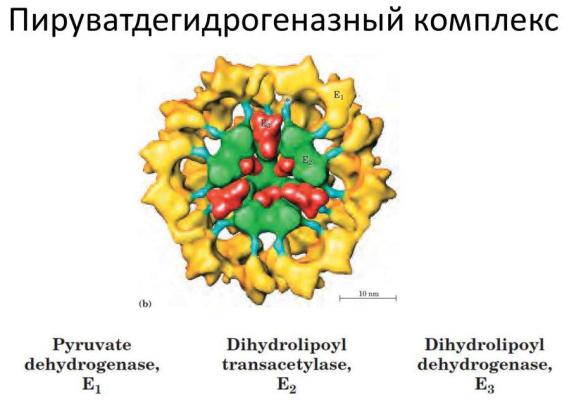
У E.coli он имеет молекулярную массу ~4000000 и виден под электронным микроскопом. Катализирует 3 разных реакции. Состоит из пируватдекарбоксилазы (12 молекул, кофермент тиамин пирофосфат, или витамин В1); дегидролипоилтрансацетилазы (24 молекулы, каждая из которых содержит остаток липоевой кислоты) и дегидролипоилдегидрогеназы (12
молекул, кофермент - ФАД). Таким образом, в комплекс в качестве коферментов входят: тиаминпирофосфат, НАД, ФАД, липоевая кислота и SH-кофермент А.
14
Зимогены
Зимогены – это ферменты, которые вырабатываются в неактивной форме и активируются по месту действия. Это опасные ферменты, вызывающие гидролиз белков (если бы они вырабатывались в самой клетке, то происходил бы автолиз).
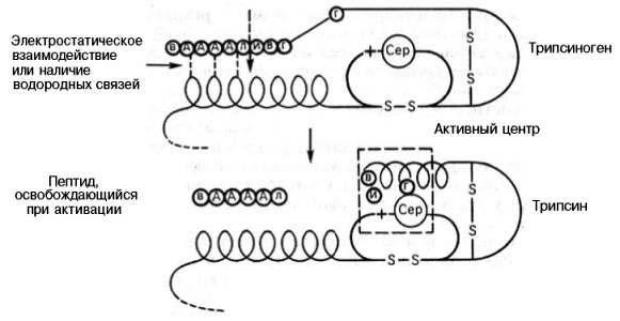
Трипсин синтезируется в поджелудочной железе в форме неактивного предшественника - трипсиногена. Трипсиноген состоит из 1 полипептидной цепи,
содержащей 249 аминокислотных остатков. Он активируется в полости кишечника ферментом энтеропептидазой при участии ионов кальция, а также способен к аутокатализу. Происходит отщепление гексапептида от трипсиногена,
в результате чего формируется активный центр и образуется трехмерная структура трипсина.
15
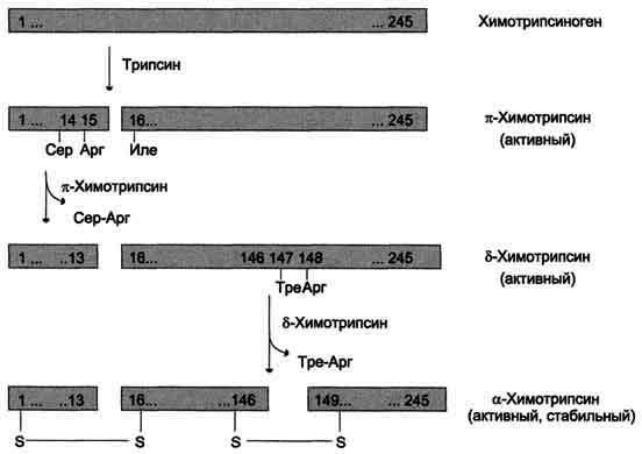
Химотрипсин синтезируется в поджелудочной железе в форме неактивного предшественника - химотрипсиногена. Химотрипсиноген состоит из 1
полипептидной цепи, а потом активный центр его достраивается. Он активируется активным трипсином и путем аутокатализа. Перестройка происходит в 3 этапа:
1.Трипсин расщепляет цепь химотрипсиногена между 15 и 16
аминокислотными остатками, в результате чего получается форма π-
химотрипсин, который активен, но не устойчив.
2.Химотрипсин отщепляет 14 и 15 аминокислотные остатки, в результате чего получается форма σ –химотрипсин.
3.Отщепляется дипептид – 148 и 149 аминокислотные остатки, в результате чего получается форма α химотрипсин.
16
Молекула α химотрипсина состоит из трех полипептидных цепей,
удерживаемых 5 дисульфидными связями.
Пепсин образуется из пепсиногена, который содержит 363 аминокислотных остатка, от которого отщепляется 42.
