
2 курс / Лекция 11. Структура ферментов
.pdf1
Лекция 11
СТРУКТУРА ФЕРМЕНТОВ
Ферменты, или энзимы, – это катализаторы белковой природы,
образующиеся и функционирующие во всех живых организмах (фермент от лат. fermentum – закваска; энзим от греч. эн – в, внутри, зиме – закваска).
Ферменты являются важнейшими компонентами клетки, они теснейшим образом связаны с разнообразными процессами жизнедеятельности.
Совокупность биохимических реакций, катализируемых ферментами, составляет сущность обмена веществ, являющегося отличительной чертой всех живых организмов. Через ферментативный аппарат, регуляцию его активности происходит и регуляция скорости метаболических реакций, и их направленности.
Являясь катализаторами – веществами, ускоряющими реакции, ферменты имеют ряд общих свойств с химическими, небиологическими катализаторами.
1.Ферменты не входят в состав конечных продуктов реакции и выходят из реакции в первоначальном виде. Они не расходуются в процессе катализа.
2.Ферменты не могут возбудить реакций, противоречащих законам термодинамики, они ускоряют только те реакции, которые могут протекать и без них.
3.Ферменты, как правила, не смещают положения равновесия реакции, а лишь ускоряют его достижение.
Для ферментов характерны и специфические свойства, отличающие их от
химических катализаторов, выражающих их биологическую природу.
1.По химическому строению молекулы все ферменты являются
белками.
2.Эффективность ферментов выше на несколько порядков, чем эффективность небиологических катализаторов.
3.Ферменты обладают узкой специфичностью, избирательностью действия на субстраты, т.е. вещества, превращение которых они катализируют.

2
4.Регулируемость. Через регуляцию ферментативного аппарата осуществляется скоординированность всех метаболических процессов во времени
ипространстве, направленная на воспроизведение живой материи, поддержание постоянства внутриклеточной среды, на приспособление к меняющимся внешним условиям.
5.Почти 100%-й выход продуктов реакции. Побочные процессы наблюдаются лишь незначительно.
Структура ферментов
Ферменты являются белками
Простые белки - состоят только из |
Сложные белки - в состав входит |
белковой части |
также небелковая часть |
↓ |
↓ |
Однокомпонентные ферменты: |
Двукомпонентные ферменты. |
существует очень много таких |
Называются холоферментами. |
ферментов. К ним относится |
Белковая часть фермента - |
рибонуклеаза, лизоцим, |
апофермент. Небелковый компонент |
протеолитические ферменты (пепсин, |
может называться коферментом или |
трипсин, химотрипсин). |
простетической группой. Название |
|
небелковой части зависит от |
|
прочности ее связывания с белковой |
|
частью. Связь кофермента с белковой |
|
частью обычно не стойкая и |
|
кофермент легко отделяется от белка |
|
и может быть устранен, например, |
|
диализом. К коферментам относятся |
|
НАД+ и НАДФ. |
Роль активных групп выполняют |
Простетическая группа прочно |
определенные аминокислотные |
связана с белковой частью. |
радикалы |
Например, геминовая группа |
|
цитохрома. Она связывается с |
|
белковой частью с помощью |
|
дисульфидной связи. |
|
Очень часто у двукомпонентных |
|
ферментов одна группа входит в |
|
состав разных ферментов, |
|
действующих на разные субстраты. В |
|
этом случае специфичность действия |
|
определяется апоферментом. |
3
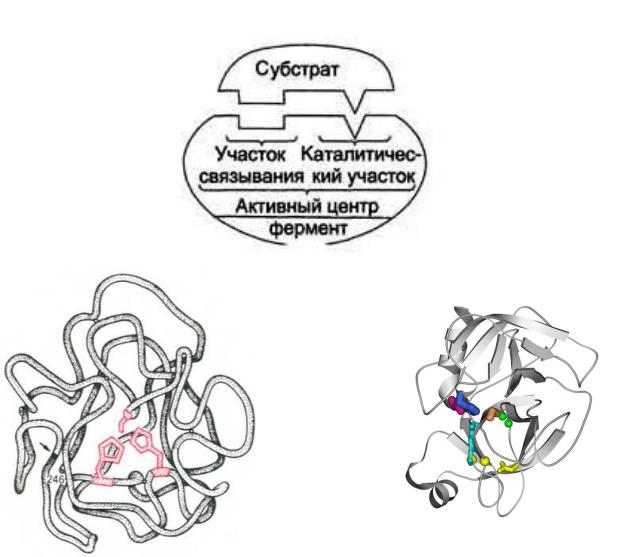
Активный центр
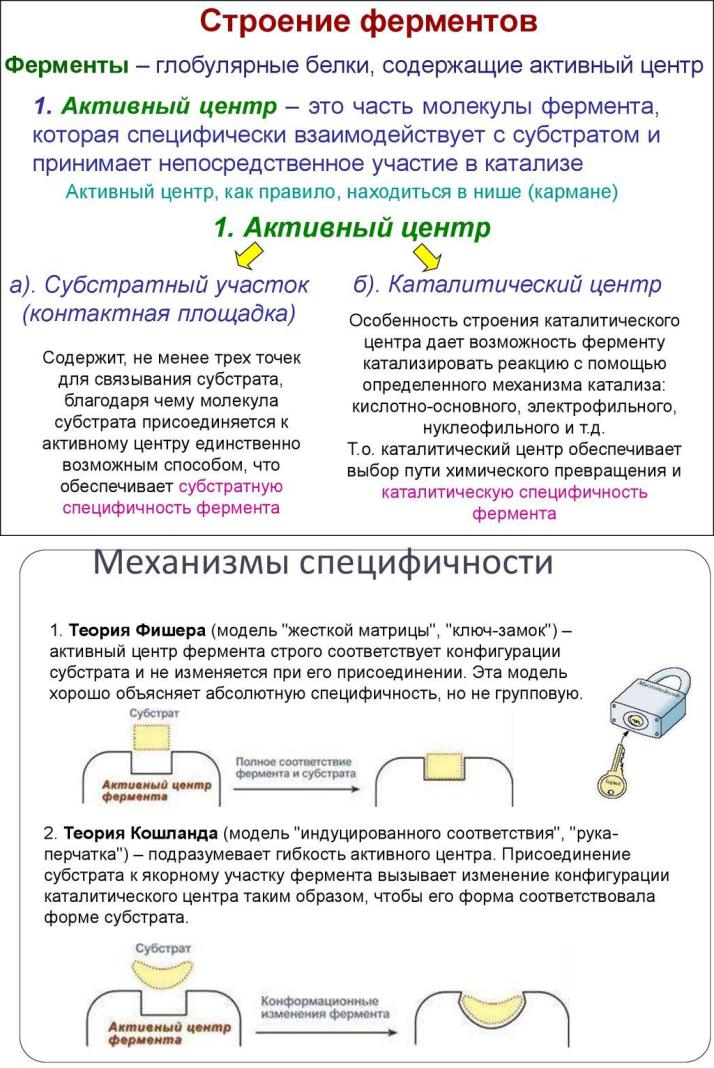
Это область молекулы, в которой происходит связывание и превращение субстрата. Образован остатками аминокислот, входящих в состав разных участков полипептидной цепи или различных полипептидных цепей, ранее пространственно достаточно удаленных и сближающихся при образовании третичной структуры белка-фермента.
Таким образом, активный центр образуется только при формировании третичной структуры.
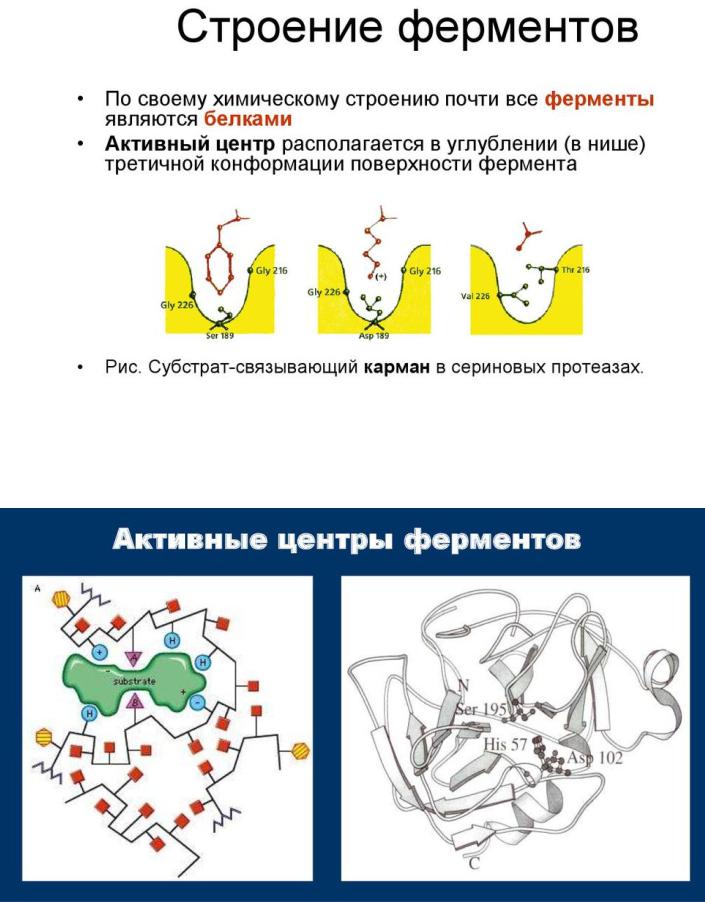
В структуре активного центра различают адсорбционный и каталитический участки. Очень часто активный центр помещается в стандартном дефекте, то есть в стандартно расположенной определенной укладкой полипептидной цепи вмятине в архитектуре белковой молекулы. Это автоматически способствует определению субстрата одновременно многими боковыми цепями белка. Часто активный центр окружен большим количеством гидрофобных аминокислотных остатков.
4
Активный центр формируется из отдельных аминокислот, содержащих разные функциональные группы. К каталитически активным радикалам относятся имидазол гистидина, оксигруппа серина или тирозина, сульфгидрильная группа цистеина, аминогруппа лизина, ионизированные карбоксильные группы аспарагиновой и глутаминовой кислот.
Каталитический участок - это область активного центра, которая непосредственно участвует в химических преобразованиях субстрата. Он формируется несколькими, а чаще тремя радикалами аминокислот. Например,
каталитический центр серин-гистидиновых протеаз.
Если фермент является сложным белком, то в формировании каталитического участка принимают участие кофермент или простетическая группа.
Адсорбционный участок - это участок активного центра, на котором происходит связывание молекулы субстрата. Обычно находится рядом с каталитическим участком. Его главная функция - связывание молекулы субстрата
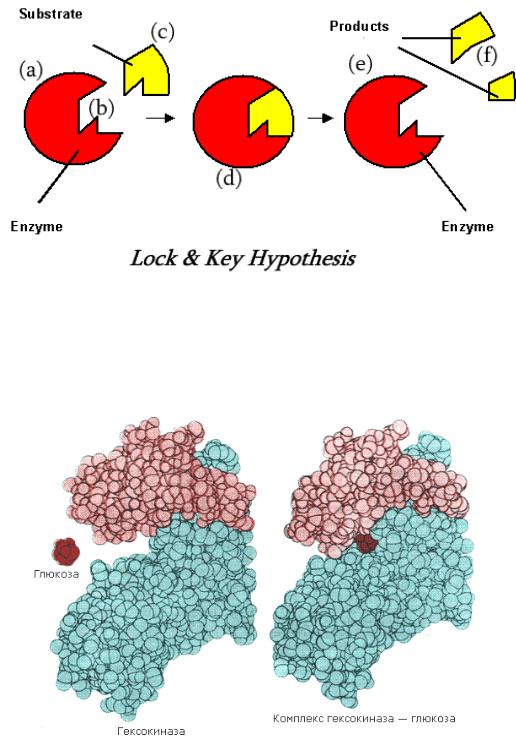
ипередача этой молекулы в наиболее удобном положении. Связывание происходит только за счет слабых типов связей и является обратимым. По мере формирования этих связей происходит конформационная перестройка адсорбционного участка, которая приводит к более тесному сближению субстрата
иактивного центра фермента и более точному соответствию их пространственных конфигураций. Это соответствие было положено в основу
теории индуцированного соответствия, предложенной американским ученым
Кошландом (рис.2). Теория Кошланда заменила теорию Фишера «ключа и замка», по которой субстрат и фермент жестко соответствуют друг другу (рис. 1).
5
Рис. 1.
Рис. 2.
7

8
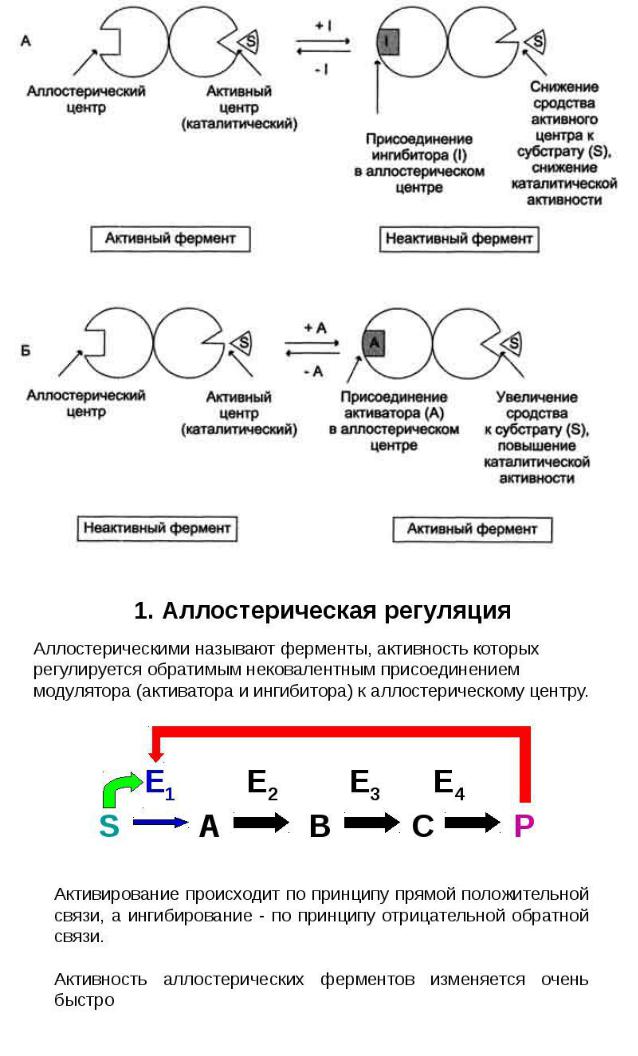
Аллостерический центр.
Как выяснилось, многие ферменты, кроме активного центра, имеют аллостерический центр. К нему присоединяются низкомолекулярные вещества -
лиганды - при этом конформация ферментов изменяется и, как следствие,
изменяется его активность. Эти низкомолекулярные вещества называются
эффекторами. Фермент при присоединении эффектора может активироваться или инактивироваться. Если фермент при присоединении эффектора инактивируется, то это аллостерическое ингибирование, а эффектор -
аллостерический ингибитор.
Аллостерические эффекторы широко используются в регуляции обменных процессов, а ферменты, имеющие аллостерические центры, называются регуляторными ферментами. Наиболее часто аллостерические ферменты участвуют в регуляции последовательных превращений:
E1 |
E2 E3 |
En |
A → B → C → D… → … P
9

10
Продукт P является аллостерическим ингибитором E1.
Такой вид ингибирования называется ингибирование по типу обратной
связи, или ретроингибирование: Е1 - регуляторный фермент.
Ретроингибирование широко распространено и используется для регуляции основных метаболических процессов.
Аллостерические центры найдены у тех ферментов, работа которых может изменяться под действием гормонов, медиаторов и других биологически активных веществ. Существуют искусственно синтезированные лекарства,
обладающие биологической активностью потому, что их молекулы комплементарны аллостерическому центру некоторых ферментов организма.
Изоферменты.
Это ферменты с одинаковым действием, но кодируемые разными
локусами однго и того же хромосомного (гаплоидного) набора. Такие локусы возникли в результате дупликации генов и последующего изменения последовательностей нуклеотидов в генах. Таким образом, у одной особи может иметься несколько вариантов одного фермента.
Изоферменты имеют одинаковый механизм действия и катализируют одинаковые реакции, но отличаются по ряду физико-химических свойств.
Наиболее изучены ферменты лактатдегидрогеназы.
Фермент существует в виде тетрамера. В организме синтезируются субъединицы двух типов: М и Н.
В тканях представлены все пять форм изомеров, но разные ткани различаются по преобладанию различных форм. В сердце Н4, Н3М. В мышцах
М4, М3Н.
