
2 курс / Лекция 12. Механизм действия ферментов. Классификация
.pdf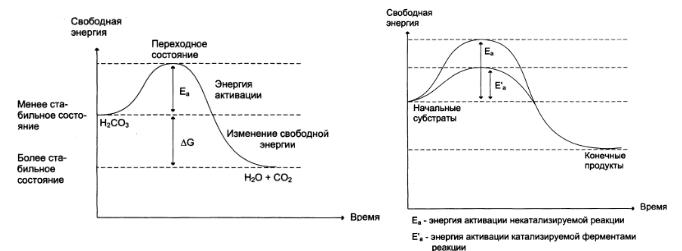
Лекция 12
Механизм действия ферментов.
Любые химические реакции протекают, подчиняясь основным законам термодинамики. График изменения свободной энергии (Е) при разложении угольной кислоты (рис. 1а):
а |
б |
|
|
|
|
Рис.1. а) Изменение свободной энергии при разложении угольной кислоты; б) изменение свободной энергии в ходе химической реакции, некатализируемой и катализируемой ферментами. Фермент понижает энергию активации Еа, т.е. снижает высоту энергетического барьера, в результате возрастает доля реакционно-способных молекул, следовательно, увеличивается скорость реакции.
Реакция разложения угольной кислоты пойдет, если ее молекула имеет энергию превышающею определенный уровень, называемый энергией активации
(Еа).
Энергией активации называют дополнительное количество кинетической энергии необходимое молекулам, чтобы они вступили в реакцию. При достижении этого энергетического барьера в молекуле происходят изменения, вызывающие перераспределение химических связей и образование новых соединений (рис.1б).
Молекулы, обладающие Еа, находятся в переходном состоянии.
Разница энергии угольной кислоты Н3СО3 и СО2 и Н2О называется изменением свободной энергии реакции. СО2 и Н2О более стабильные вещества и в обычных условиях практически не реагируют, выделяющаяся энергия рассеивается в виде тепла.
Чем больше молекул обладает энергией активации, тем больше скорость реакции. Увеличить скорость реакции можно нагреванием, но для клеток это губительно.
Ферменты обеспечивают высокие скорости реакций, снижая энергию активации в результате превращения идут при температуре 37°С, при нормальном атмосферном давлении и физиологических значения рН.
1
Таким образом, ферменты не изменяют свободную энергию субстратов, продуктов и не меняют равновесие реакции.
Этапы ферментативного катализа
Формирование фермент-субстратного комплекса (ES).
Тот факт, что ферменты обладают высокой специфичностью позволил Фишеру в 1890 г. выдвинуть теорию «ключа и замка», согласно которой активный центр фермента комплементарен субстрату.
После взаимодействия субстрата (ключ) с ферментом (замок) происходят химические превращения. Активный центр рассматривается при этом как стабильная, жесткая структура. Но эксперименты показали, что активный центр является по отношению к субстрату гибкой структурой.
В1959 г. Кошландом была предложена другая теория, согласно которой субстрат взаимодействует с ферментом, изменяет конформацию его активного центра, приводя к образованию фермент-субстратного комплекса. При этом молекула субстрата также изменяется, что обеспечивает высокую эффективность ферментативной реакции.
Эта гипотеза индуцированного соответствия, подтверждена экспериментально.
Роль активного центра в ферментативном катализе.
Так как молекула фермента во много раз больше чем молекула субстрата, в контакт с субстратом вступает лишь небольшая часть молекулы фермента, обычно от 5 до 10 аминокислот, формирующих активный центр. Роль остальных аминокислот состоит в создании правильной конформации фермента.
Активный центра на всех этапах ферментативного катализа нельзя рассматривать как пассивный участок для связывания субстрата. Это комплексная молекулярная «машина» использующая разнообразные химические механизмы, способствующие превращению субстрата в продукт.
Вактивном центре субстраты располагаются таким образом, чтобы функциональные группы находились в непосредственной близости друг к другу. Это свойство называется эффектом сближения и ориентации (см. ниже) что вызывает снижение энергии активации.
Активный центра способствует дестабилизации связей в субстрате –
эффект деформации фермента (эффект напряженной конфигурации).
Последовательность событий в ходе ферментативного катализа.
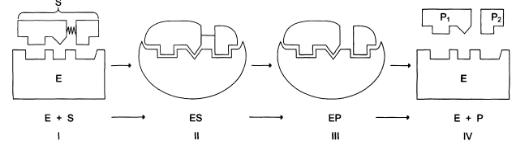
Процесс ферментативного катализа делится на 4 этапа (рис.2).
Рис. 2. Этапы ферментативного катализа.
2
I этап. Этап сближения и ориентации субстрата (S) и фермента (Е). Связывание как min в трех точках.
II этап. Образование фермент-субстратного комплекса (ES) в результате наблюдается индуцированное соответствие (гипотеза Кошланда) при этом суммируется изменения конформационной структуры Е структуры S. Фермент переходит в напряженное состояние, соответствующее переходному состоянию.
III этап. Деформация субстрата и образование нестабильного комплекса
ЕР.
IV этап. Распад комплекса ЕР и выделение продуктов реакции из свободного Е.
Первый, второй и четвертый этапы катализа непродолжительны и зависят от концентрации субстрата (для первого этапа) и констант связывания лигандов в активном центре фермента (для первого и третьего этапов). Изменения энергетики химической реакции на этих стадиях незначительны.
Третий этап наиболее медленный; длительность его зависит от энергии активации химической реакции. На этой стадии происходят разрыв связей в молекуле субстрата, образование новых связей и формирование молекулы продукта.
Эффекты ферментативного катализа.
1)Эффект сближения и ориентации. Скорость каталитического процесса зависит от концентрации реагентов. В неферментативных реакциях концентрация обычно ~ 1 моль. В ферментативных реакциях концентрация реагентов значительно ниже, следовательно, ниже вероятность сталкивания молекул 2-х субстратов, еще меньше 3-х субстратов. Без фермента эти вероятности ограничиваются только концентрациями, следовательно, в ферментных реакциях столкновения оказываются значительно более эффективны. Кошланд указал на 2 причины, по которым столкновение молекул субстрата на поверхности фермента более эффективны.
а) Эффект сближения: молекулы 2-х субстратов связанные с одной и той же молекулой ферментов попадают в непосредственную близость друг от друга; в результате вероятность их взаимодействия повышается, эффект сближения равнозначен повышению локальной концентрации субстрата.
б) Эффект ориентации: при связывании на поверхности фермента, субстрат определенным образом ориентируется и принимает положение
необходимое для их взаимодействия.
Эффект сближения и ориентации повышает скорость превращения в 103 раз,
аесли предположить, что присоединяются 2 субстрата к ферменту идет не в 2, а в
3-х точках, то есть участвуют 3 функциональные группировки активного центра фермента; скорость может быть выше до 108 раз.
2)Эффект деформации фермента. Согласно гипотезе вынужденного индуцированного контакта каталитически активная конформация активного центра возникает в момент присоединения фермента и субстрата. В результате
3

деформирующего воздействия субстрата по этой гипотезе активный центр – гибкая структура по отношению к субстрату. Такое взаимодействие обеспечивает повышение эффективности ферментативной реакции.
3) Эффект напряженной конфигурации – эффект деформации субстрата связан с образованием и расщеплением ковалентных связей. Предполагаемая модификация молекул субстрата, которая приводит к изменению прочности связи ферментов. Обуславливается это уменьшение изменением электронной плотности, а также связыванием субстрата в напряженной конформации, следовательно, связь легко разрывается. Такое изменение названо эффектом «дыбы».
Эффект «дыбы» хорошо объясняет действия гидролаз, лиаз, трансфераз. В связи с этим созданы структурные аналоги субстратов, нормальные конформации, которые соответствуют напряженной конформации субстрата, а значит, они могут служить эффективными конкурентными ингибиторами ферментов.
4
Типы ферментативного катализа.
Врезультате образования комплекса происходит обмен электронами и протонами между ферментом и субстратом. Если фермент отдает электронную пару субстрату, т.е. если фермент является донором электронов, осуществляющим нуклеофильную атаку, которая определяет скорость ферментативной реакции, то имеет место нуклеофильный катализ. Скорость каталитической реакции определяется электронодонорной способностью нуклеофила, т.е. тех аминокислотных остатков активного центра, которые взаимодействуют с субстратом.
Вэлектрофильном катализе, напротив, фермент акцептирует пару электронов от субстрата. Электрофильный катализ характерен для многих ферментов, имеющих в своем составе атомы металлов. Металлы с переменной валентностью являются электрофильными катализаторами, принимающими электронную пару.
Впроцессе общего кислотно-основного катализа происходит перенос протона либо в пределах молекулы субстрата, либо от одного субстрата к другому. Следует отметить, что многие электроили нуклеофильные реакции протекают более эффективно, если они сопровождаются одновременным переносом протона на субстрат.
5
Классификация ферментов
Каждый фермент имеет 2 названия. Первое – короткое, так называемое рабочее, удобное для повседневного использования. Второе (более полное) – систематическое, применяемое для однозначной идентификации фермента.
А. Рабочее название
В названии большинства ферментов содержится суффикс «аза», присоединённый к названию субстрата реакции, например уреаза, сахараза, липаза, нуклеаза или к названию химического превращения определённого субстрата, например лактатдегидрогеназа, аденилатциклаза, фосфо-глюкомутаза, пируваткарбоксилаза. Согласно российской классификации ферментов (КФ), названия ферментов пишутся слитно. Однако в употреблении сохранился ряд тривиальных, исторически закреплённых названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения, например трипсин, пепсин, ренин, тромбин.
Б. Классы ферментов
Международный союз биохимии и молекулярной биологии в 1961 г. разработал систематическую номенклатуру, согласно которой все ферменты разбиты на 6 основных классов в зависимости от типа катализируемой химической реакции. Каждый класс состоит из многочисленных подклассов и подподклассов с учётом преобразуемой химической группы субстрата, донора и акцептора преобразуемых группировок, наличия дополнительных молекул и т.д. Каждый из 6 классов имеет свой порядковый номер, строго закреплённый за ним.
Был разработан также принцип нумерации ферментов, вошедший в систему классификации. Шифр каждого фермента содержит четыре числа и составляется следующим образом:
первое число указывает, к какому из шести классов принадлежит тот или иной фермент;
второе число обозначает подкласс. У оксидоредуктаз, например, оно указывает природу группы, которая подвергается окислению, у трансфераз
– природу транспортируемой группы и т.д.;
третье число обозначает подподкласс. У гидролаз, например оно, указывает на тип гидродлизуемой связи, у трансфераз – тип транспортируемой группы;
четвертое число обозначает порядковый номер фермента в данном классе.
Оксидоредуктазы. Они представляют самый большой класс ферментов. Названия их составляют по форме: «донор: акцептор – оксидоредуктаза». Они играют основополагающую роль в процессах биологического окисления. Коферменты НАД или НАДФ являются акцепторами водорода, ферменты, катализирующие перенос водорода, называются дегидрогеназами, переносящие кислород к субстрату – оксидоредуктазами. Пероксидазами называют ферменты, использующие в качестве акцептора водорода Н2О2. Оксидоредуктазы подразделяют на подклассы по критерию окисления тех или иных группировок, в частности от природы доноров водорода. Некоторые подклассы этих ферментов.
6
Подкласс 1.1. В него входят ферменты, действующие на СН – ОН-группу доноров (малатдегидрогеназа, алкоголдегидрогеназа и др.).
Подкласс 1.2. В него входят ферменты, окисляющие альдегидные или кетоновые группировки.
Подкласс 1.6. Ферменты этого подкласса отличаются тем, донором водорода для них является восстановленные НАД или НАДФ.
Всего класс оксидоредуктаз содержит 17 подклассов.
Трансферазы. Ферменты этого класса осуществляют перенос групп атомов. Их названия включают в себя такие понятия, как: «донор: акцептор – транспортируемая группа – трансфераза». Эти ферменты разделены на подклассы, катализирующие перенос углеродных остатков.
Подкласс 2.1. Ферменты этого подкласса переносят одноуглеродные метильные, формильные, карбоксильные и другие остатки (метилтрансфераза, формилтрансфераза).
Подкласс 2.2. Ферменты этого подкласса осуществляют перенос альдегидных и кетоновых двух или трех углеродных остатков (транскетолаза, трансальдолаза). Трансферазы играют существенную роль в процессах взаимопревращения многих веществ, а также в реакциях дезинтоксикации.
Класс трансфераз имеет всего 8 подклассов.
Гидролазы. Эти ферменты катализируют расщепление внутримолекулярных связей при помощи молекул воды. Их названия состоят из двух частей: субстрат – гидролаза.
Подкласс 3.1. В него включены ферменты, обладающие широкой специфичностью. Они катализируют гидролиз эфирных связей большого количества эфиров. В частности, тиолэстераза катализирует гидролиз тиоэфирных связей, играющих большую роль в обмене ацильных групп.
Подкласс 3.2. В него входят ферменты, гидролизующие как истинные гликозиды, так и N- или S-гликозидные соединения.
Всего класс гидролаз подразделяют на 11 подклассов, катализирующих различные реакции гидролиза.
Лиазы. К ним относятся ферменты, разрывающие связи С-С, С-N, С-О, С-S c образование двойных связей. Возможна и обратная реакция, например присоединение молекул воды или аммиака по двойной связи.
Подкласс 4.1. Из ферментов этого подкласса наиболее известны альдолазы, катализирующие реакции альдольной конденсации, в основе которых лежит расщепление или образование связей С-С.
Подкласс 4.2. В него входят такие С-О лиазы, как фумарат- и аконитатгидратаза, катализирующие обратимое отщепление молекул воды от субстрата.
Всего в класс лиаз входит 7 подклассов ферментов, участвующих в процессах синтеза и распада промежуточных продуктов обмена веществ.
Изомеразы. К ним относят ферменты, катализирующие самые различные процессы изомеризации. Систематическое название их учитывает название субстрата, а также тип изомеризации.
Подкласс 5.1. Ферменты этого подкласса – рацемазы – катализируют превращение, например, L-аминокислот в D-аминокислоты.
7
Подкласс 5.2. Представителями являются цис-транс-изиомеразы или эпимеразы. Эти ферменты вызывают взаимные переходы сахаров, например галактоза → глюкоза.
Подкласс 5.3. Ферменты этого подкласса – мутазы – катализируют перенос химических группировок с одной части молекулы на другую.
Всего класс изомераз содержит 6 подклассов.
Лигазы (синтетазы). Они катализируют конденсации двух молекул за счет энергии АТФ. Названия их включают оба соединяющихся вещества и фермент лигазу. Например, аспартат: аммиак – лигаза.
Подкласс 6.1. Ферменты этого подкласса катализируют образование связей С-О. Этот тип связей имеет место, например, при активации аминокислот, предшествующей процессу трансляции.
Подкласс 6.2. Представителями этого подкласса являются, в частности, ферменты, катализирующие образование С–S-связей в процессе присоединения ацильных остатков к коэнзимуА.
Всего класс лигаз содержит 5 подклассов, включающих ферменты анаболических стадий обмена веществ.
8
