
2 курс / Лекция 10. Общие свойства ферментов
.pdf
1
Лекция 10
Общие свойства ферментов
Ферменты как катализаторы обладают всеми свойствами обычных химических катализаторов, но их белковая природа дает ферментам другие свойства, такие как:
1. Лабильность действия:
а) термолабильность;
б) влияние рН;
2.Специфичность действия;
3.Влияние ингибиторов и активаторов.
1. Лабильность действия ферментов
а) Термолабильность
Термолабильность ферментов объясняется тем. что температура, с одной стороны, воздействует на белковую часть фермента, приводя при слишком высоких значениях к денатурации белка и снижению каталитической функции,
а с другой стороны, оказывает влияние на скорость реакции образования фермент-субстратного комплекса и на все последующие этапы преобразования субстрата, что ведет к усилению катализа. Зависимость каталитической активности фермента от температуры выражается кривой.
До некоторого значения температуры (в среднем до 50°С) каталитическая активность растет, причем на каждые 10°С примерно в 2 раза повышается скорость преобразования субстрата. В то же время постепенно возрастает

2
количество инактивированного фермента за счет денатурации его белковой части.
При температуре выше 50°С денатурация ферментного белка резко усиливается и, хотя скорость реакций преобразования субстрата продолжает расти, активность фермента, выражающаяся количеством превращенного субстрата, падает. Температура, при которой каталитическая активность фермента максимальна, называется его температурным о п т и м у м о м.
Температурный оптимум для различных ферментов неодинаков. В общем для ферментов животного происхождения он лежит между 40 и 50°С, а
растительного - между 50 и 60°С. При 100 ºС почти все ферменты утрачивают свою активность. При низких температурах ферменты не разрушаются, хотя активность их падает почти до нуля.
б) Зависимость активности фермента от значения pH среды. Для каждого фермента существует оптимальное значение pH среды, при котором он проявляет максимальную активность. Зависимость каталитической активности фермента от рН среды выражается кривой.
Точка, при которой фермент проявляет максимальную каталитическую активность, называют оптимумом рН среды для действия данного фермента.
Большинство ферментов имеет максимальную активность в зоне рН поблизости от нейтральной точки. В резко кислой или резко щелочной среде хорошо работают лишь некоторые ферменты (пепсин = 2, аргиназа = 10, уреаза = 7).
Переход к большей пли меньшей (по сравнению с оптимальной)
концентрации водородных ионов сопровождается более или менее равномерным падением активности фермента. Влияние концентрации
3
водородных ионов на каталитическую активность ферментов состоит в воздействии ее на активный центр. При разных значениях pH в реакционной среде активный центр может быть слабее или сильнее ионизирован, больше или меньше экранирован соседними с ним фрагментами полипептидной цепи белковой части фермента и т.п. Кроме того, рН среды влияет на степень ионизации субстрата, фермент-субстратного комплекса и на третичную структуру белковой молекулы.
Так как максимальная активность фермента обусловлена оптимальной конформацией молекулы фермента в целом и активного центра в частности, то даже небольшие изменения окружающих условий, которые затрагивают связывание субстрата или конформацию третичной структуры белка, будут влиять на скорость ферментативной реакции. Например, изменение pH
приводит к изменению степени ионизации ионогенных групп фермента и,
следовательно, ведет к перераспределению межрадикальных связей в третичной структуре. Оптимальное значение pH для каждого фермента означает некоторое оптимальное состояние его ионизации, соответствующее наилучшей комплементарности.
2. Субстратная специфичность
Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определенными субстратами. Ни один из химических катализаторов не имеет специфичности действия. Для объяснения были выдвинуты теория Фишера, затем данная теория была заменена теорией Кошланда, согласно которой изменяется структура фермента и субстрата и наблюдается индуцированный контакт.
Различают:
а) абсолютную субстратную специфичность,
б) групповую субстратную специфичность,
4
в) стереоспецифичность.
а) Абсолютная субстратная специфичность.
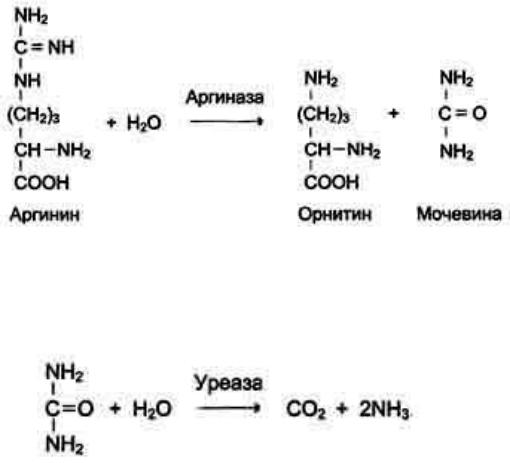
Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Пример фермента с абсолютной субстратной специфичностью - аргиназа, катализирующая реакцию растщепления аргинина до мочевины и орнитина:
Другой пример фермента с абсолютной субстратной специфичностью – уреаза, катализирующая гидролиз мочевины до диоксида углерода и аммиака.
б) Групповая субстратная специфичность.
Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов.
Так, фермент панкреатическая липаза катализирует гидролиз жиров в двенадцатиперстной кишке человека, катализируя превращение любой молекулы жира (триацилглицерола) до молекулы моноацилглицерола и двух молекул высших жирных кислот. Панкреатическая липаза гидролизует

5
эфирную связь у α-атомов углерода глицерола, независимо от того, какие жирные кислоты входят в состав молекулы жира.
Большинство протеолитических ферментов, осуществляющих гидролиз белков, имеет групповую субстратную специфичность, гидролизуя пептидные связи, образованные разными аминокислотами.
в) Стереоспецифичность.
При наличии у субстрата нескольких стереоизомеров фермент проявляет абсолютную специфичность к одному из них. В организме человека наблюдают специфичность ферментов к следующим стереоизомерам.
Стереоспецифичность к D-сахарам. Большинство моносахаридов и продуктов их обмена в организме человека и других млекопитающих относят к
D-стереоизомерам. Ферменты, осуществляющие их метаболизм, имеют специфичность к D-, а не к L-сахарам.

6
Стереоспецифичность к цис-транс-изомерам. Фермент фумараза оказывает действие только на фумарат. Малеинат (цис-изомер фумарата) не является субстратом фумаразы. Исключение составляют только ферменты эпимеразы (рацемазы), катализирующие превращение оптических изомеров.
7
3. Действие ингибиторов и активаторов
1) Активаторы – это вещества, которые увеличивают скорость реакций,
катализируемых ферментами. К ним относятся ионы металлов (Mg, Mn, Zn, K, Co) и некоторые анионы (Cl). В одних случаях ионы металлов входят в состав простатической группы фермента, в других - способствуют присоединению субстрата к активному центру и образованию фермент-субстратного комплекса.
В ряде случаев металлы соединяются с субстратом, образуя' истинный субстрат, на который действует фермент. Металлы принимают участие в формировании и стабилизации активного центра и всей третичной структуры молекулы фермента.
Мощное действие на ферменты оказывают аллостерические активаторы.
Они присоединяются к аллостерическому центру фермента и изменяют третичную структуру белковой молекулы. В результате этого образуется наиболее выгодная пространственная конфигурация фермента для осуществления своих функции. Анионы металлов обычно неэффективны или оказывают небольшое активирующее влияние на ферменты.
2) Ингибиторы. Действие ферментов можно полностью или частично подавить (ингибировать) определенными химическими веществами
(ингибиторами). Ингибиторы - это вещества, вызывающие частичное или полное торможение реакций, катализируемых ферментами. Ферменты являются белками, поэтому любые агенты, вызывающие денатурацию белка, приводят к инактивации фермента. Однако подобное инактивироваиие относительно неспецифично. Оно не связано с механизмом действия ферментов.
Гораздо большую группу составляют специфические ингибиторы,
которые оказывают свое действие на I какой-либо фермент или группу родственных ферментов.

8
По характеру действия ингибиторы могут быть обратимыми и необратимыми. В основе этого деления лежит прочность соединения ингибитора с ферментом.
Другой способ деления ингибиторов основывается на характере места их связывания. Одни из них связываются с ферментом в активном центре, а другие
- в удаленном от активного центра месте. Они могут связывать и блокировать функциональную группу молекулы фермента, необходимую для проявления его активности. При этом они необратимо, часто ковалентно, связываются с ферментом или фермент-субстратным комплексом и необратимо изменяют нативную конформацию. Это, в частности, объясняет действие Hg2+, Pb2+,
соединений мышьяка. Ингибиторы такого рода могут быть полезны при изучении природы ферментативного катализа.
Например, диизопропилфторфосфат ингибирует ферменты, имеющие серии в активном центре. Таким ферментом является ацетилхолинэстераза,
катализирующая следующую реакцию:

9
Реакция происходит каждый раз после проведения нервного импульса,
прежде чем второй импульс будет передан через синапс.
Диизопропилфторфосфат – одно из отравляющих веществ нервно-
паралитического действия, так как приводит к утрате способности нейронов проводить нервные импульсы.

10
Терапевтическое действие аспирина как жаропонижающего и противовоспалительного средства объясняется тем, что аспирин ингибирует один из ферментов, катализирующий синтез простагландинов (ПГ).
Простагландины - вещества, участвующие в развитии воспаления.
Ингибирование обусловлено ковалентной модификацией одной из аминогрупп фермента - простагландинсинтетазы.
