
2 курс / Лекция 06. Классификация белков
.pdf
Лекция 5
Классификация белков
Белки в зависимости от химического состава делятся на простые и сложные. Простые белки построены только из аминокислот и при гидролизе распадаются только на аминокислоты. Сложные белки (протеиды) – это двухкомпонентные белки, которые состоят из какого-либо простого белка и
небелкового компонента, называемого простетической группой. Сложные белки при гидролизе распадаются на аминокислоты и небелковую часть или продукты ее распада.
Простые белки
Простые белки по отношению к растворимости делятся:
1. Альбумины - хорошо растворимы в воде и крепких солевых растворах. Альбумины – глобулярные белки. Молекулярная масса 15–70 кДа.
Они имеют низкую изоэлектрическую точку рI=4 (подробнее об этом Вы узнаете в следующей лекции). Они содержат примерно 1% глицина, много аспарагиновой и глютаминовой кислот, поэтому имеют большой отрицательный заряд при физиологических значениях рН. В отличие от животных, растительные альбумины характеризуются повышенным содержанием метионина и триптофана. Это сильно гидратированные белки,
поэтому они осаждаются только при большой концентрации водоотнимающих веществ. При переходе к очень концентрированным растворам (NH4)2SO4, вплоть до полностью насыщенных, альбумины высаливаются (т.е. осаждаются с помощью концентрированных растворов солей). При этом сохраняется гидратная оболочка белков, которая поддерживает их структуру.
Очень распространены в органах и тканях животных. Это основной белок в крови, составляющий более половины (от 50 до 65%) от общего количества плазмы. Альбумины легко адсорбируют полярные и неполярные молекулы, поэтому одна из функций этих белков – транспортная. По результатам биохимического анализа крови и содержанию в сыворотке альбумина врач диагностирует работу почек и печени. Альбумины отвечают
за поддержание давления в плазме крови, благодаря чему жидкость не вызывает отеков, не проникает в соединительную и мышечную ткань Они выполняют также и питательную функцию (например, в составе белка яиц,
лактальбумин в молоке). Синтезируются преимущественно в печени.
У растений – это запасные белки: лейкозин (в зародыше пшеничного зерна), легумелин – в семенах гороха.
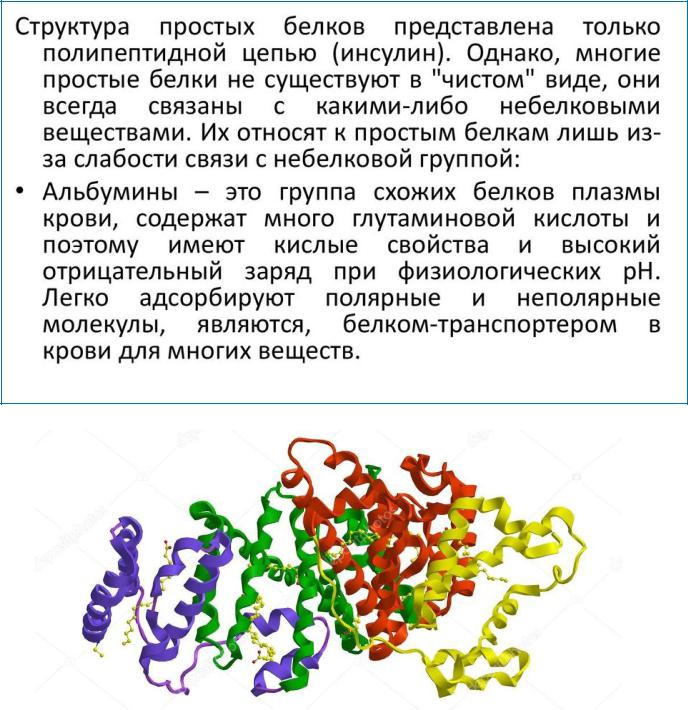
Молекулярная структура сывороточного альбумина человека
2.Глобулины - растворимы в разбавленных солевых растворах,
нерастворимы в воде и солевых растворах умеренных концентраций. Это
достаточно крупные глобулярные белки с молекулярной массой 100 кДа и

больше. Слабокислые или нейтральные белки (изоэлектрическая точка pI в
интервале рН 6 – 7,3). Это слабогидратированные белки, поэтому они менее устойчивы в растворе и легче осаждаются. По сравнению с альбуминами характерно меньшее содержание кислых аминокислот.
Очень распространены в органах и тканях животных. Транспортная функция основана на способности некоторых глобулинов к
специфическому связыванию веществ (например, трансферрин – главный белок переносчик железа в плазме крови, церулоплазмин содержит ионы меди, гаптоглобин – переносчик гемоглобина). Другие глобулины, как и альбумины, способны к неспецифическому связыванию липидорастворимых веществ. Гамма-глобулины определяют иммунные свойства организмов. Синтезируются в печени, лимфоидной ткани.
Глобулины составляют большую часть белков семян многих растений,
особенно бобовых и масличных. Например, легумин – в семенах гороха,
фазеолин – в семенах фасоли, эдестин – в семенах конопли, глицинин – сои.
3. Гистоны - растворяются в слабых кислотах (0,2 Н HCl),
Небольшие белки с молекулярной массой 11-24 кДа. Имеют только третичную структуру. Являются белками с резко выраженными основными свойствами. В их состав входят лизин, аргинин и гистидин. Они не содержат триптофана и, в большинстве случаев, цистеина и цистина. В
естественных условиях гистоны прочно связаны с ДНК и выделяются в составе нуклеопротеида. Эти белки содержатся в ядрах клеток, в составе дезоксирибонуклеопротеинов. Их нет у прокариот, так как у них нет оформленного ядра. Найдены во всех эукариотических клетках. Гистоны выполняют структурную функцию – участвуют в стабилизации пространственной структуры ДНК, а, следовательно, хроматина и хромосом.
Регуляторная функция заключается в способности блокировать передачу генетической информации от ДНК к РНК.
Восемь молекул гистонов образуют октамер (гистоновую глобулу), который обвивает молекула ДНК (показана серым цветом).

3. Протамины - растворимы в слабых кислотах, не осаждаются при кипячении. Это группа простейших, самых низкомолекулярных белок (4
– 12 кДа). Обладают выраженными основными свойствами (содержат от 60
до 85% аргинина). Как и гистоны, являются поликатионными белками. Не дают многих цветных реакций на белки. Связаны с ДНК посредством ионных связей. Это своеобразный биологический заменитель гистонов. Они связываются с ДНК в хроматине спермиев. Замена гистонов на протамины наблюдается не у всех животных. Наиболее типично присутствие протаминов в составе нуклеопротамина взрослых рыб (в молоках). У
представителей растительного царства – в спорах плауна.
Протамины содержатся в половых клетках животных и человека и составляют основную массу белков хроматина. Структурная функция
состоит в том, что протамины делают компактной ДНК сперматозоидов.
Придают ДНК биохимическую инертность, что необходимо для сохранения наследственных свойств организмов. Не выполняют регуляторной функции, поэтому присутствуют в клетках, не способных к

делению. Возможно, что этим и объясняется биологическая замена в некоторых клетках гистонов на протамины. Из молок сёмги выделен сальмин, из молок сельди – клупеин.
5. Проламины - хорошо растворимы в 60–80% водном растворе этанола, нерастворимы в воде, соляных растворах, кислотах и щелочах. Это
белки растительного происхождения. Они содержат 20–50% глутаминовой кислоты, 10–15% пролина. В очень незначительном количестве в них содержится лизин, аргинин, глицин. Представляют собой комплексы белков,
различающиеся по составу, свойствам и молекулярной массе. Проламины характерны для семян злаков, где выполняют роль запасных белков.
Например, белок клейковины пшеницы глиадин, кукурузы – зеин, ячменя – гордеин.

6. Глютелины - растворимы только в растворах слабых щелочей
(0,2-2% NaOH), нерастворимы в воде, растворах солей и этаноле.
Представляют собой комплексы белков, различающиеся по составу,
свойствам и молекулярной массе. Значительно большее, чем в проламинах содержание аргинина и меньшее - пролина. Это белки растений, содержатся в семенах злаков и других культур, а также в зеленых частях растений.
Глютелин - в пшенице, оризенин - в рисе.

7. Протеиноиды – трудно растворимые белки, не растворяются в обычных растворителях белков: воде, солевых и водно-спиртовых смесях.
Характерна высокая степень гидрофобности. По строению все они являются фибриллярными белками, которые имеют вытянутую, нитевидную форму и состоят, как правило, из нескольких полипептидных цепей. Характерно высокое содержание гидрофобных аминокислот. Стабилизация структур происходит за счет межцепочечных водородных, ионных и Ван-
дервальсовых взаимодействий и небольшого количества ковалентных связей.
Характерно высокое содержание серы. Это белки опорных тканей (костей,
хрящей, связок, сухожилий, ногтей, волос и т.д.). Структурная и опорная функции. Например, к ним относят фиброин, кератины, коллагены, спонгин.

Сложные белки
Сложные белки по природе простетической группы делятся:
1. Хромопротеины состоят из простого белка и связанного с ним окрашенного небелкового компонента, откуда и произошло их название (от греч. chroma - краска). Среди хромопротеинов различают гемопротеины
(содержащие в качестве простетической группы геминовое Fe), магний-
порфирины (хлорофилл) и флавопротеины (содержащие производные изоаллоксазина). Биологические функции хромопротеинов: они участвуют в фотосинтезе, дыхании клеток; транспорт О2 и СО2 и др. Таким образом,
хромопротеины играют важную роль в процессах жизнедеятельности.
Гемопротеины. Сюда относятся гемоглобин и его производные,
миоглобин и ферменты (вся цитохромная система, каталаза и пероксидаза).
Все они содержат в качестве небелкового компонента структурно сходные
