
2 курс / Лекция 03. Вторичная-четвертичная структура белков
.pdf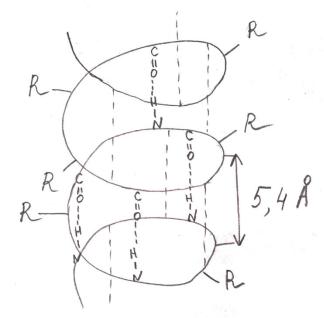
Лекция 3
Вторичная структура белков
Если бы все белки имели только первичную структуру, то их молекулы были бы нитевидными. Но большинство белков имеют глобулярную структуру, и это значит что существуют более высокие уровни формирования пространственной структуры белков.
Первичная структура образована прочными ковалентными связями.
Пространственные структуры белков определяются слабыми связями,
поэтому белковая молекула – лабильная структура. Белок может слегка изменять свою структуру. Это лежит в основе регуляции активности белковой молекулы.
Пространственная структура белка изучается с помощью рентгеноструктурного анализа. Одна из первых рентгенограмм была получена Уильямом Астбери. На рентгенограмме было ясно видно, что белок состоит из спиральных структур.
Лайнус Полинг и Карл Кори в 1950-м г. представили модель вторичной структуры белка. Ими была описана α-спираль – закрученная полипептидная цепь (её укладку в пространстве сравнивают с укладкой шнура от телефонной трубки). Это правая спираль, закручена слева направо.
При этом закручивается остов полипептидной цепи, а радикалы располагаются в стороны.
Шаг спирали 5,4 ангстрема.
Правозакрученная спираль.
В один виток укладывается 3,6 амино-
кислотных остатка
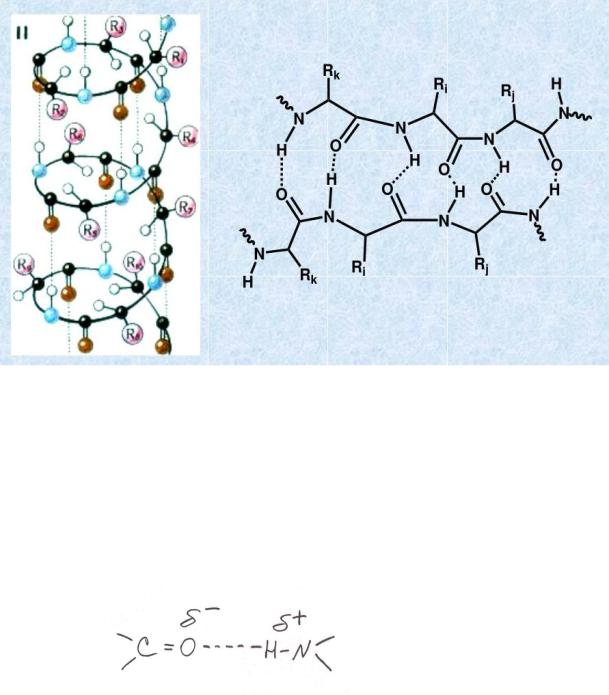
α-Спирали стабилизируются водородными связями между группировками пептидных связей ниже и выше расположенных витков. В
каком же порядке возникают водородные связи? Они образуются через три аминокислотных остатка: 1-й аминокислотный остаток образует водородную связь с 4-м, 2-й – с 5-м и т.д.
Водородные связи имеют очень важное значение в биологии. Они участвуют в передаче информации между белками, нуклеиновыми
кислотами и участвуют в формирования пространственной структуры
макромолекул.
Водородные связи обозначаются пунктиром:
Между группировками пептидных связей возникает слабое
электростатическое взаимодействие. Водородные связи – это слабые
электростатические взаимодействия.
α-Спираль образуется одним фрагментом полипептидной цепи. Это объёмная структура.
За счет какой энергии она образуется? – α-Спирали образуются
самопроизвольно, спонтанно. Полипептидная цепь сама стремится принять эту наиболее энергетически выгодную конфигурацию.
Существуют аминокислотные остатки, которые способствуют образованию α-спирали: ала, лей, мет, вал и др. А есть такие, которые не благоприятствуют образованию α-спирали или даже препятствуют: гли, тир,
асп, про. Где они преобладают, там образуется другая структура – β-
структура.
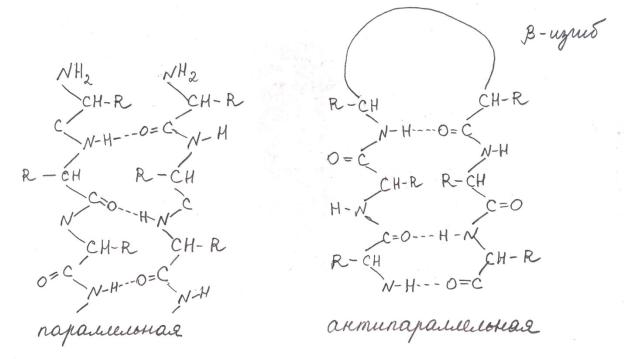
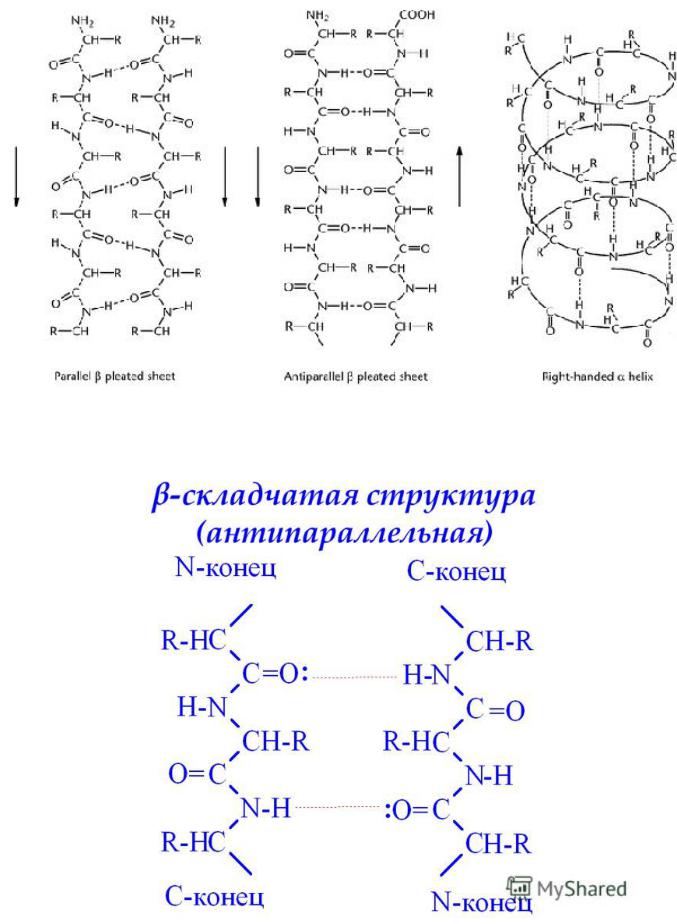
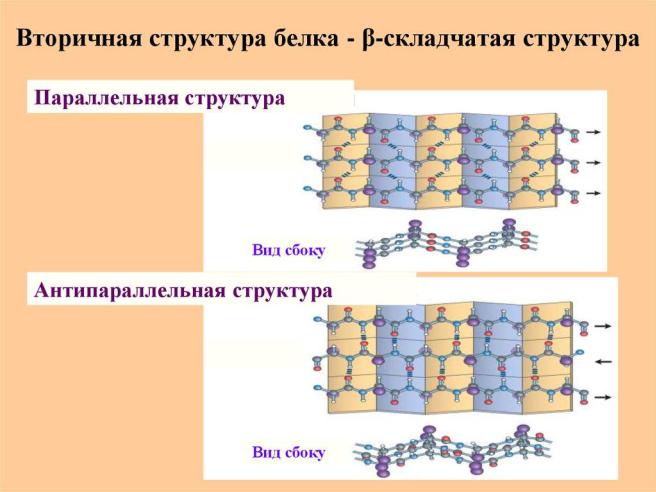
β-структура (β-слой)
Образуется двумя или более фрагментами полипептидной цепи.
Структура плоская.
Параллельная – когда направление цепей совпадает. Водородные связи формируются между цепями.
Антипараллельная – когда полипептидная цепь поворачивает,
образуется β-изгиб, затем идёт в обратном направлении, и так формируется антипараллельная β-структура.
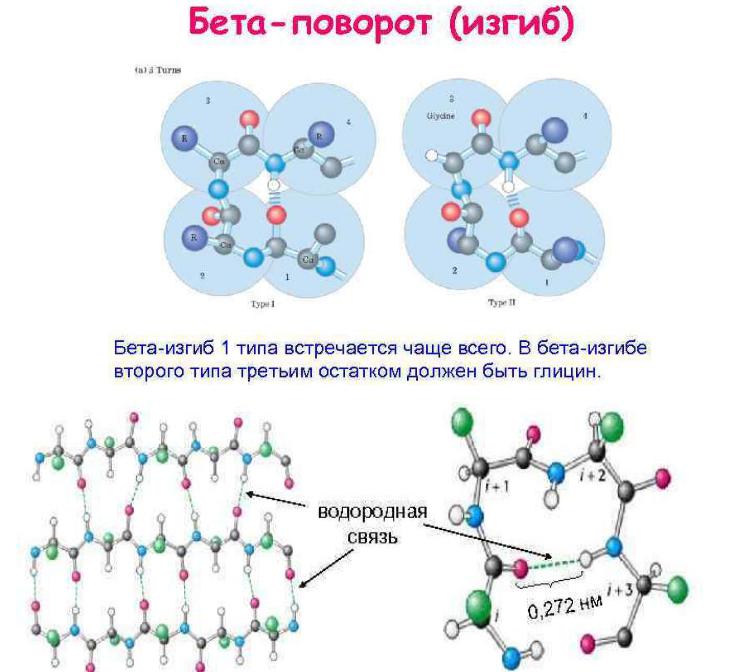
β-изгиб(β-поворот)
Вглобулярных белках с компактной структурой до 1/3
аминокислотных остатков участвуют в образовании β-поворота. β-поворот может быть до 180º, образующим петлю. Он образуется четырьмя аминокислотными остатками. Водородные связи формируются между 1-м и
4-м аминокислотными остатками. 2-й и 3-й не участвуют в образовании водородных связей. Обычно эти места занимает пролин или глицин. Глицин маленький и гибкий по структуре, пролин позволяет пептидной предшествующей связи изменить транс-конфигурацию на цис-
конфигурацию.
Третичная структура белков
Это пространственное расположение полипептидной цепи.
Каждый белок обладает своей собственной третичной структурой, от которой зависят его специфические биологические (нативные) свойства.
Сворачивание полипептидной цепи происходит строго закономерно и
определяется первичной структурой. Пептидная цепь сворачивается одним
единственным способом и приобретает функционально-активную структуру, характерную для данного нативного белка.
Образование третичной структуры называется фолдингом.
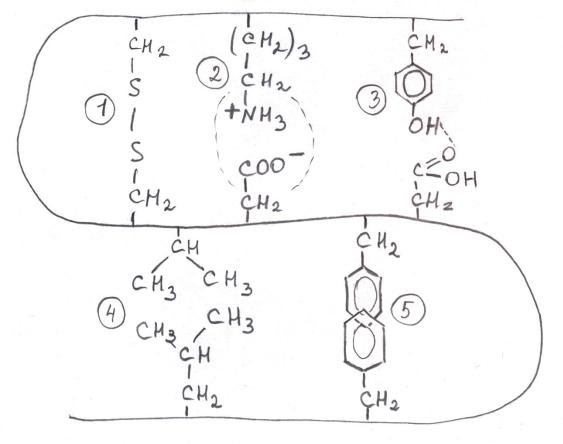
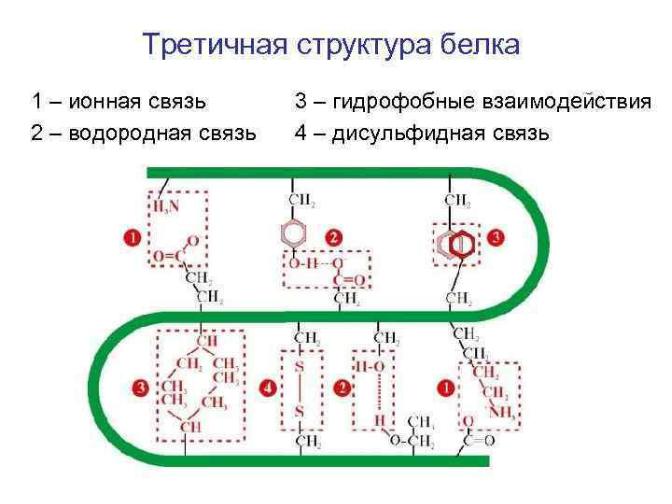
Связи, участвующие в образовании третичной структуры
На рисунке связи расположены по мере убывания прочности.
1.Дисульфидная ковалентная. Редко входит в состав внутриклеточных белков (прочная структура редко нужна). Только
первичная структура образуется ковалентными связями. Остальные
уровни структуры образуются слабыми типами связей.
2.Ионная (электростатические взаимодействия).
3.Водородная (слабые электростатические взаимодействия).
4 и 5. Гидрофобные взаимодействия (вандерваальсовы). Самые слабые, но играют ведущую роль в формировании третичной структуры (на рисунке под номером 5 показаны циклические радикалы,
связь изобразили, накладывая кольца друг на друга).
Ведущую роль в формировании третичной структуры играют
гидрофобные взаимодействия. Вода будет стремиться вытолкнуть гидрофобные радикалы, поэтому они будут уходить от контакта с водой внутрь белковой молекулы, где образуется гидрофобное ядро. При этом полипептидная цепь изгибается и занимает определённое положение в
пространстве. Это положение фиксируется остальными типами связей. На поверхности остаются гидрофильные радикалы, полярные, которые взаимодействуют с водой и определяют функциональные свойства белковой молекулы.
При укладке полипептидная цепь стремится принять энергетически
выгодную форму. Эта структура будет иметь минимум свободной энергии.
Образование пространственной структуры – процесс, не требующий
дополнительной информации. Структура белка определяется его
аминокислотной последовательностью. Следовательно, белки
самоорганизуются.
Функционально активная молекула возникает только при
формировании третичной структуры.
Т.е. образуется молекулярная машина (например, мышца сокращается).
На поверхности белковой молекулы остаются аминокислотные остатки
трёх классов: полярные и заряженные. Некоторые полярные радикалы (менее
10%) могут быть внутри белка и образовывать ионные связи.
При формировании молекулы на поверхности могут оставаться
жирные пятна (гидрофобные аминокислоты), которые используются для
контакта с другими субъединицами.
Остающиеся на поверхности белковой молекулы полярные аминокислотные остатки взаимодействуют с водой и отвечают за физико-
химические свойства белков (растворимость). |
|
|
||
Связи, |
образующие |
пространственную |
структуру, |
слабые. |
Поддержание конформации возможно благодаря их очень большому количеству. Связи лабильны, и они могут меняться при разных воздействиях
(например, при высокой температуре гидрофобные связи разрушаются и структура дестабилизируется).
При взаимодействии с другими молекулами могут возникать
конформационные изменения, играющие большую роль при
функционировании белков и являющиеся основой регуляторных воздействий
(например аллостерическое ингибирование).
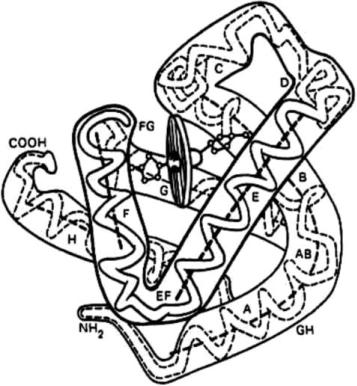
Впервые третичная структура была изучена в 1957 г. Джоном
Кендрью в Кембридже на примере белка миоглобина. За это исследование он получил Нобелевскую премию. Миоглобин (белок, родственный гемоглобину) состоит из одной субъединицы, депонирует кислород в мышцах. Его много у кита, кашалота, тюленя – у ныряющих животных.
Тюлень может находиться под водой до 40 мин.
Кендрью получил кристаллы миоглобина. Третичную структуру он изучал с помощью рентгеноструктурного анализа и метода изоморфного замещения. Чтобы изучить белок этим методом, нужно получить его в кристаллической форме, затем кристаллы помещаются в поток рентгеновских лучей в трех положениях. За счёт таких явлений, как дифракция и интерференция, образуются рассеивающиеся структуры, пятна.
Затем проводится трёхмерный синтез Фурье и рассчитывается пространственное положение полипептидной цепи. На основании рентгенограмм Кендрью и представил первую пространственную модель
миоглобина:
