
2 курс / Лекция 04. Физико-химические свойства белков
.pdf1
Лекция 4
Физико-химические свойства белков
Поскольку белки являются макромолекулами, то размеры их очень велики и сравнимы с размерами частиц в коллоидных растворах (от 1 до
100нм). Это сказывается на поведении белков в растворах, где они проявляют коллоидные свойства, хотя истинными коллоидыми не являются.
Важной особенностью белков является также и то, что на поверхности белковой глобулы находится большая часть полярных и заряженных гидрофильных групп.
Эти особенности определяют физико-химические свойства белков и их поведение в растворах.
Амфотерные свойства белков
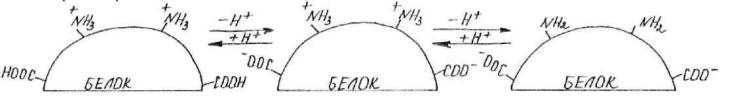
Белки являются амфотерными полиэлектролитами. Они амфотерны благодаря наличию свободных –NH3+ и –СОО- - групп и характеризуются всеми свойствами кислот и оснований. Большая часть полярных гидрофильных групп находится на поверхности белковых глобул. Кислотно-
основные свойства белков определяются, главным образом, боковыми радикалами аминокислот, способными к ионизации.
Кислотные свойства определяют остатки аспарагиновой кислоты и глутаминовой кислоты, имеющих отрицательный заряд, а основные – лизина,
аргинина, гистидина, заряженных положительно.
Если кислотные радикалы преобладают, то молекула оказывается электроотрицательной; если преобладают основные радикалы, –
электроположительной. Заряды по поверхности глобулы распределяются неравномерно.
Белки, в которых преобладают аспарагиновая кислота, глутаминовая кислота – кислые.
Белки, в которых преобладают аргинин, лизин, гистидин – основные.
2
рН < 7 |
|
pH=7 |
|
pH > 7 |
|
|
|
|
|
|
|
Протонов |
в |
Суммарный |
заряд |
Заряд |
|
среде много. |
Заряд |
равен нулю. Миграция в |
отрицательный. |
|
|
положительный. |
|
электрическом |
поле |
Миграция |
в |
Миграция |
в |
отсутствует |
|
электрическом поле |
к |
электрическом поле к |
|
|
аноду (положительный |
||
катоду отрицательный |
|
|
полюс) |
|
|
полюс) |
|
|
|
|
|
|
|
|
|
|
|
Разделение белков в электрическом поле называют электрофорезом.
Сдвиг рН среды приводит к изменению диссоциации радикалов и перераспределению зарядов в белковой молекуле, в результате чего изменяется структура белка и его биологическая активность.
Гомеостаз- это поддержание постоянства внутренней среды.
Для каждого белка существует такое значение рН, при котором положительные и отрицательные заряды скомпенсированы.
Значение рН среды, при котором суммарный заряд белка равен
нулю, называется изоэлектрической точкой (ИЭТ, pI).
Большинство белков имеет ИЭТ=4,5-6,5 (каталаза ИЭТ=5,6). Поэтому при рН, близких к нейтральным, большинство белков имеют отрицательный заряд. Однако у некоторых белков ИЭТ находится при крайних значениях рН
(пепсин ИЭТ= 1,0; лизоцим ИЭТ=11,0).
Правило определения заряда
Если рН среды<ИЭТ, то заряд белка положительный.
Если рН среды>ИЭТ, то заряд белка отрицательный.
3
Растворимость белков
Растворимость любого вещества зависит от сродства молекул растворенного вещества друг к другу и к молекулам растворителя.
Большинство белков – гидрофильные соединения (гидрофобные белки в мембране).
Вода образует диполь.
Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объём увеличиваются. Набухание белка сопровождается его частичным растворением. Гидрофильность отдельных белков зависит от их строения.
Имеющиеся в составе и расположенные на поверхности белковой макромолекулы гидрофильные амидные (–СО–NH–, пептидная связь),
аминные (–NH2) и карбоксильные (–СООН) группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы. Окружая белковые глобулы, гидратная (водная) оболочка препятствует агрегации и осаждению, и, следовательно, способствует устойчивости раствора белка.
При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями, или гели. Студни не текучи, упруги, обладают пластичностью, определённой механической прочностью, способны сохранять свою форму. Глобулярные белки могут полностью гидратироваться, растворяясь в воде (например, белки молока),
образуя растворы с невысокой концентрацией.
Гидрофильность белков зерна и муки играет большую роль в хранении и переработке зерна, в хлебопечении. Тесто, которое получают в хлебопекарном производстве, представляет собой набухший в воде белок,
концентрированный гель, содержащий зёрна крахмала.
4
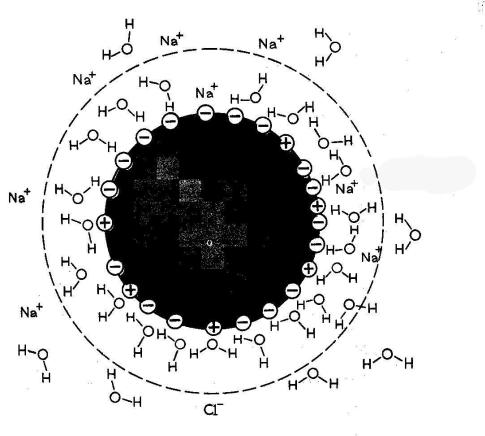
Механизм гидратации белков
При контакте белков с водой диполи воды адсорбируются на поверхности белков, группируясь вокруг полярных групп – ионная адсорбция;
Адсорбированная вода самопроизвольно не отделяется и не может быть растворителем для других веществ.
Молекулы белка на поверхности воды образуют гидратационные слои.
Пептидная связь может связывать 1 молекулу воды, группа –СОО- – 4
молекулы, –NНз+ – 1 молекулу воды.
Чем больше гидратационный слой, тем больше устойчивость белкового раствора. Для того, чтобы белок выпал в осадок, молекулы белка должны столкнуться, вследствие чего они слипнутся и выпадут в осадок. Наличие гидратационного слоя препятствует слипанию.

5
Факторы стабилизации белков:
1.Наличие гидратационного слоя.
2.Наличие заряда.
Как только один из факторов исчезает, белки слипаются и выпадают в осадок.
Минимальной растворимостью обладает белок в ИЭТ (так как суммарный заряд белка равен нулю). Это свойство используется в изоэлектрическом осаждении белков. Как этот метод проводят? Достигается ИЭТ одного белка, следовательно, он выпадает в осадок; затем ИЭТ другого белка и т.д.
Растворимость белков возрастает при добавлении небольших концентраций нейтральных солей ((NH4)2S04) - этот эффект называется солевым растворением. Растворению белков способствуют факторы,
снижающие взаимодействие между молекулами белков. Известно, что степень диссоциации электролитов прямо пропорциональна диэлектрической постоянной растворителя. У воды диэлектрическая постоянная равна 80.
Высокие концентрации нейтральных солей осаждают (высаливают) белки – это метод высаливания. Они оттягивают на себя молекулы воды и лишают белок гидратной оболочки (сольватационного слоя) – происходит дегидратация. По способности к высаливанию анионы и катионы располагаются в особые лиотропные ряды – ряды Гофмейстера.

6

7
8
Белковые растворы как коллоидные
Поскольку молекула белка очень велика, то раствор белка в воде является коллоидным раствором (раствором, в котором размер частиц от 1 до
100 нм). Соответственно растворы белков проявляют общие свойства для
коллоидных систем:
1.Наличие зарядов и водной оболочки у растворенных частиц, которые являются необходимыми стабилизаторами.
2.Неспособность белковых частиц проникать через мембраны, поры которых меньше диаметра белков (полунепроницаемые мембраны). Это используется в диализе.
3.Частицы коллоидных растворов способны адсорбировать ионы и атомы.
4.Создание осмотического давления, т.е. перемещение воды в сторону более высокой концентрации белка, что проявляется, например, как формирование отёков при повышении проницаемости сосудистой стенки.
5.Коллоидные растворы могут переходить из состояния золя в состояние геля и наоборот. Для состояния геля характерна высокая вязкость в результате сил сцепления между крупными молекулами.
6.Белковые растворы в отличие от истинных обладают малой скоростью диффузии.
Врастворах белки проявляют коллоидные свойства: они медленно диффундируют, не проходят через полупроницаемую мембрану, рассеивают свет, характеризуются высокой вязкостью. Однако следует иметь в виду, что белковые растворы не являются типичными коллоидными растворами,
т.к. белки диспергированы до единичных молекул и образуют гомогенный раствор. В отличие от них типичные коллоидные растворы гетерогенны,
двухфазны (растворенное вещество и растворитель), коллоидные частицы
(мицеллы) растворенного вещества состоят из нескольких молекул. Сходство
9
белковых и истинных коллоидных растворов основано на том, что молекулы белков имеют размеры, приближающиеся к размеру мицелл коллоидного раствора (10-4-10-7).
Образование коллоидных растворов белками и другими биологическими макромолекулами обусловливает многие физико-
химические явления, наблюдающиеся в биологических жидкостях и организмах в целом. Растворы белков, как и все коллоидные растворы, могут при определенных условиях терять свою текучесть и образовывать гели, или студни. Гели возникают в результате объединения молекул в виде сетки,
внутреннее пространство которой заполнено большим количеством растворителя, при этом разделения на жидкую и твердую фазы, как в случае коагуляции, не происходит (в протоплазме клеток, хрусталике глаза,
соединительных тканях и т.д.). Полагают, что в ряде растительных и животных тканей белки находятся не только в виде растворов, но и гелей. В
состояние геля белковые растворы, например молоко, могут переходить под воздействием ферментов микроорганизмов, результатом чего является образование простокваши, кефира. При подготовке растений к зимнему периоду жизни, в процессе так называемого осеннего «закаливания»,
происходит переход части белков из растворенного состояния в гелеобразное.
Гели со временем стареют, отслаивают воду и делятся на 2 фазы:
уплотненный гель и разведенный золь. Этот процесс получил название
синерезиса. Одним из свойств гелей является их способность к набуханию – увеличению объема за счет связывания большого количества воды.
В растворах белков и других высокомолекулярных соединений может наблюдаться явление коацервации – слияния водных оболочек нескольких частиц без объединения самих частиц. Коацерваты возникают при ограниченной растворимости компонентов раствора, это служит причиной появления коацерватных капель.
10
Денатурация белков
Денатурация – одно из самых характерных свойств белковой молекулы.
Визуальным признаком денатурации является уменьшение растворимости белка и выпадение его в осадок.
В основе денатурации лежит изменение нативной конформации белковой молекулы. Денатурация в зависимости от ее степени сопровождается нарушением вторичной, третичной и четвертичной структур.
Денатурация может быть обратимой.
При более глубоких изменениях структуры денатурация уже необратима.
Чувствительность белков к денатурации связана с величиной и сложностью белковой молекулы.
Белок с исходной, природной укладкой цепи называют нативным,
белок с развернутой, беспорядочной укладкой цепи – денатурированным, а
превращение нативного белка в денатурированный – денатурацией.
Укладка цепи в нативные белки осуществляется в значительной мере благодаря слабым нековалентным связям, поскольку ковалентные связи при умеренном нагревании не разрываются. Сама полипептидная цепь в этих условиях остается интактной.
Денатурация белка – существенные изменения вторичной и третичной структуры белка, т.е. нарушение, разупорядочение нековалентных взаимодействий, не затрагивающее его ковалентную структуру.
Денатурация, как правило, сопровождается инактивацией белка. Однако инактивация сама по себе не может служить критерием денатурации
(конформационные переходы в белке не приводят к утрате упорядоченности в структуре белка). Характерным признаком денатурации является именно утрата упорядоченности. Переход от нативного состояния к денатурированному происходит резко и скачкообразно.
