
- •Основные обозначения
- •Введение
- •СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА
- •Основные характеристики электромагнитного излучения
- •Спектр электромагнитных колебаний
- •Глава 1. Абсорбционная спектроскопия
- •1.1. Законы поглощения света
- •1.2.2. Спектры поглощения
- •1.2.3. Устройство приборов
- •1.2.4. Практическое применение
- •1. Определение фенолов.
- •2. Определение аминов.
- •3. Определение кетонов.
- •1.2.5. Практические работы
- •Работа 1. Определение хрома дифенилкарбазидным методом
- •Выполнение работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •1.3. Инфракрасная (колебательная) спектроскопия
- •1.3.1. Элементарная теория колебательных спектров
- •1.3.2. Спектры поглощения
- •Количественный анализ по инфракрасным спектрам.
- •1.3.4. Устройство приборов
- •1.3.5. Практические работы
- •Выполнение работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •Глава 2. Эмиссионная спектроскопия
- •2.3. Практические работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- •Глава 3. Кондуктометрия
- •3.1. Электропроводность растворов электролитов
- •3.1.1. Удельная электропроводность
- •3.1.2. Эквивалентная электропроводность
- •3.2. Электропроводность природных вод
- •3.3. Кондуктометрическое титрование
- •Титрование сильной кислоты сильным основанием
- •Титрование слабой кислоты сильным основанием
- •3.4. Практические работы
- •Кондуктометр ОК 102/1
- •Порядок работы на приборе
- •Выполнение работы
- •Работа 2. Определение удельной электропроводности воды
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •Глава 4. Потенциометрия
- •4.1. Электродный потенциал
- •4.2. Электроды сравнения
- •4.3. Диффузионный потенциал
- •4.4. Прямая потенциометрия
- •4.4.2. Ионоселективные электроды
- •4.5. Потенциометрическое титрование
- •4.7. Практические работы
- •Порядок работы
- •Ход работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •Глава 5. Вольтамперометрия
- •5.1. Кривая ток-потенциал
- •5.2. Полярографический фон
- •5.3. Диффузионный ток
- •5.4. Количественный полярографический анализ
- •5.5. Качественный полярографический анализ
- •5.6. Полярографическая установка
- •5.7. Хроноамперометрия с линейной разверткой потенциала
- •5.8. Инверсионная вольтамперометрия
- •5.9. Практическое применение
- •5.10. Практические работы
- •Работа 1. Обнаружение ионов Cu2+, Cd2+, Zn2+, Mn2+
- •Выполнение работы
- •Работа 2. Обнаружение ионов Pb2+ и Tl+
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •Глава 6. Электрофорез
- •6.1. Общие принципы электрофореза
- •1. Форма и величина белковой молекулы.
- •2. Электрическое поле.
- •3. Характер буфера и его ионная сила.
- •4. Природа носителя.
- •6.2. Электрофорез на бумаге и ацетате целлюлозы
- •6.3. Электрофорез в гелях
- •6.4. Диск-электрофорез
- •6.5. Применение метода диск-электрофореза
- •6.6. Практические работы
- •Выполнение работы
- •Проведение электрофореза
- •Обнаружение белковых фракций
- •Хранение и реставрация гелей
- •Техника безопасности при работе методом электрофореза
- •Контрольные вопросы
- •Литература
- •6.8. Практические работы
- •Выполнение работы
- •Контрольные вопросы
- •Выполнение работы
- •Контрольные вопросы
- •Контрольные вопросы
- •Литература
- •ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- •Глава 7. Общие принципы хроматографии
- •7.2. Классификация хроматографических методов
- •7.3. Применение методов хроматографии
- •Контрольные вопросы
- •Литература
- •Глава 8. Жидкостная хроматография
- •8.1.1. Хроматография на колонке
- •8.1.2. Тонкослойная хроматография (ТСХ)
- •8.1.3. Практические работы
- •Выполнение работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •8.2. Жидкостно-жидкостная (распределительная) хроматография
- •8.2.1. Теоретические основы метода
- •8.2.2. Хроматография на бумаге
- •8.2.3. Практические работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •8.3. Ионообменная хроматография
- •8.3.1. Теоретические основы метода
- •Контрольные вопросы
- •Литература
- •8.4. Проникающая или эксклюзионная хроматорафия
- •8.4.1. Теоретические основы метода
- •8.4.2. Практические работы
- •Выполнение работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •8.5. Высокоэффективная жидкостная хроматография (ВЭЖХ)
- •8.5.1. Теоретические основы метода
- •8.5.2. Практические работы
- •Выполнение работы
- •Контрольные вопросы
- •Литература
- •8.6. Понятие об аффинной или биоспецифической хроматографии
- •Контрольные вопросы
- •Литература
- •Глава 9. Газовая хроматография
- •9.1. Теоретические основы метода
- •9.2. Аппаратурное оформление газовой хроматографии
- •9.3. Качественный и количественный анализ
- •9.4. Применение газовой хроматографии
- •9.5. Практические работы
- •Контрольные вопросы
- •Литература
8.4.2. Практические работы
Работа 1. Разделение высоко- и низкомолекулярных веществ методом проникающей хроматографии
Наиболее часто в проникающей хроматографии применяют органические полимеры с трехмерной сетчатой структурой, придающей им свойства гелей. К числу таких соединений относятся декстраны с поперечными сшивками (сефадекс). Сефадекс - это полимер в виде гранул, построенных из молекул бактериального полисахарида декстрана (1,6-глюкана), "сшитых" через определенные промежутки поперечными связками за счет взаимодействия с эпихлоргидрином.
Примерная структура ячейки сефадекса:
Чем больше число поперечных сшивок, тем меньше размеры отверстий молекулярного сита. Сефадексы очень хорошо набухают в воде, растворах солей. Получается гель-сефадекс. В зависимости от степени сшивки молекул декстрана друг с другом различные сефадексы отличаются набуханием гранул сефадекса и пределами эксклюзии (выражаемой значениями молекулярной массы веществ, еще способных входить внутрь гранул сефадекса), в связи с чем и построена классификация сефадексов.
Объекты исследования. Голубой декстран, хромат калия.
145
Оборудование и реактивы. Трубка с краном размером 20×1,2 см, софадекс G-25, голубой декстран (или гемоглобин кристаллический), хромат калия.
Выполнение работы
Сефадекс G-25 (4 г) помещают в химический стакан, заливают водой и оставляют набухать при комнатной температуре в течение 3 ч. Колонку укрепляют вертикально в штативе. Ее нижнее отверстие закрывают пробкой из стекловаты (или пористым диском из полиуретана) и наполняют на 1/3 дистиллированной водой. Из стакана с набухшим гелем сливают избыток воды, хорошо перемешивают оставшуюся в нем суспензию (объем около 50 мл) стеклянной палочкой и переносят суспензию в колонку. Нужно следить за тем, чтобы в суспензии не было пузырьков воздуха. Избыток воды из суспензии можно осторожно слить. Следующую порцию суспензии добавляют, не дожидаясь полной усадки слоя сорбента. Когда весь гель окажется в колонке, высота его должна быть около 15 см. Полностью открывают кран колонки и в течение примерно 30 мин промывают (стабилизируют) слой дистиллированной водой. При вводе в колонку растворителя нельзя обнажать поверхность слоя.
Пробу готовят, растворив 5 мг голубого декстрана и 5 мг хромата калия в 1 мл дистиллированной воды (голубой декстран растворяется медленно, лучше его растирать). В колонку добавляют небольшое количество воды, закрывают кран, пипеткой осторожно вводят в нее зеленый раствор пробы (лучше всего по стенкам трубки колонки). Затем открывают кран и после того, как проба впитается в слой геля, промывают остаток одной или двумя порциями по 1 мл воды и заливают колонку доверху водой. Больше воды в процессе данного эксперимента не добавляют. Разделенные фракции собирают в калибровочные пробирки объемом 3 мл. Однородность (чистота) зон разделенных компонентов свидетельствует о том, что колонка приготовлена правильно. Объем воды, требующийся для элюирования голубого декстрана, равен свободному объему колонки.
Работа 2. Разделение белков методом гель-фильтрации через сефадекс
Оборудование и реактивы. Спектрофотометр или фотоэлектроколориметр; коллектор фракций; колонка для гель-фильтрации; пробирки химические (150 – 200 штук); склянка на 5 л; трубки каучуковые (диаметр 0,5 - 0,7 см); зажим винтовой; насос, сефадекс G-75; хлорид натрия: С(хлорида натрия) = 0,09 моль/л; реактивы для определения белка по
146

Лоури; яичный альбумин с М = 45000, трипсин с М = 22680; рибонук-
леаза c М = 13700.
Выполнение работы
Готовят гель сефадекса. Для этого 25 г сефадекса G-75 предварительно заливают в двухлитровом стакане 1,5 л раствора хлорида натрия: C(NaCl) = 0,09 моль/л, хорошо перемешивают и оставляют на 24 ч. Через сутки набухший сефадекса промывают 5 раз раствором хлорида натрия C(NaCl) = 0,02 моль/л путем декантации. Полученным гелем сефадекса заполняют колонку. Заполнение колонки ведут осторожно, заливая его медленно и непрерывно по стенке колонки, что предохраняет от захвата им пузырьков воздуха.
Сразу после внесения сефадекса в колонке создают рабочее давление, подключая к колонке пятилитровую склянку с элюирующим раствором (раствором хлорида натрия: C(NaCl) = 0,09 моль/л). Этим раствором немедленно начинают промывку колонки и ведут ее около 12 ч.
Рис. 8.6. Установка для колоночной хроматографии: 1 - коллектор фракций; 2 - колонка с сефадексом; 3 - насос;
4 - склянка с элюирующим раствором
Содержание белка в растворе, подлежащем гель-фильтрации, должно быть около 10 мг/мл. Поэтому готовят смесь белков в соотношении: яичный альбумин – 5 мг, трипсин – 3 мг, рибонуклеаза – 2 мг и растворяют ее в 1 мл раствора хлорида натрия: C(NaCl) = 0,09 моль/л.
Перед нанесением образца, предназначенного для фракционирования, отключают склянку с элюирующим раствором от колонки. Слегка ослабляют кран колонки и устанавливают уровень элюирующего раствора вровень с поверхностью сефадекса. Осторожно, стараясь ни в коем случае не взмутить верхний слой сефадекса, пипеткой наслаивают 1 мл смеси белков. Ослабляя зажим в нижней части колонки, нанесенной образец вводят в сефадекс и очень осторожно, наслоив по каплям или по стенке при помощи пипетки элюент, подключают к колонке склянку с
147
раствором хлорида натрия: C(NaCl) = 0,09 моль/л и начинают элюцию
(рис. 8.6.).
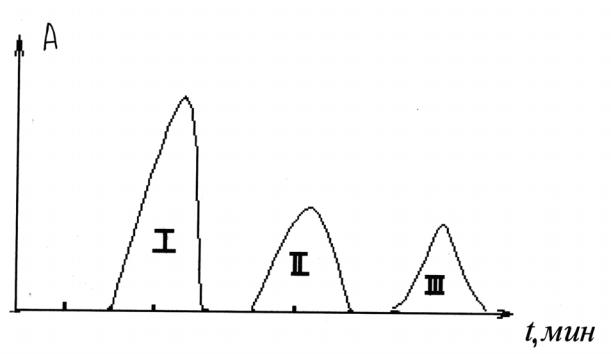
Собирают фракции по 5 мл при помощи коллектора фракций со скоростью 1 мл в минуту. Элюцию завершают после сбора 30 фракций. Содержание белка по всех исследуемых фракциях можно определять спектрофотометрически, измеряя оптическую плотность каждой пробы на спектрофотометре СФ-16 при 280 нм или на фотоэлектроколориметре, предварительно проведя цветные реакции по методу Лоури. Строят выходную кривую (рис. 8.7.).
Рис. 8.7. Выходная кривая: А - абсорбция вещества во фракциях, t - время их выхода; I, II, III - белковые фракции
Отчет по работе. Он должен содержать схему прибора, рисунок выходной кривой, построенной по результатам определения количества белков во фракциях на фотоэлектроколориметре.
148
