
- •Классификация современных методов анестезиологического пособия
- •Физико-химические свойства ингаляционных анестетиков
- •Местные анестетики эфирного типа.
- •2) Местные анестетики амидного типа.
- •Инфильтрационная анестезия.
- •3.В/венная анестезия по Биру.
- •5. Эпидуральная анестезия (эа).
- •6) Спинальная анестезия.
Вопросы терминологии, задачи и цели анестезиологического пособия.
При рассмотрении вопроса защиты организма больного от операционного стресса неизбежно приходиться сталкиваться с такими терминами как наркоз, анестезия, общая и местная анестезия, анестезиологическое пособие. Следует обратить внимание, что единой общепринятой классификации методов анестезиологического обеспечения не существует.
Наркоз (греч. narcosis оцепенение, усыпление) - искусственно вызванное состояние, характеризующееся обратимой утратой сознания, болевой чувствительности, подавлением некоторых рефлексов, расслаблением скелетных мышц (в настоящее время этот термин считается устаревшим и все реже употребляется в профессиональной литературе).
Анестезия - состояние, при котором на фоне потери или сохранения сознания частично либо полностью утрачиваются ощущения и поэтому отсутствует боль. Слово «анестезия» означает нечувствительность. Анестезия может быть местной и общей.
Примечание. Термины "общее обезболивание" и "наркоз" не полностью отражают сути происходящих процессов (например, при общей анестезии) и описывают (представляют) один из компонентов анестезиологического пособия, тогда как в анестезиологическое обеспечение оперативного вмешательства входит ряд компонентов.
Местная анестезия - осуществляется местными анестетиками путем блокады ноцицептивной импульсации в зоне проводимого оперативного вмешательства. К видам местной анестезии относятся поверхностная (терминальная) и инфильтрационная анестезии.
Общая анестезия – измененное физиологическое состояние, характеризующееся обратимой утратой сознания, полной аналгезией, амнезией и некоторой степенью миорелаксации (Морган Д., Михаил М., 1998). Является анестезиологическим методом, заключающимся в выключении сознания, анестезии с целью безболезненного проведения хирургического вмешательства и создания условий для управления функциями организма. Общая анестезия, в свою очередь, подразделяется на общую ингаляционную и общую неингаляционную анестезию.
В последние годы анестезиологи в своей практической деятельности стали использовать еще одно понятие – "тотальная внутривенная анестезия". Фактически оно идентично прежнему – "неингаляционная многокомпонентная анестезия", так как современные неингаляционные анестетики вводят, как правило, внутривенно. Тем не менее, в связи с тем, что введение некоторых из них возможно другим путем (например, в/м), в целом данное понятие имеет право на существование (Полушин Ю.С., 2004).
Анестезиологическое пособие – управление жизненными функциями организма в связи с операцией (и/или травматичной манипуляцией), предназначенное защитить организм от операционного стресса. В предоперационном периоде оно должно обеспечивать коррекцию нарушенных функций организма и создание медикаментозного фона, облегчающего проведение анестезии. В послеоперационном периоде анестезиологическое пособие должно включать коррекцию возникших функциональных расстройств, снижение реакций организма на послеоперационный стресс, управление функциями организма в новых условиях.
Термины "анестезиологическое пособие" и "анестезиологическое обеспечение операции" имеют одинаковое содержание, но последний из них определяет сущность происходящего на более высоком профессиональном уровне.
Классификация современных методов анестезиологического пособия
Применяемые в клинической практике методы обезболивания можно подразделить на местную, регионарную и общую анестезию.
Местная анестезия является результатом блокады проведения ноцицептивных импульсов непосредственно в зоне хирургического вмешательства.
Регионарная анестезия достигается блокадой ноцицептивной чувствительности в зоне иннервации определенного нерва или нервного сплетения.
Общая анестезия. Имеются различные классификации общей анестезии. Наиболее простой нам представляется следующая:
I. Ингаляционная общая анестезия – анестетик поступает в организм пациента через дыхательные пути.
1. Масочный способ – анестетик подаётся в дыхательные пути больного через маску.
2. Интубационный способ заключается во введении анестезирующих газов или паров вместе с кислородом непосредственно через трахею и бронхи в легкие. Газонаркотическая смесь подается по интубационной трубке, введённой через голосовую щель в трахею или бронх:
а) эндотрахеальный;
б) эндобронхиальный.
II. Неингаляционная общая анестезия - анестетик вводится в организм пациента, минуя дыхательные пути.
1. Сосудистый способ:
а) внутривенный;
б) внутрикостный путь введения вещества.
2. Внесосудистый способ:
а) пероральный;
б) ректальный;
в) внутримышечный путь введения вещества.
III. Комбинированная многокомпонентная анестезия представляет собой одновременное применение ингаляционных и неингаляционных методов анестезии, обычно на фоне ИВЛ.
IV. Сочетанная анестезия представляет собой сочетание местной или регионарной и компонентов общей анестезии.
V. Электроанестезия – вид общей анестезии, заключающийся в воздействии электрического тока определенных параметров на структуры мозга. Этот вид обезболивания обязательно должен сочетаться с другими компонентами современного общего обезболивания.
МЕХАНИЗМЫ ДЕЙСТВИЯ ОБЩЕЙ АНЕСТЕЗИИ
(теории наркоза)
С момента открытия эфирного наркоза (К. Лонг и У. Кларк, 1842; У. Мортон, 1846) перед исследователями неизбежно возникал вопрос о сущности и механизмах его реализации.
Одной из первых попыток объяснить возможный механизм эфирного наркоза предпринял в 1848 г. Н. И. Пирогов. На основании многочисленных экспериментов на животных и опыте применения наркоза у больных он пришел к заключению, что наркотический эффект эфира проявляется лишь тогда, когда насыщенная его парами кровь «придет в соприкосновение с органами нервной системы».
Позднее исследователями в этой области был предложен ряд гипотез (т.н. «теории наркоза»), объясняющих своеобразный эффект наркотических веществ. В данном разделе представлено описание лишь тех, которые имеют значение для современного понимания механизма развития общей анестезии.
Авторы ранних теорий общей анестезии вплоть до начала XX в., исходя из единообразия клинической картины наркоза, пытались выработать унитарный механизм действия разных анестетиков.
Теории наркоза:
1.Коагуляционная
2.Липоидная
3.Поверхностного натяжения
4.Гипоксическая
5.Мембранная
6.Ретикулярная
Так, одной из первых была коагуляционная теория (Кюн, 1864), основанная на способности диэтилового эфира и хлороформа вызывать своеобразное свертывание внутриклеточного белка с образованием зернистости в протоплазме. Позднее выяснилось, что подобные изменения происходят лишь в условиях очень высоких концентраций анестетиков, значительно превосходящих уровень, достигаемый в клинических условиях.
Липоидная теория (Германн, 1866; Мейер и Овертон, 1899—1901) была основана на двух установленных к тому времени фактах: значительной липоидотропности использовавшихся тогда наркотических веществ, а также высоком содержании липоидов в нервных клетках. Согласно этой теории, анестезия возникает благодаря растворению молекул анестетика в специфических гидрофобных молекулах. Бимолекулярный слой фосфолипидов в клеточных мембранах нейронов имеет в своем составе множество гидрофобных структур. Связываясь с этими структурами, анестетики расширяют фосфолипидный бимолекулярный слой до критического объема, после чего функция мембраны претерпевает изменения (теория критического объема). В дальнейшем было выяснено, что такая закономерность прослеживается в отношении большинства ингаляционных анестетиков, однако обнаружились исключения. Таким образом, связь между растворимостью общих анестетиков в жирах и силой их действия не оказалась универсальной.
В начале XX в. была предпринята попытка объяснить наркотический эффект применявшихся тогда общих анестетиков на основе изменений, вызываемых ими на границе водной и липопротеиновой фаз мембраны нервных клеток – теория поверхностного натяжения (Траубе, 1904) и адсорбционная теория (Лове, 1912). Последняя послужила основанием для построения очередной гипотезы, объясняющей наркотический эффект анестетиков их ингибирующим влиянием на ферментные комплексы, занимающие ключевое положение в обеспечении окислительно-восстановительных процессов в клетках (Варбург, 1911; Ферворн, 1912).
Отдельные исследования, свидетельствовавшие о подобном влиянии анестетиков на метаболизм клеток, привели к формированию гипоксической теории наркоза, в соответствии с которой торможение функции ЦНС при насыщении анестетиками жирного ряда возникает в результате нарушения энергетики клеток. Однако было выяснено, что в условиях общей анестезии клеточный метаболизм нарушается далеко не всегда. Гипоксические метаболические изменения в клетке обычно возникают лишь при высокой концентрации некоторых анестетиков в тканях, значительно превышающей использующуюся в клинических условиях. Не было получено также убедительных данных о снижении потребления кислорода клетками. Наконец, факт быстрого восстановления функций ЦНС после элиминации анестетика из организма вызывал серьезные сомнения в правильности основных положений гипоксической теории.
В 1961 г. Полинг предложил теорию водных микро-кристаллов, объясняющую развитие наркотического состояния под влиянием общих анестетиков свойством последних образовывать в водной среде тканей своеобразные кристаллы. Они, как выяснилось, создают препятствие для перемещения катионов через мембрану клетки и тем самым блокируют процесс деполяризации и формирование потенциала действия. Однако дальнейшие исследования показали, что свойством кристаллообразования обладают не все общие анестетики. Те же из них, для которых характерен этот феномен, образуют кристаллы при концентрациях, превышающих использующиеся в клинической практике.
Из всех теорий наркоза, предложенных в первое столетие со времени начала изучения механизма действия наркотических средств, наибольшее развитие в дальнейшем получила мембранная теория (Хобер, 1907; Винтерштейн, 1916). Первоначально она, как и некоторые другие теории наркоза, базировалась на данных о влиянии наркотических веществ на физико-химические свойства клеточных мембран. Развитие наркотического состояния авторы связывали с нарушением проницаемости мембран нервных клеток для метаболитов. В таком виде рассматриваемая теория не заключала в себе новых существенных элементов по сравнению с ранее разработанными теориями наркоза.
Большое значение для дальнейшего развития мембранной теории наркоза имели результаты фундаментальных исследований электрического трансмембранного потенциала и роли электрических процессов, происходящих на мембране клетки, в формировании потенциала действия и распространении возбуждения как в пределах одного нейрона, так и при межнейронных контактах.
Современные представления о механизмах общей анестезии
Одно из сложившихся представлений предусматривает влияние анестетиков на процессы образования и распространения потенциала действия на уровне самих нейронов и, прежде всего, межнейронных синапсов. Поскольку синапсы являются в рефлекторной цепи звеном не только наиболее сложным, но и наиболее подверженным влиянию на его функцию различного рода эндогенных и экзогенных факторов, тормозящее влияние анестетиков на передачу импульсов в них проявляется больше, чем на возбудимость мембраны нейрона.
Накопленные в этой области данные свидетельствуют о вероятности действия анестетиков на различные звенья синаптической передачи возбуждения. Хотя сам механизм угнетения возбудимости нейронов и торможения синаптической передачи возбуждения под влиянием анестетиков полностью не раскрыт.
Естественно, что различные анестетики неодинаково влияют на основные функциональные звенья синапсов. Это связано как с неоднородностью последних, так и с особенностями свойств отдельных анестетиков. Одни из них тормозят передачу возбуждения преимущественно на уровне терминалей нервных волокон, другие — путем снижения чувствительности рецепторов мембран к медиатору или угнетения его образования.
Косвенным подтверждением преимущественного действия общих анестетиков в зоне межнейронных контактов может служить функционирование антиноцицептивной системы организма. Она, в современном понимании, представляет собой совокупность механизмов, регулирующих болевую чувствительность и оказывающих тормозящее влияние на ноцицептивную импульсацию в целом. Больше других к настоящему времени изучен антиноцицептивный механизм, функционирующий на основе взаимодействия имеющихся в центральной нервной системе специфических рецепторов с эндогенными опиоидами.
Развитию ретикулярной теории способствовали два важных научных факта, установленных при изучении функции ретикулярной формации:
1) ее активирующая роль в отношении лежащих выше отделов ЦНС;
2) разрушение определенных зон ретикулярной формации вызывает состояние, близкое к медикаментозному сну или наркозу. Это привело к заключению о вероятной связи специфического действия наркотических веществ с их влиянием прежде всего на функцию ретикулярной формации. Экспериментальные исследования показали, что на фоне действия некоторых общих анестетиков не возникает характерная для обычных условий десинхронизация биотоков мозга в ответ на электрическое раздражение ретикулярной формации.
Таким образом, сформировалось представление о том, что эффект общих анестетиков является результатом торможения рефлекторных процессов на уровне ретикулярной формации мозга. При этом устраняется восходящее активизирующее влияние ее, что приводит к деафферентации вышележащих отделов ЦНС.
Несмотря на убедительные данные в пользу ретикулярной теории наркоза, которая получила широкое признание, результаты некоторых исследований свидетельствуют о том, что она не может быть признана универсальной. В частности, Т. М. Дарбинян и В. Б. Головчинский (1976) на основании экспериментальных данных показали, что при наркотизации диэтиловым эфиром и циклопропаном торможение функции мозга распространяется не от ретикулярной формации вверх, а в соответствии с ранее сложившимся представлением, т. е. сверху вниз.
Установлено, что общие анестетики могут влиять на ионные каналы, рецепторы трансмиттеров. Многие анестетики усиливают депрессию ЦНС, опосредованную β-аминомасляной кислотой. Агонисты ГАМК-рецепторов углубляют анестезию, в то время как антагонисты – устраняют многие эффекты анестетиков. Влияние на функцию ГАМК может быть одним из ведущих механизмов действия многих анестетиков (Tanelian D.L. и соавт., 1993).
Таким образом, несмотря на достигнутые успехи в области раскрытия физиологической сущности и механизмов действия общих анестетиков, проблема оказалась чрезвычайно сложной. Необходимо признать, что сегодня единой теории, объясняющей действия известных общих анестетиков нет.
СТАДИИ И КЛИНИКА НАРКОЗА
При введении в организм наркотических веществ установлена закономерная стадийность в клинической картине общей анестезии, которая наиболее четко проявляется при масочной общей анестезии эфиром. И хотя сегодня общая анестезия диэтиловым эфиром стала историей, в практической анестезиологии методически удобнее изучать стадии общей анестезии, типичные ответные реакции ЦНС, дыхания, кровообращения на примере ингаляционной анестезии эфиром. Первый английский анестезиолог Сноу в 1847 году опубликовал книгу «Об ингаляции эфира» и установил 5 стадий наркоза. Разработал показания и противопоказания. В 1937 году Гведел предложил свою классификацию и выделил 4 стадии наркоза, где хирургическая стадия была разделена на 4 уровня.
Из предложенных классификаций клинического течения эфирной общей анестезии наиболее широкое распространение получила классификация Гведела.
Первая стадия (аналгезии) начинается с момента вдыхания паров эфира (в концентрации эфира во вдыхаемом воздухе 1,5-2 об.%) и продолжается в среднем 6-8 мин, после чего наступает утрата сознания. Для этой стадии характерно постепенное угнетение сознания, учащение дыхания и пульса, некоторое повышение артериального давления. Тактильная, температурная чувствительность и рефлексы сохранены, болевая чувствительность резко ослаблена, что позволяет в этой стадии выполнять кратковременные хирургические вмешательства и манипуляции (т.н. «рауш-наркоз»). Продолжительность стадии аналгезии зависит от общего состояния больного, его возраста и премедикации.
Вторая стадия (возбуждения) начинается сразу же после утраты сознания и продолжается 1-5 мин, что зависит от индивидуальных особенностей больного, а также квалификации анестезиолога. Концентрацию эфира во вдыхаемой смеси увеличивают в среднем до 10-12 об.%. Вследствие выраженной симпатоадреналовой стимуляции эфиром развивается характерная клиническая картина: психомоторное возбуждение, выраженная гиперемия кожи, расширение зрачков, слезотечение, тризм жевательной мускулатуры, усиление кашлевого и рвотного рефлексов, учащение пульса (возможна аритмия) и дыхания, повышение артериального давления. Вследствие гипервентиляции и гипокапнии нередко наблюдается угнетение дыхания. Иногда в этой стадии отмечается непроизвольное мочеиспускание, довольно часто рвота.
Третья стадия (хирургическая) наступает через 12-20 мин после начала, когда по мере насыщения организма эфиром происходит углубление общей анестезии. Концентрация эфира во вдыхаемой смеси в начале развития хирургической стадии составляет 4-8 об.%, постепенно снижается и поддерживается на уровне 2-4 об.%. Клинически на фоне глубокого сна отмечаются потеря всех видов чувствительности, мышечная релаксация, угнетение рефлексов, урежение и углубление дыхания, замедление пульса, некоторое снижение артериального давления. Очень важным в этой стадии является состояние зрачков, сигнализирующее о пробуждении больного (расширение зрачков с живой реакцией на свет) или о передозировке наркотического вещества (расширение зрачка, отсутствие реакции на свет). Для контроля глубины общей анестезии и предотвращения передозировки в хирургической стадии Гведел предложил различать четыре уровня:
первый уровень хирургической стадии (III1) — уровень движения глазных яблок — характеризуется тем, что на фоне спокойного сна еще сохраняются мышечный тонус, гортанно-глоточные рефлексы. Дыхание ровное, несколько учащенное, пульс также учащен, артериальное давление на исходном уровне. Глазные яблоки совершают медленные кругообразные движения, зрачки равномерно сужены, живо реагируют на свет, роговичный рефлекс сохранен. Поверхностные рефлексы (кожные) исчезают;

Схема течения эфирного наркоза по Гведелу.
второй уровень (III2) — уровень роговичного рефлекса. Глазные яблоки фиксированы, роговичный рефлекс исчезает, зрачки сужены или слегка расширены, реакция на свет сохранена. Гортанный и глоточный рефлексы отсутствуют, тонус мышц значительно снижен, дыхание ровное, замедленное, пульс и артериальное давление — на исходном уровне, слизистые оболочки влажные, кожные покровы розовые;
третий уровень (III3) — уровень расширения зрачка. В стадии III3 появляются признаки токсического влияния эфира — зрачок расширяется вследствие паралича гладкой мускулатуры радужной оболочки, реакция на свет резко ослабевает, появляется сухость роговицы. Кожные покровы становятся бледными, резко снижается тонус мышц (сохранен только тонус сфинктеров). Реберное дыхание постепенно ослабевает, преобладает диафрагмальное, тахипноэ до 30 в минуту, вдох несколько короче выдоха, пульс учащается, артериальное давление на исходном уровне или снижено;
четвертый уровень (III4) — уровень диафрагмального дыхания — не должен допускаться в клинической практике, поскольку является признаком передозировки и предвестником летального исхода. Для него характерны резкое расширение зрачков, отсутствие реакции на свет, тусклая, сухая роговица, полный паралич дыхательных межреберных мышц; сохранено только диафрагмальное дыхание — поверхностное, аритмичное. Кожные покровы бледные с цианотичным оттенком, пульс нитевидный, учащенный, артериальное давление на предельно низких цифрах, возникает паралич сфинктеров. Если не прекратить подачу наркотического средства, то происходит дальнейшее угнетение дыхания и кровообращения (паралич дыхательного и сосудодвигательного центров) до остановки дыхания и сердечной деятельности. В течение операции глубина общей анестезии не должна превышать уровня III1— III2, и лишь на короткое время допустимо ее углубление до III3.
Четвертая стадия (пробуждения) наступает после прекращения подачи эфира и характеризуется постепенным восстановлением рефлексов, тонуса мышц, чувствительности, сознания, в обратном порядке отображая стадии общей анестезии. Следует подчеркнуть, что в стадии пробуждения обычно не бывает такого сильного возбуждения, которое отмечается в период насыщения при введении в наркотический сон. Пробуждение происходит медленно и, в зависимости от индивидуальных особенностей больного, длительности и глубины общей анестезии, продолжается от нескольких минут до нескольких часов. В стадии пробуждения сохраняется анальгетический эффект.
В связи с внедрением в практику многокомпонентной анестезии возникла проблема определения глубины анестезии. Это в первую очередь связано с применением мышечных релаксантов. Классическая клиника наркоза, большинство симптомов которой оценивалось по участию мышечной системы (дыхание, рефлексы) перестала быть информативной. Исчезла классическая стадийность наркоза.
В настоящее время в условиях комбинированной многокомпонентной анестезии выделяют три стадии наркоза:
1.-поверхностный наркоз →
2.-оптимальная глубина наркоза (хирургическая стадия наркоза III1-2)
3.-глубокий наркоз
При поверхностном наркозе сохраняется живая реакция зрачков на свет и слезотечение («больной плачет – ему больно»). Появление потоотделения, тахикардии, повышение артериального давления, двигательная реакция больного в ответ на болевой раздражитель при прекращении действия мышечных релаксантов – все это говорит о недостаточной глубине наркоза.
При оптимальной глубине наркоза-показатели гемодинамики стабильны.
При глубоком наркозе отмечается отсутствие реакции зрачков на свет и зрачкового рефлекса, сухой глаз. Со стороны сердечно-сосудистой системы - тахикардия, снижение артериального давления.
Оценка глубины общей анестезии является одной из важных проблем анестезиологии. Более точно и объективно, по сравнению с клинической картиной, установить глубину общей анестезии позволяет проведение интраоперационного BIS–мониторинга.
Метод биспектрального мониторинга предложен американской фирмой Aspect Medical Sistem. Проведена обработка параметров ЭЭГ более чем на 5000 пациентах с помощью оригинальной методики анализа сигнала BIS – числового, отражающего глубину наркоза. BIS – индекс это число на шкале от 0 до 100, соотносящееся с конкретным клиническим состоянием пациента в период действия анестетиков или гипнотиков.
Awake – бодствование; -100.
General Anestesia – общая анестезия;
Deep Hipnotic State - глубокий наркоз;
Flar Line EEG – изолиния на ЭЭГ, то есть отсутствие биоэлектрической активности мозга;- 0.
При проведении анестезии значения BIS – индекса соответствует следующим клиническим показателям глубины седации:
100 – 90 – бодрствование;
90 – 70 – лёгкая седация;
70 – 60 – глубокая седация;
60 – 40 – хирургическая стадия наркоза; идеально 60 – 50.
40 – 20 – глубокий наркоз.
Ниже 20 подавление вспышек ЭЭГ.
0 – изолиния на ЭЭГ.
Понятие «адекватность анестезиологического пособия» несет в себе некоторую неопределённость. Показатели гемодинамики используемые в качестве критерия не отражает критериев мозговой активности.В этом плане BIS – мониторинг предоставляет врачу ценные данные о мозговой активности в режиме реального времени. Благодаря этому существенно облегчается:
Оценка состояния пациента во время операции
Подбор доз анестетика
Титрование анестетика
Выход пациента из наркоза.
Возможность точно титровать анестетик достигая необходимой глубины анестезии, избегая передозировки, снижается расход препаратов, способствует снижения частоты послеоперационного делирия, путём снижения эпизодов очень глубокой анестезии.
АППАРАТУРА ДЛЯ НАРКОЗА
Основными техническими средствами обеспечения общей анестезии являются аппараты ингаляционного наркоза (ИН) и искусственной вентиляции легких (ИВЛ).
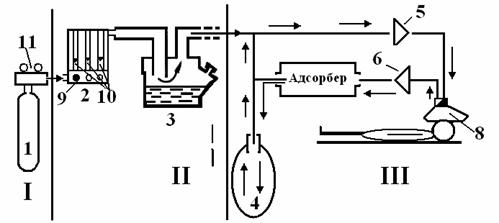
Схема наркозного аппарата, основные узлы.
Аппараты ИН предназначены для получения газонаркотической смеси с относительно точным дозированием в ней концентрации анестетиков и обеспечения условий, позволяющих поддерживать во вдыхаемом воздухе необходимое содержание кислорода и углекислоты. Все современные аппараты ИН дают возможность проводить ИВЛ ручным способом и в автоматическом режиме.
Несмотря на разнообразие конструкций, принципиальные схемы устройства аппаратов ИН имеют много общего (рис. 9.2.).

Условная схема наркозного аппарата.
I. Источник газов. Газовый баллон (1) с редуктором (11).
II. Блок дозиметров и испаритель для летучих анестетиков. Блок дозиметров (2) - ротаметры по кислороду и закиси азота с поплавками (10), кнопка экстренной подачи кислорода (9), испаритель (3).
III. Дыхательный контур. Дыхательный мешок, или мех наркозного аппарата (4), клапан вдоха (5), клапан выдоха (6), клапан разгерметизации системы (7), маска наркозного аппарата (8), адсорбер.
Во всех аппаратах газонаркотическая смесь формируется с помощью дозиметров газов и испарителей летучих анестетиков. Она поступает в дыхательный мешок (мех), а затем через клапан вдоха и приводящий шланг подается больному. В большинстве моделей современных аппаратов предусмотрена возможность рециркуляции выдыхаемой газовой смеси. При этом она проходит от больного по второму шлангу через клапан выдоха и в зависимости от избранного контура дыхания полностью (закрытый контур) или частично (полузакрытый контур) поступает в циркуляцию, освободившись предварительно в адсорбере от углекислого газа. Аппараты рассматриваемого типа позволяют проводить анестезию и по полуоткрытому контуру.
Источники газов. Осуществление анестезии и ИВЛ с помощью современных технических средств обычно связано с использованием сжатых медицинских газов, главным образом кислорода и закиси азота. Эти газы поступают к аппаратам ИН и ИВЛ из системы центрального снабжения или непосредственно из баллонов. В кислородных баллонах, которые принято окрашивать в голубой цвет*, первичное давление равно 15 МПа (150 атм.). Следовательно, в расчете на атмосферное давление в баллоне объемом 40 л содержится 6000 л газа, а в баллоне объемом 10 л его количество составляет 1500 л.
Газ |
Емкость, м3 |
Давление, при 200С |
Цвет баллона |
Кислород |
40 ,10, 5, 2,1 |
150 атм. |
Голубой* |
Закись азота |
10 |
50 атм. |
Серый |
*В Европе цвет кислородного баллона – белый
Закись азота поступает в лечебные учреждения в баллонах объемом 10 л в сжиженном состоянии. После заполнения закисью азота каждый баллон на заводе взвешивают и отмечают на прикрепленной к нему бирке количество анестетика в килограммах. Закись азота, находящаяся над уровнем жидкости в газообразном состоянии, при комнатной температуре создает давление около 5 МПа (50 атм.).

Определение количества закиси азота в баллоне
(А.З. Маневич, 1984)
В процессе эксплуатации баллона это давление остается неизменным до полной газификации жидкой закиси азота. Дальнейшее использование анестетика сопровождается снижением давления. При газификации 1 кг закиси азота образуется 500 л газа.
Редукторы, предназначаемые для баллонов с кислородом и закисью азота, не однотипны. Для первых предпочтительны двухкамерные редукторы, снабженные двумя манометрами, один из которых отражает давление в баллоне, второй — на выходе газа из редуктора. Это давление устанавливают с помощью специального вентиля обычно в пределах 200—400 кПа (2—4 атм.). На баллоны с закисью азота рекомендуется устанавливать редукторы с ребристой поверхностью корпуса, которая в значительной степени предупреждает обледенение внутри редуктора, связанное с содержанием в закиси азота небольшого количества паров воды.
Дозиметры и испаритель.
Дозиметры служат для регулирования и измерения потока газов, поступающих в аппарат ИН по шлангам из системы снабжения ими. В аппаратах с постоянным потоком газов предусмотрены дозиметры, представляющие собой совокупность ротаметрических трубок, в каждой из которых поток газа дозируется изменением уровня поплавка (рис. 9.4.). Точность дозировки в таких аппаратах зависит от максимального газотока, на который рассчитана данная ротаметрическая трубка.

Дозиметр ротаметрического типа.
Более современные электронные дозиметры позволяют с высокой точностью регулировать даже минимальный поток газов.
Испарители предназначены для превращения жидких общих анестетиков, обладающих высокой летучестью, в пар и дозированного поступления его в дыхательную систему. Современные специализированные испарители (т.е. предназначенные только для одного анестетика) способны обеспечить постоянную концентрацию анестетика независимо от температуры или потока через испаритель и располагаются вне дыхательного контура.
Дыхательный блок аппаратов ИН.
В этот блок входят адсорбер, дыхательные клапаны, дыхательный мешок и шланги.
Адсорбер служит для поглощения углекислоты содержащейся в нем натронной известью в условиях реверсивного контура дыхания. Он не предусмотрен лишь в тех аппаратах ИН, которые предназначены для анестезии при открытом и полуоткрытом контурах дыхания.
Поглотителем служит гранулированная масса, близкая по составу к натронной извести. Химическая нейтрализация углекислоты сопровождается нагреванием адсорбера, (адсорбенты с цветовым индикатором изменяют цвет) причем теплообразование больше выражено при замкнутом контуре. Объективные данные о полноценности функционирования адсорбера можно получить путем капнометрии во вдыхаемой газовой смеси.
Клапаны большинства аппаратов ИН представлены двумя дыхательными, предохранительными и нереверсивными. Дыхательные клапаны вдоха и выдоха обеспечивают направление газового потока. Неполноценная работа их нарушает циркуляцию газов в аппарате и может быть причиной недостаточной вентиляции легких. Предохранительный клапан, или клапан разгерметизации, предназначен для сброса в атмосферу газовой смеси, когда давление ее в системе дыхания выходит за пределы предусмотренного.
С функцией дыхательного блока непосредственно связаны такие факторы, как дыхательный контур, динамика концентрации анестетика во вдыхаемой газовой смеси, сопротивление дыханию, мертвое пространство. В зависимости от источника газов, поступающих в дыхательный блок, и степени герметизации последнего различают четыре контура дыхания: открытый, полуоткрытый, полузакрытый и закрытый. При первом из них в аппарат поступает воздух из атмосферы, и выдох происходит тоже в атмосферу.

Открытый контур.
Полуоткрытый контур характеризуется тем, что газы поступают из замкнутой системы
Полузакрытый и закрытый контуры соответственно отличаются от предыдущего частичным или полным возвращением выдыхаемого воздуха в дыхательный блок аппарата.
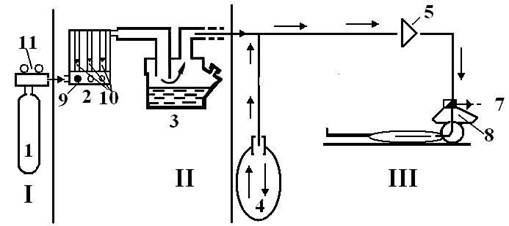
Рис. 9.6. Полуоткрытый контур.
Закрытый контур с испарителем вне круга циркуляции газов.
Особенностью полузакрытого контура является то, что доля выдыхаемого воздуха, возвращаемая в дыхательный блок аппарата, может варьировать в широких пределах.
Одно из преимуществ ингаляционной анестезии - возможность быстрого управления альвеолярной концентрацией анестетика (глубиной анестезии). Такая возможность чаще всего реализуется путем подачи в контур большого количества летучих анестетиков за короткий промежуток времени, т. е. при высоком потоке свежего газа. Вместе с тем, традиционная анестезия с высоким газотоком имеет и свои серьезные недостатки, которые состоят в большом расходе анестетика, значительных потерях тепла и влаги из дыхательных путей, загрязнении окружающей среды и воздуха в операционной. Снижение газотока в дыхательном контуре позволяет избежать всех этих негативных явлений, что определяет значительный интерес анестезиологов к методам ингаляционной анестезии на основе низких потоков свежего газа.
Классификация дыхательных контуров в зависимости от величины газотока
газоток в контуре (N2O+O2) |
название |
>4 л/мин |
высокий газоток high flow anesthesia |
1,0–0,5 л/мин |
низкий газоток low flow anesthesia |
< 0,5 л/мин |
минимальный газоток minimal flow anesthesia |
= поглощению газов и паров анестетика организмом в данный момент времени |
закрытый контур closed system anesthesia |
ИСКУССТВЕННАЯ ВЕНТИЛЯЦИЯ ЛЕГКИХ.
Искусственная вентиляция лёгких (ИВЛ) – это форма вентиляции, призванная решать задачу, которую в норме выполняют дыхательные мышцы.
ИВЛ замещает или дополняет газообмен в легких. В большинстве случаев (в условиях отделений интенсивной терапии) ее проводят в связи с невозможностью элиминации СО2 (гиперкапническая форма дыхательной недостаточности) либо при гипоксемии. В анестезиологической практике ИВЛ является компонентом общей анестезии. Таким образом, в настоящее время четко различают две сферы применения ИВЛ — как компонента комбинированной анестезии и как один из самых важных способов интенсивной терапии и реанимации.
Основные различия между спонтанным дыханием и искусственной вентиляцией легких.
Прежде всего, совершенно очевидны различные источники управления дыханием. При спонтанном дыхании объем вентиляции, адекватный потребностям газообмена, регулируется дыхательным центром, который направляет деятельность дыхательных мышц для поддержания газового гомеостаза.
В отличие от этого ИВЛ предполагает внешний контроль объема вентиляции и, в конечном счете, газообмена со стороны врача, который должен выполнять функцию «искусственного дыхательного центра» больного. В условиях общей анестезии помимо газообмена, на дыхание возлагается еще одна задача — насыщение организма анестетиком и выведение ингаляционного анестетика после операции.
Кроме того, при ИВЛ принципиально меняется физиология дыхания, что порой играет большую роль в возникновении нежелательных эффектов, сопровождающих замену спонтанного дыхания искусственным. В физиологических условиях дыхательные мышцы, увеличивая размер грудной клетки, создают отрицательное давление в легких, и в них поступает определенный объем воздуха. Возникающая разница давлений обычно невелика и достигает 1—2 см водного столба (вод. ст.). После того как вдох заканчивается, давление в альвеолах снова повышается до атмосферного. Во время выдоха давление в альвеолах вновь изменяется: оно превышает атмосферное на несколько см водяного столба и снова снижается до атмосферного в конце выдоха.
Принципиально иные условия создаются при ИВЛ. Во время вдоха, когда в легкие поступает, допустим, 800 мл газа, при податливости, равной 0,05 л/см вод. ст., альвеолярное давление составит 16 см вод. ст. К концу выдоха оно понизится до атмосферного.
Разница между двумя типами вентиляции закономерно отражается и на сдвигах внутриплеврального давления. При спонтанном дыхании внутриплевральное давление, равное в конце выдоха -5 см вод. ст., к концу вдоха снижается до -10 см вод. ст. и вновь повышается до -5 см вод. ст. во время выдоха. В процессе ИВЛ (при тех же условиях) внутриплевральное давление растет во время вдоха от -5 до +3 см вод. ст., снижаясь до -5 см вод. ст. к концу выдоха.
Таким образом, в условиях спонтанной вентиляции и альвеолярное, и внутриплевральное давление во время вдоха наименьшее, а во время выдоха наибольшее.
ИВЛ характеризуется обратным соотношением. Это обстоятельство создает предпосылки для проявления побочных и вредных эффектов ИВЛ.
В обычных условиях дыхательные движения и соответствующие колебания давления в грудной клетке служат дополнительным механизмом, способствующим притоку крови к сердцу и обеспечивающим необходимый сердечный выброс (так называемая дыхательная помпа). Изменения величины и направленности сдвигов давления во время ИВЛ в большей или меньшей степени нарушают этот механизм, что и обусловливает нежелательный циркуляторный эффект (нарушение вентиляционно-перфузионных отношений).
Методы и режимы ИВЛ, выбор параметров вентиляции
Существует два принципиально отличающихся метода ИВЛ: вентиляция с положительным давлением (аппарат обеспечивает доставку дыхательной смеси в дыхательные пути посредством периодически генерируемого положительного давления) и вентиляция с отрицательным давлением (аппарат ИВЛ создает отрицательное давление вокруг тела больного, благодаря чему дыхательная смесь поступает в легкие - кирасный метод). Наибольшее распространение получила ИВЛ под положительным давлением, в то время как вторая методика практически не используется.
Вентиляция с положительным давлением может быть через эндотрахеальную трубку или через лицевую маску, с переключением фаз по объёму и по давлению.
Многочисленные режимы ИВЛ подразделяются на:
* принудительные (CMV, AC, IPPV, VC, PC и др.),
* вспомогательные (CSV, CPAP, PS, PSV, ASV и др.),
* комбинированные (IMV, SIMV и др.) и * двухфазные (BIPAP, APRV и др.) (А.С. Горячев, И.А. Савин Основы ИВЛ, 2009).
Также выделяют высокочастотную ИВЛ (HFV, HFJV, HFOV).
Выбор параметров вентиляции во многом определяется показаниями для ИВЛ. Так, если речь идет о проведении комбинированной общей анестезии с использованием миорелаксантов, то вентиляция проводится в режиме принудительной ИВЛ с целью поддержания адекватного газообмена. Большинство пациентов с острой дыхательной недостаточностью (ОДН) нуждаются в полной заместительной вентиляции. Главными задачами при этом становятся нормализация газового гомеостаза и предотвращение связанных с ИВЛ осложнений. В этом случае чаще всего начинают с режима ИВЛ, гарантирующего поступление заданного объёма. Необходимо выбрать содержание кислорода на вдохе (FiO2). Обычно начинают с 1,0, медленно снижая до минимальной концентрации, переносимой пациентом. Длительное воздействие высоких значений FiO2 (> 0,6-0,7, что соответствует 60-70%) может сопровождаться токсическим действием кислорода.
Дыхательный объём подбирается с учётом массы тела и патофизиологических механизмов повреждения лёгких. В настоящее время приемлемым считается установка объёма в пределах 8-10 мл/кг массы тела. Однако при повреждении легких различного генеза их податливость (комплайнс) снижается. Поскольку высокие значения давлений и объёмов могут ухудшать течение основного заболевания, используют меньшие объёмы – в пределах 6-8 мл/кг. Большинство современных аппаратов ИВЛ автоматически рассчитывают ориентировочный дыхательный объем и прочие параметры вентиляции по введенным значениям массы пациента.
Частота дыхания (ЧД), как правило, устанавливается в диапазоне 10 – 16 в минуту. В конечном итоге адекватность выбранного режима вентиляции и его параметров контролируется периодической оценкой состояния пациента, непрерывным мониторингом ЭКГ, оценкой насыщения крови кислородом и содержанием углекислого газа.
Отрицательные эффекты искусственной вентиляции легких
Основным побочным эффектом ИВЛ является ее отрицательное воздействие на кровообращение, которое можно отнести к числу почти неизбежных недостатков метода. Как было отмечено выше, причиной тому служит нарушение нормальной физиологии механики дыхании при его аппаратном протезировании.
На фоне ИВЛ повышается ЦВД. Градиент давления между периферическими и центральными венами уменьшается, венозный возврат, а вслед за ним сердечный выброс и артериальное давление снижаются. Этому способствует эффект мышечных релаксантов, выключающих скелетную мускулатуру, сокращения которой в обычных условиях служат «периферическим сердцем». Отмеченные сдвиги быстро компенсируются рефлекторным повышением тонуса периферических вен (а возможно, и мелких артерий, так как периферическое сопротивление возрастает), градиент венозного давления увеличивается, что содействует восстановлению нормальной величины сердечного выброса и артериального давления.
В описанном процессе компенсации существенное значение приобретают нормальный объем циркулирующей крови (ОЦК), сохранение способности сердечно-сосудистой системы к приспособительным реакциям и т. д.
Например, выраженная гиповолемия сама по себе вызывает интенсивную вазоконстрикцию, и дальнейшая компенсация уже невозможна. Гиповолемия особенно опасна при применении ПДКВ, воздействие которого на кровообращение еще более выражено. Столь же очевидна возможность осложнений на фоне тяжелой сердечно-сосудистой недостаточности.
Повышение внутригрудного давления при ИВЛ отрицательно воздействует на легочный кровоток. При выраженном повышении альвеолярного давления легочные капилляры частично или полностью сдавливаются, в результате чего:
1) уменьшается количество крови в легких, с перемещением ее на периферию, что и является одним из механизмов повышения венозного давления;
2) увеличивается нагрузка на правый желудочек, что в условиях сердечной патологии способно вызвать правожелудочковую недостаточность.
Таким образом, отличия механики ИВЛ от спонтанного дыхания не проходят бесследно для больного. Вместе с тем большинство больных способны компенсировать эти изменения, и клинически у них не обнаруживают никаких патологических сдвигов. Только у больных с расстройствами кровообращения той или иной этиологии, когда приспособительные возможности понижены, ИВЛ может быть причиной осложнений.
Другие нежелательные эффекты ИВЛ могут быть связаны с тем обстоятельством, что начальный выбор параметров ИВЛ имеет ориентировочный характер и не основывается на обратной связи с потребностями организма, предполагает возможность некоторых нарушений. Например, неверно заданный объем вентиляции неизбежно приводит к сдвигам газообмена, в основе которых лежит гипо- или гипервентиляция.
Наконец, можно упомянуть снижение диуреза, обусловленное ИВЛ. Этот эффект длительной ИВЛ опосредуется через антидиуретический гормон. Однако нет четко подтвержденных данных, которые свидетельствовали бы о подобном значении относительно кратковременного (несколько часов) периода ИВЛ во время анестезии.
Конструкция современной наркозно-дыхательной аппаратуры позволяет, если и не исключить, то, во всяком случае, в значительной мере минимизировать отрицательные эффекты ИВЛ.
Абсолютные и относительные показания к ИВЛ.
ИВЛ показана при многих патологических состояниях. К главным причинам применения ИВЛ относятся неспособность к достаточной оксигенации и утрата адекватной альвеолярной вентиляции, что может быть связано либо с первичным паренхиматозным поражением лёгких (например, при пневмонии или отёке лёгких), либо с системными процессами, опосредованно поражающими функцию лёгких (как это происходит при сепсисе или нарушениях функции центральной нервной системы).
Главная задача ИВЛ в условиях дыхательной недостаточности – поддержание газообмена до тех пор, пока не будет устранен патологический процесс, вызвавший эту недостаточность. Решение о переводе на ИВЛ принимают на основании клинической картины, учитывая при этом результаты некоторых лабораторных и инструментальных методов (Морган Дж. и Михаил М., 2006).
Абсолютные показания для проведения ИВЛ
Газы артериальной крови |
Измеряемые показатели: РаО2 < 50 мм рт. ст. при дыхании атмосферным воздухом, или РаСО2 > 50 мм рт. ст. в отсутствие метаболического алкалоза Расчетные показатели: РаО2/FiО2 < 250 Альвеолярно-артериальный градиент > 350 мм рт. ст. |
Клинические симптомы |
Частота дыханий > 35 в мин |
Функция внешнего дыхания |
Дыхательный объем < 5 мл/кг ЖЕЛ < 15 мл/кг Максимальная сила вдоха > -25 см водного столба |
К относительным показаниям ИВЛ при проведении общей анестезии можно отнести:
1) внеполостные операции, длительностью более 1,5-2 час;
2) небольшие оперативные вмешательства у больных, страдающих сопутствующими заболеваниями и метаболическими нарушениями (хронические заболевания легких и сердца, нарушения КОС и водно-электролитного баланса и др.).
Аппараты для ИВЛ, их классификация, принцип работы
Сложное устройство современных аппаратов ИВЛ затрудняет их классификацию. Тем не менее, аппараты ИВЛ чаще всего классифицируют на основании характеристик вдоха и способа переключения со вдоха на выдох.
По характеристике вдоха их подразделяют на:
генераторы постоянного потока, обеспечивающие постоянный инспираторный поток газа независимо от давления в дыхательном контуре,
генераторы непостоянного потока, когда инспираторный поток газа меняется с каждым дыхательным циклом, чаще всего имеет синусоидальную форму.
По типу переключения с вдоха на выдох аппараты ИВЛ делят на аппараты с переключением:
по времени (переключаются с вдоха на выдох через определенный промежуток времени после начала вдоха), при этом дыхательный объем зависит от установленной продолжительности вдоха и объемной скорости инспираторного потока газа,
по объему (переключаются на выдох после достижения заданного дыхательного объема), используются чаще всего при проведении ИВЛ у взрослых,
по давлению (переключаются с вдоха на выдох, когда давление в дыхательных путях достигает заданного уровня),
по потоку (снабжены датчиками давления и потока, при достижении инспираторного потока газа заданного уровня аппарат переключается на выдох).
Аппараты ИВЛ работают от пневматического или электрического привода, иногда в одной модели сочетаются оба привода. Поток дыхательной смеси поступает либо непосредственно от источника газа, находящегося под давлением, либо генерируется с помощью вращающегося или линейного поршня. Этот поток или поступает непосредственно к больному (одноконтурная система), или, что более распространено, периодически сжимает резервуарный мешок или мех, который является частью дыхательного контура больного (двухконтурная система).
Цикл работы любого аппарата ИВЛ можно подразделить на 4 фазы: вдох, переключение с вдоха на выдох, выдох, переключение с выдоха на вдох. Регулирование этих фаз определяет дыхательный объем, частоту дыхания, продолжительность вдоха, инспираторный поток газа и продолжительность выдоха.
КОМПОНЕНТЫ ОБЩЕЙ АНЕСТЕЗИИ
Современная концепция общей анестезии опирается главным образом на такие понятия, как адекватность и компонентность анестезии. Под адекватностью анестезии понимают не только соответствие ее уровня характеру, выраженности и длительности операционной травмы, но и учет требований к ней в соответствии с возрастом пациента, сопутствующей патологии, тяжестью исходного состояния, особенностями нейровегетативного статуса и т. д. При этом адекватность анестезии обеспечивается с помощью управления различными компонентами анестезиологического пособия.
Долгие годы наркоз был однокомпонентным. Становлением новой эры общей анестезии можно считать 1942 год, когда канадские ученые Гарольд Гриффит и Энид Джонсон (Griffith and Johnson) применили для мышечной релаксации во время наркоза очищенный препарат кураре – интокострин. Если до этого времени существовал мононаркоз, когда одним препаратом достигалось и торможение психического восприятия, и анальгезия, и мышечная релаксация, то теперь анестетик требовался только для торможения психического восприятия и анальгезии, а мышечная релаксация достигалась другим препаратом. Таким образом, отпадала нужда в углублении наркоза только ради удобства проведения операции в условиях расслабленной скелетной мускулатуры. Токсичность наркоза резко снизилась, уменьшился риск, связанный с ним. Так возник второй компонент общей анестезии - миорелаксация.
Возникновение третьего компонента связано с именами Лабори и Гюгерара (Laborit, Huguenar, 1951) и Де Кастро и Манделира (de Castro, Mundeleer, 1959). Благодаря разработкам этих ученых стала применяться нейролептанальгезия для обеспечения адекватной нейровегетативной блокады и центральной аналгезии.
Компоненты общей анестезии
Компонент |
Проявление |
Чем достигается |
1.Торможение психического восприятия боли |
Сон |
Анестетики (ингаляционные и неингаляционные) |
Гипорефлексия – блокада всех видов афферентной импульсации, в том числе и болевой, а также предупреждение и торможение вегетативного компонента боли и различных патологических рефлексов. Включает в себя центральную аналгезию и нейровегетативную блокаду |
||
2.Центральная аналгезия |
Блокада болевых афферентных импульсов |
Анальгетики (фентанил, морфин) |
3.Нейровегетативная блокада |
Торможение вегетативных реакций |
Нейролептики (дроперидол) |
4.Мышечная релаксация |
Выключение двигательной активности |
Мышечные релаксанты (сукцинилхолин, рокурония бромид (Эсмерон♠), цис-атракурий (Нимбекс♠) и др.) |
5.Управление гемодинамикой |
Управляемая гемодинамика |
Контроль ОЦК, инфузионно-трансфузионная терапия, управляемая гемодилюция. |
6.Управление газообменом |
Адекватная вентиляция |
Интубация, ИВЛ |
7.Управление обменными процессами |
Температура тела, биохимические показатели |
Поддержание температурного режима. Коррекция КОС, электролитного баланса, и др. |
|
|
|
В настоящее время оптимальным способом проведения общей анестезии является многокомпонентный принцип.
Для того чтобы поддержать адекватную анестезию и выполнить принцип многокомпонентности, в современной анестезиологии используются различные фармакологические средства, соответствующие тем или иным основным компонентам анестезии - гипнотики, анальгетики, мышечные релаксанты.
Принцип многокомпонентности в современной анестезиологии находится в полном соответствии с принципом индивидуализации проведения общей анестезии, дающий возможность использования в зависимости от потребностей хирургии более простых или более сложных методик. При кратковременных и малотравматичных вмешательствах вполне приемлемы более простые способы анестезии, если в этих случаях они отвечают изложенным требованиям. С другой стороны, обязательным условием успеха сложных, длительных и травматичных операций является применение комбинированных методов анестезии с использованием ряда основных и вспомогательных средств, дополняющих друг друга.
Таким образам, разделение анестезии на отдельные компоненты, избирательно регулируемые анестезиологом, позволяет ему действовать в зависимости от ситуации.
К дополнительным компонентам общей анестезии в специализированных областях хирургии (нейрохирургия, кардиохирургия) относятся: искусственная гипотермия, искусственная гипотония, кардиоплегия, электрокардиостимуляция и другие.
ИНГАЛЯЦИОННАЯ ОБЩАЯ АНЕСТЕЗИЯ.
ВИДЫ И МЕТОДЫ
Ингаляционная общая анестезия — распространенный вид общей анестезии. Она достигается введением в организм летучих или газообразных анестетиков. Собственно ингаляционным можно назвать только тот метод, когда больной вдыхает анестетик при сохраненном спонтанном дыхании. Если же ингаляционный анестетик вводят в легкие принудительно, то это инсуфляционный метод. В связи с отсутствием принципиальной разницы в механизме развития общей анестезии при этих методах их объединяют под общим названием «ингаляционная общая анестезия». Существует два основных способа проведения ингаляционной анестезии: масочный и эндотрахеальный.
Спектр ингаляционных анестетиков в современной анестезиологии включает такие средства как галотан (Наркотан♠; Флюотан♠; Фторотан♠), метоксифлуран (Пентран♠), энфлуран (Этран♠), изофлуран (Аерран♠; Форан♠), десфлуран (Suprane♠), севофлуран (Севоран♠), закись азота, ксенон (см. раздел 12.1.). Эфир и хлороформ из-за выраженной токсичности и огнеопасности сегодня являются историей анестезиологии.
Ингаляционный (в англоязычной литературе - "летучий" (volatile) анестетик из испарителя наркозного аппарата в процессе вентиляции поступает в альвеолы, общая поверхность которых составляет более 90 м2. Поступление ингаляционных анестетиков из дыхательной системы в кровь, их распределение в тканях организма и последующее выведение происходят согласно законам диффузии. Быстрота развития наркотического эффекта, глубина анестезии, скорость пробуждения зависят от многих факторов, среди которых ведущее значение имеют парциальное давление анестетика во вдыхаемой смеси, объем альвеолярной вентиляции, диффузионная способность альвеолярно-капиллярной мембраны, альвеоловенозный градиент парциальных давлений общего анестетика, его растворимость в крови и тканях, объем кровотока в легких, состояние кровообращения в целом. При этом в таких органах, как мозг, печень, почки, сердце, напряжение анестетика растет быстро, параллельно увеличению его напряжения в легких. В отличие от этого, в мышцах и, особенно, в жировой ткани напряжение анестетика растет очень медленно и значительно отстает от легких.
Некоторую роль в развитии анестезии имеет метаболизм ингаляционного средства в организме. Так как метаболическая трансформация или незначительна (20% у галотана) или очень низка (у других современных препаратов), имеется определенная взаимосвязь между величиной вдыхаемой концентрации и достижением этой концентрации в тканях организма. Прямая пропорциональная зависимость относится только к закиси азота, которая не подвергается метаболизму. Для остальных анестетиков этот эффект проявляется только при очень высоких вдыхаемых концентрациях.
