
Физколлоидная химия, экзамен / Физическая химия всё-всё
.pdf
отношение произведения равновесных активностей (концентраций) продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к такому же произведению активностей (концентраций) исходных веществ при данной температуре есть величине постоянная, называемая константой химического равновесия.
Константы равновесия зависят от природы реагентов, от температуры и не зависят от концентрации (Кс), активности (Ка), давления (Во) и фугитивности (Кf). Константы равновесия КС и Кр безразмерны только для реакций, идущих без изменения числа молей газообразных участников. В остальных случаях Кр имеет размерность давления, а Кс - размерность концентрации в степенях ∆v:
Парциальные давления и концентрации индивидуальных веществ в твёрдом и жидком состояниях принимают за единицу.
N2(г)+3Н2(г)=2NH3 (г)
а)при увеличении концентрации NН3 в 2 раза - не изменится
б)при уменьшении температуры - Кс увеличится (так как реакция экзотермическая??)

Экзотермические реакции протекают с выделением теплоты, а при увеличении температуры константа равновесия уменьшается.
30. Химическое равновесие. Термодинамические критерии химического равновесия для закрытых термодинамических систем в случае, когда реакция протекает при V, T= const и при Р, T = const. Напишите выражение для константы равновесия системы:H3PO4 = H+ + H2PO4–. Как повлияет на смещение равновесия а) прибавление к раствору соляной кислоты; б) прибавление к раствору дигидрофосфата натрия; в) прибавление к раствору катализатора; г) прибавление к раствору КОН?
V,T = const: dF = 0, F = Fmin p,T = const: dG = 0, G = Gmin
31.Уравнение изотермы химической реакции. Запишите выражение для константы равновесия для реакции. СН3СООН(ж) + С2Н5ОН(Ж) СН3СООС2Н5(ж) + Н2О(ж), (ΔН° = 7 кДж/моль). Как будет изменяться равновесная концентрация СН3СООС2Н5 и константа равновесия (увеличится, уменьшится, не изменится) при: а) уменьшении концентрации Н2О; б) добавлении в систему СН3СООН; в) увеличении давления в 3 раза; г) понижении температуры? Ответ обоснуйте.
Чтобы вывести уравнение изотермы рассмотрим реакцию:
vaA + vbB = vcC + vdD, протекающую при постоянных давлениях и температуре.
Изменение энергии Гиббса: ∆Gr = (μjvj) прод - (μini)исх = (vCμC + vDμD - vAμA - vBμB)
С учётом того, что μi = μ i + RT ln pi* и dG = dμi, получаем:
∆Gr = (vCμ C + vDμ D - vAμ A - vBμ B) + RT (vC lnpC + vD lnpD - vA lnpA - vB lnpB) (1)
Если представить, что в системе наступило равновесие, то ∆Gr = 0, то уравнение превращается:
vCμ C + vDμ D - vAμ A - vBμ B = - RT (vC lnp C + vD lnp D - vA lnp A - vB lnp B) (2)

Подставим вместо vCμ C + vDμ D - vAμ A - vBμ B в уравнение (1) правую часть уравнения (2) и получим:
Эти уравнения называют уравнениями изотермы химической реакции или уравнениями Я. Вант-Гоффа. Они показывают зависимость между изменением температуры гемодинамического потенциала (∆Gr или ∆Fr), константой химического равновесия (Kp или Kc) и условиями проведения реакции. Условия проведения реакции выражаются первым членом в скобках. В него входят парциальные давления (концентрации) участников в исходном состоянии. Второй член в скобках (ln Kp или ln Kc) содержит эти величины в равновесном состоянии.
По уравнению изотермы химической реакции можно рассчитать изменение энергий Гиббса и Гельмгольца при соответствующих условиях, то есть определить возможность, направление и предел протекания самопроизвольного процесса.

Эндотермические реакции протекают с поглощением теплоты, а при увеличении температуры константа равновесия увеличивается.
32. Влияние температуры на константу равновесия. Приведите уравнения изобары Вант-Гоффа в дифференциальной и интегральной формах. Схематически изобразите графики зависимости КР от Т и In КР от 1/Т для эндотермической и экзотермической реакций.
Химическое равновесие может смещаться при изменении внешних условий, то есть является динамическим, что выражается в изменении константы химического равновесия.
Уравнение, показывающее зависимость константы равновесия от температуры, получают из уравнений изотермы Вант-Гоффа и Гиббса - Гельмгольца:
В этих уравнениях dlnKp/dT и dlnKс/dT называют температурными коэффициентами логарифма константы химического равновесия, то есть изменили lnKp и lnKc с изменением температуры на единицу. В правую часть уравнений входит тепловой эффект химической реакции. Отсюда следует, что зависимость константы равновесия от температуры определяется знаком и величиной теплового эффекта реакции. Например, для экзотермических реакций ∆Hr < 0, dlnKp/dT < 0 и Кр уменьшается при увеличении температуры.

Для количественной оценки влияния температуры на константу равновесия уравнение изобары (изохоры) необходимо интегрировать в требуемом интервале температур T1 - T2, считая тепловой эффект в этом интервале температур постоянным:
33. Постулат Планка как формулировка третьего закона термодинамики. Применение Постулата Планка к расчету абсолютных значений энтропий чистых веществ. Как рассчитать изменение энтропии для химических реакций на основании значений стандартных энтропий участников химической реакции.
Если в уравнении энтропии заменить значение δQ на CpdT, то получим: dS = CpdT/T
Интегрирование этого выражения от абсолютного нуля до температуры Т приводит к выражению:

 , где S0 и Sτ - энтропия вещества при абсолютном нуле и температуре Т соответственно.
, где S0 и Sτ - энтропия вещества при абсолютном нуле и температуре Т соответственно.
Определяя энтропии вещества при разных температурах, Нернст пришёл к выводу, что изменение энтропии многих процессов при температурах, близких к абсолютному нулю, пренебрежительно мало. Позднее Планк, Льюис и Рендал выдвинули постулат о том, что при абсолютном нуле энтропия S0 чистого кристаллического вещества без дефектов в кристаллической решётке равна нулю (следовательно, можно сказать, что при абсолютном нуле температуры изменение энтропии конденсированных тел равно нулю). Этот постулат Планка настолько важный, что получил название третьего закона термодинамики. Энтропию, найденную относительно S0 = 0, называют абсолютной энтропией. Она, естественно, всегда положительна.
В расчётах используют стандартную энтропию Sº298. Стандартной называют энтропию при стандартном давлении и температуре (298 К):
34. Что называется фазой, числом компонентов, вариантностью системы? Перечислите условия фазового равновесия.
Запишите уравнение КлапейронаКлаузиуса. Для равновесия жидкость-пар приведите график зависимости давления фазового перехода от температуры. Для каких фазовых переходов применимо уравнение Клапейрона-Клаузиуса?
Систему, состоящую из нескольких фаз, называют гетерогенной, а равновесие, устанавливающиеся в такой системе, - гетерогенным, или фазовым. Фазовое равновесие в гетерогенной системе характеризуется определёнными условиями:
1)равенства температур во всех фазах (термическое условие равновесия);
2)равенством давлений во всех фазах (механическое условие равновесия);

3)равенством химических потенциалов каждого компонента во всех фазах (химическое условие равновесия).
Фаза - часть гетерогенной системы, ограниченная поверхностью раздела и характеризующаяся в отсутствии внешнего поля сил одинаковыми химическими, физическими и термодинамическими свойствами во всех своих точках. Каждая фаза гомогенна, но не непрерывна, то есть может состоять из отдельных кристаллов.
По числу фаз системы делят на однофазные, двухфазные, трёхфазные и многофазные.
Система может состоять из одного или нескольких компонентов. Компонентом называют индивидуальное химическое вещество, которое является составной частью системы, может быть выделено из неё и существовать самостоятельно.
Числом компонентов (К) называют наименьшее число индивидуальных химических веществ (компонентов), необходимое для образования всех фаз термодинамической системы и математического выражения состава любой фазы. Из определений компонентов и числа компонентов следует:
1.Каждый компонент может изменяться и существовать независимо от других компонентов.
2.Не все составные части системы учитываются при расчёте числа компонентов. Например, в водном растворе поваренной соли имеется несколько видов частиц (Na+, Cl-, H+, OH-, NaCl, H2O), но два компонента (NaCl, H2O).
3.Если вещества,образующие систему, не взаимодействуют друг с другом, то число компонентов равно числу R веществ в системе. При химических взаимодействиях К меньше R на число связей g. Величина g равна числу независимых уравнений реакций:
Состояние системы характеризуют числом степеней свободы (вариантностью). Число степеней свободы (С) - это число термодинамических параметров, определяющих состояние системы, которое можно произвольно изменять (независимо один от другого) без изменения числа фаз в системе. К таким параметрам относят внешние факторы (температуру, давление) и внутренние (концентрации компонентов).
По числу степеней свободы системы подразделения ляют на инвариантные (С = 0), моновариантные (С = 1), бивариантные (С = 2) и так далее. Например, при постоянном давлении на водный раствор соли имеет одну степень свободы. Каждой произвольно выбранной температуре соответствует строго определённая концентрация насыщенного раствора.
Большой практический интерес представляют однокомпонентные двухфазные системы. Такие системы образуются при плавлении, испарении, возгонке, то есть при фазовых переходах (превращениях).
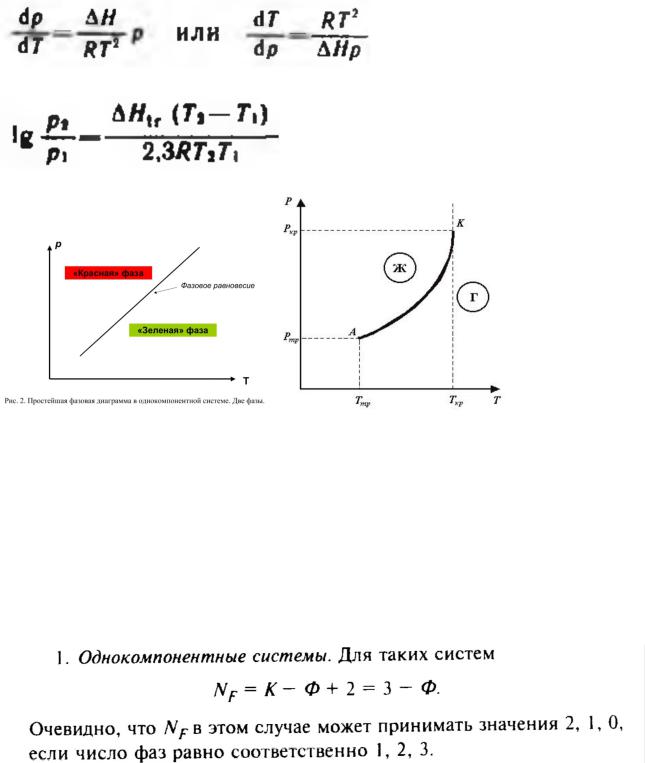
Уравнение Клапейрона-Клаузиуса описывает процессы фазовых превращений, в которых одной из равновесных фаз является пар. Величина ∆H является молярной теплотой испарения, возгонки или конденсации:
Интегральная форма:
35.Основные понятия фазового равновесия. Дайте определение фазы, числа составляющих веществ и числа компонентов, вариантности системы. Перечислите условия фазового равновесия. В закрытом сосуде при постоянной температуре находятся в равновесии насыщенный раствор Na2SO4 с избытком твердой фазы и его пар. Сколько фаз и компонентов присутствует при этом? Какова вариантность системы?
Фазы: 3 Компоненты: 1
Вариантность системы: 3 - 3 = 0
36. Определите тип диаграммы. Укажите области существования жидкости, твердого вещества и пара на фазовой диаграмме. Рассчитайте число степеней свободы для каждой области диаграммы. ( Для различных диаграмм).

37. Диаграмма состояния однокомпонентной системы для нормальной жидкости. Укажите области существования жидкости, твердого вещества и пара на фазовой диаграмме. Рассчитайте число степеней свободы для каждой области диаграммы.
Области с Ф=1: С=1-1+2=2 - для точек, лежащих между кривыми Области с Ф=2: С=1-2+2=1 - для точек, лежащих на кривых Тройная точка: С=0 Кривая ОС - кривая возгонки
Кривая ОВ - кривая испарения Кривая OD - кривая плавления
38. Диаграмма состояния однокомпонентной системы для аномальной жидкости. Уравнение Клапейрона-Клаузиуса для фазовых переходов I рода. Укажите области существования жидкости, твердого вещества и пара на фазовой диаграмме. Рассчитайте число степеней свободы для каждой области диаграммы.

Тройную точку А называют тройной точкой воды - даже небольшое изменение одного из параметров нарушает равновесие и приводит к исчезновению одной или двух фаз.
Если С = 2 - можно менять температуру и давление без изменения числа фаз, если С = 1 можно изменять или давление, или температуру.
Диаграмма состояния воды отличается от диаграмм состояния других веществ наклоном кривой зависимости температуры плавления льда от давления. Кривая плавления направлена влево вверх, тогда как почти у всех других веществ она идет направо вверх.
