
- •Кафедра биохимии и биоинформатики
- •Оглавление
- •1.1 Общая характеристика элементов
- •1.2 Физические свойства простых веществ
- •1.3 Химичесие свойства простых веществ
- •1.3 Гидриды типа н2э
- •1.4 Соединения кислорода с водородом
- •1.5 Халькогениды
- •1.6 Оксиды халькогенов
- •1.7 Кислородсодержащие кислоты и их соли.
1.7 Кислородсодержащие кислоты и их соли.
Сернистая, селенистая и теллуристая кислоты. Строение молекул и анионов кислот. Физические и химические свойства. Их соли. Применение.
Серная, селеновая и теллуровая кислоты. Строение молекул и анионов кислот. Физические и химические свойства. Свойства разбавленной и концентрированной серной кислоты. Состав продуктов ее взаимодействия с металлами и неметаллами. Промышленные способы получения серной кислоты. Олеум. Применение серной кислоты. Сульфаты и гидросульфаты. Купоросы и квасцы. Их применение.
Полисерные, пероксосерные, политионовые кислоты. Строение молекул. Химические свойства, получение. Соли и их практическое использование.
Биологическая роль и химические основы применения серы, селена и их соединений. Загрязнение биосферы соединениями серы.
Сила
кислот (в свободном состоянии выделена
лишь Н2SeO3, свойства Н2SO3 и Н2TeO3,
оцениваются по свойствам соответствующих
полей) уменьшается в ряду Н2SO3 - Н2SeO3 -
Н2TeO3. В отличие от селенитов и теллуритов
сернистая кислота и ее соли обладают
выраженными восстановительными
свойствами. Сульфиты в водных растворах
медленно окисляются кислородом воздуха:
2SO32- + О2 SO42- (аналогичная реакция,
катализируемая оксидом азота NO, в
атмосфере служит источником кислотных
дождей).
Сернистая
кислота действует как мягкий восстановитель
в многочисленных реакциях с солями
металлов:
Fe2(SO4)3
+ SO2 + 2H2O 2FeSO4 + 2H2SO4
У
селенистой и теллуристой кислот
восстановительные свойства выражены
слабее, то есть окислить их до производных
Se(VI) и Te(VI) значительно труднее.
окислительные
свойства H2TeO3 выражены сильнее, чем у
сернистой кислоты. Соединения Se(IV)
проявляют более сильные окислительные
свойства, чем соединения S(IV)
и
Te(IV). Например, водный раствор SO2
восстанавливает селенистую кислоту:
H2SeO3
+ 2 SO2 + H2O Se + 2H2SO4
Аналогично
протекает реакция с H2TeO3.H2SO4 – бесцветная
маслянистая жидкость, летучая, смешивается
с водой в любфх отношених.
Оксокислоты
халькогенов (VI) H2SO4, H2SeO4 и H6TeO6 синтезируют
окислением их диоксидов (или соответствующих
им кислот):
H2SeO3
+ Н2О2
5TeO2
+ 2KMnO4 + 6HNO3 + 12 Н2О 5H6TeO6 + 2KNO3 + 2Mn(NO3)2 ,
а
также окислением простых веществ
сильными окислителями:
5Te
+ 6HClO3 + 12H2O 5H6TeO6 + 3Cl2 ,
или
обменными реакциями:
BaTeO4
+ H2SO4 + 2H2O H6TeO6 + BaSO4.
В
молекуле H2SO4 сера тетраэдрически
окружена двумя гидроксильными (ОН)
группами и двумя атомами кислорода.
Бесцветные, похожие на лед кристаллы
H2SO4 имеют слоистую структуру, в которой
каждая молекула H2SO4 соединена с четырьмя
соседними молекулами прочными водородными
связями, образуя единый пространственный
каркас. При температуре 10.48оС H2SO4 плавится
с образованием тяжелой маслянистой
жидкости, кипящей при 280оС. У жидкой
H2SO4 структура почти такая же, как у
твердой, только целостность
пространственного каркаса нарушена,
и его можно представить как совокупность
микрокристалликов, постоянно меняющих
свою форму. H2SO4 смешивается с водой в
любых соотношениях, что сопровождается
образованием гидратов H2SO4. n H2O. Теплота
гидратации настолько велика, что смесь
может даже закипеть.
Жидкая
H2SO4 удивительно похожа на воду со всеми
структурными особенностями и аномалиями.
Здесь та же система сильных водородных
связей, что и в воде, почти такой же
прочный пространственный каркас, такие
же аномально высокие вязкость,
поверхностное натяжение, температуры
плавления и кипения.
Серная
и селеновая кислоты являются сильными
двухосновными кислотами и близки по
структуре и свойствам между собой.
Строение
ортотеллуровой кислоты H6TeO6 отличается
от строения серной и селеновой кислот.
Кристаллическая структура твердой
H6TeO6 построена из молекул правильной
октаэдрической формы, которые сохраняют
свою форму и в растворах. Селеновая
кислота более сильный окислитель, чем
Н2SO4 и Н6ТеО6. Она растворяет без нагревания
Cu и даже Au:
2Au
+ 6H2SеO4 Au2(SeO4)3 + 3 H2SeO3 + 2H2O,
окисляет
ионы галогенидов, кроме фторида, до
свободных галогенов, под ее действием
воспламеняется клетчатка. Ортотеллуровая
кислота также более сильный окислитель,
чем серная кислота. Наиболее частым
продуктом восстановления H2SeO4 и H6TeO6
являются простые вещества.
Серная
кислота обладает сильными окислительными
свойствами только в концентрированном
виде и при нагревании:
Cu
+ 2 H2SO4
Продуктами
ее восстановления в зависимости от
условий проведения реакций могут быть
SO2 (при избытке H2SO4), H2S, S,
H2SеO4,
например, выделяет хлор из концентрированной
HCl:
H2SеO4
+ 2HCl = =Cl2 + H2SeO3 + H2O.
Химические
свойства разбавленной серной кислоты.
Разбавленная серная кислота — сильный
электролит, она проявляет общие свойства
кислот: меняет цвет индикаторов и
образует соли в реакциях с металлами,
основными и амфотерными оксидами,
гидроксидами металлов, другими солями.
Рассмотрим конкретные примеры.
1.
Индикаторы лакмус и метилоранж окрашивают
раствор серной кислоты в красный цвет.
В разбавленных растворах серная кислота
диссоциирует согласно схеме:
а)
металлы, расположенные в ряду активности
до водорода, вытесняют его из разбавленных
растворов серной кислоты:
Zn
+ Н2SO4 = ZnSO4 + H2↑; Fe + Н2SO4 = FeSO4 + H2↑;
б)
реакции серной кислоты с основными и
амфотерными оксидами, как правило,
требуют небольшого нагревания для
увеличения скорости:
СuO
+ Н2SO4 = CuSO4 + H2O; Al2O3 + 3Н2SO4 = Al2(SO4)3 + 3H2O;
в)
в реакциях со щелочами и нерастворимыми
основаниями образуются соли и вода
(нейтрализация):
2NaOH
+ Н2SO4 = Na2SO4 + 2H2O или NaOH + Н2SO4 = NaНSO4 + H2O;
Сa(OH)2 + Н2SO4 = СаSO4↓ + 2H2O.
Отметим,
что при мольном соотношении щёлочи
NaOH и кислоты Н2SO4 2 : 1 или избытке NaOH
образуется средняя соль (сульфат), а
при их соотношении 1 : 1 — кислая соль
(гидросульфат). Следовательно, избыток
многоосновной (двухосновной) кислоты
Н2SO4 приводит к образованию кислых
солей;
г)
реакции растворов серной кислоты с
солями протекают в полном соответствии
с условиями реакций ионного обмена:
H2SO4
+ Na2CO3 = Na2SO4 + H2O + CO2↑;
H2SO4
+ Na2SiO3 = Na2SO4 + H2SiO3↓.
Концентрированная
серная кислота — более сильный
окислитель, чем разбавленная. Её
окислительные свойства проявляются
прежде всего в реакциях с металлами.
Отметим несколько важных моментов.
Во-первых,
происходит восстановление не водорода,
а атомов серы. Продуктами восстановления
являются SO2, S и Н2S. Состав преимущественно
образующихся продуктов зависит как от
концентрации кислоты, так и от активности
металла как восстановителя. Чем меньше
концентрация кислоты и выше активность
металла, тем сильнее восстанавливаются
атомы серы. В общем виде взаимодействие
концентрированной серной кислоты с
металлами можно представить схемой:
Так,
в реакции с металлами, находящимися в
ряду активности после водорода (кроме
золота и платины), образуется оксид
серы(IV) SO2, например:
В
реакциях с металлами, расположенными
в ряду активности до водорода, могут
образовываться и SO2, и S, и Н2S. Например,
cхемы реакций, протекающих при
взаимодействии цинка с серной кислотой
по мере увеличения её концентрации,
выглядят так:
Во-вторых,
некоторые сравнительно активные металлы
(например, железо, алюминий, хром)
концентрированной серной кислотой при
комнатной температуре пассивируются:
на поверхности металла образуется
плотная оксидная плёнка. Благодаря
пассивации железа возможна перевозка
кислоты в стальных цистернах.
Среди
других особенностей концентрированной
серной кислоты можно отметить следующие.
Она способна вытеснять менее сильные
или более летучие кислоты (НСl, HNO3, H3PO4,
CH3COOH) из их солей:
В
промышленности серную кислоту получают
окислением диоксида серы (сернистый
газ, образующийся в процессе сжигания
серы или серного колчедана) до триоксида
(серного ангидрида) с последующим
взаимодействием SO3 с водой. Получаемую
данным способом серную кислоту также
называют «контактной» (концентрация
92-94 %).
2SO2
+ O2 = 2SO3
H2O
+ SO3 = H2SO4
О́леум![]()
![]() H2SeO4 + Н2О
H2SeO4 + Н2О![]() CuSO4 + SO2 + 2H2O .
CuSO4 + SO2 + 2H2O .![]() , политионаты (при недостатке H2SO4).
, политионаты (при недостатке H2SO4). 2.
Образование солей:
2.
Образование солей:
![]()

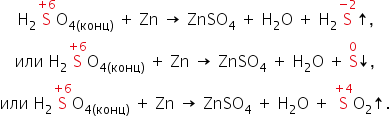

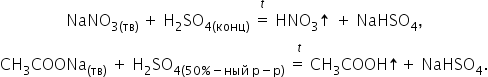
 Концентрированная
кислота окисляет сложные органические
вещества: обугливает бумагу, древесину,
кожу, поэтому необходимо крайне
осторожное обращение.
Концентрированная
кислота окисляет сложные органические
вещества: обугливает бумагу, древесину,
кожу, поэтому необходимо крайне
осторожное обращение.
Олеум представляет собой вязкую маслянистую бесцветную жидкость или легкоплавкие кристаллы, которые, однако, могут приобретать самые различные оттенки вследствие наличия примесей. Входит в состав серной кислоты, сера – основной компонент кислоты. Олеум – крайне едкое вещество: оставляет сильные ожоги на коже, быстро разъедает многие материалы, за исключением наименее реакционноспособных. Тем не менее, вследствие эффекта пассивации может храниться в стальных ёмкостях. Олеум нельзя разбавлять водой или выливать его в воду из-за сильно экзотермической реакции. Разбавление олеума производится прибавлением его к серной кислоте. При приливании в воду жидкость закипает, образуя туман из серной кислоты. Применяется в промышленности при производстве серной кислоты, капролактама и многих других веществ. В органической химии применяется как сульфирующий, водоотнимающий или окисляющий реагент.
ЗАКЛЮЧЕНИЕ
Халькогены - это группа элементов в периодической таблице, которая включает в себя кислород, серу, селен и теллур. Эти элементы обладают схожими химическими свойствами, такими как высокая электроотрицательность и способность образовывать соединения с металлами.
Халькогены играют важную роль в различных процессах, таких как дыхание, окисление и восстановление, а также в биологических системах. Они также широко используются в промышленности, например, сера используется для производства удобрений и пластмасс, а кислород - для дыхания и в производстве стали.
Халькогены имеют различные аллотропные формы и могут образовывать разнообразные соединения, что делает их важными для различных научных и промышленных приложений.
СПИСОК ЛИТЕРАТУРЫ
Глинка, Н.Л. Общая химия / Н.Л. Глинка – 2010.
Общая химия в формулах, определениях, схемах./ И.Е.Шиманович, М.Л.Павлович, В.Ф. Тикавый, П.М.Малашко
Общая химия./ под редакцией Ю.А. Ершова
Сернистая,
селенистая, теллуристая кислоты.
Строение, свойства и их солей
[Электронный ресурс] /studfile.net
–
Режим доступа
–https://studfile.net/preview/16707408/page:25/–
Дата доступа: 11.11.2023.
