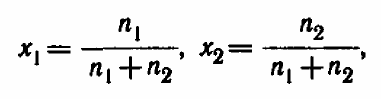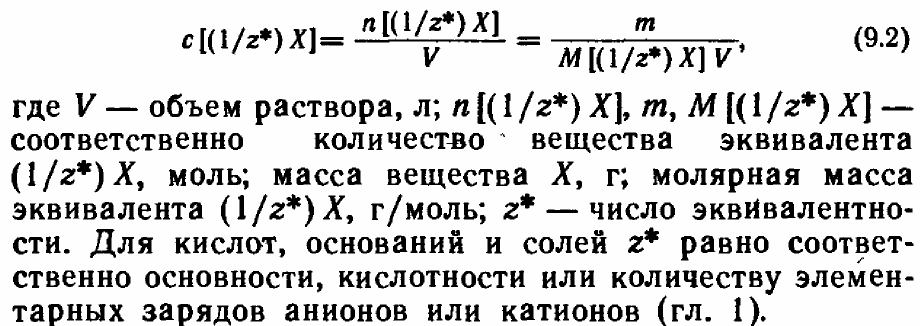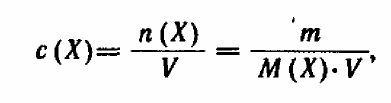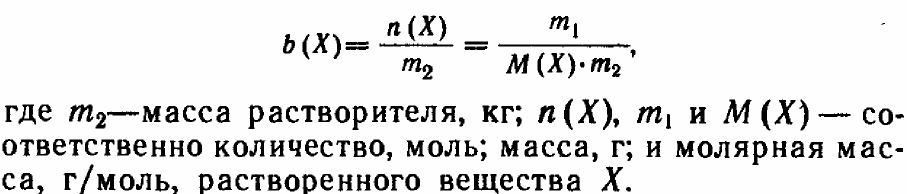- •1) Предмет и задачи общей и неорганической химии. Роль химии в системе естественных наук.
- •4) Важнейшие классы и номенклатура неорганических веществ.
- •8) Периодичность свойств химических элементов.
- •9) Природа химической связи. Основные типы химической связи.
- •10) Ковалентная химическая связь. Способы образования ковалентной связи. Валентность.
- •11) Свойства ковалентной связи. Степень окисления атома.
- •13) Основы метода молекулярных орбиталей.
- •14) Ионная и металлическая связь. Водородная связь. Межмолекулярное взаимодействие.
- •17)Влияние температуры на скорость химической реакции. Основные положения теории активации Аррениуса.
- •18) Катализ. Влияние катализатора на скорость химической реакции.
- •19) Необратимые и обратимые реакции. Химическое равновесие. Принцип Ле-Шателье.
- •20) Дисперсные системы. Коллоидные растворы.
- •21)Растворение как физико - химический процесс.
- •22) Растворимость веществ. Состав растворов.
- •23)Основные положения теории электролитической диссоциации.
- •24)Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
- •25)Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
- •26) Константа диссоциации слабых электролитов. Закон разбавления Оствальда.
- •27) Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
- •28) Диссоциация воды. Константа диссоциации, ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •29) Произведение растворимости. Условия образования и растворения осадков. Реакции обмена в растворах электролитов.
- •30) Гидролиз солей. Количественные характеристики гидролиза.
- •32) Ионно-электронный метод (метод полуреакций). Классификация окислительно-восстановительных реакций.
- •33) Электрохимические процессы. Электродный потенциал. Стандартные электродные потенциалы. Водородный электрод.
- •34) Электрохимический ряд напряжений металлов. Уравнение Нернста. Гальванический элемент и его э.Д.С. Влияние условий на протекание окислительно-восстановительных процессов.
- •36) Устойчивость комплексных соединений. Понятие о двойных солях. Биологическая роль комплексных соединений.
- •37) Общая характеристика водорода. Гидриды. Ион водорода и ион гидроксония.
- •39) Галогеноводороды. Галогениды. Особенности плавиковой кислоты. Соляная кислота. Роль соляной кислоты и хлоридов в живых организмах.
- •40) Кислородсодержащие соединения галогенов. Кислородные кислоты хлора и их соли. Хлорная известь. Бертолетова соль. Перхлораты. Кислородосодержащие кислоты брома, иода и их соли.
- •41) Общая характеристика элементов via группы. Особенности кислорода. Аллотропия и изоморфизм серы. Свойства простых веществ. Применение и биологическое значение халькогенов.
- •42) Гидриды типа н2э. Ассоциация молекул воды. Токсичность сероводорода и других халькогеноводородов, их физиологическое действие.
- •44) Халькогениды. Растворимость и гидролиз сульфидов металлов. Полисульфиды.
- •45) Оксиды халькогенов. Диоксиды и триоксиды элементов. Сернистая, селенистая и теллуристая кислоты.
- •47) Общая характеристика элементов va группы. Свойства простых веществ. Аллотропия фосфора. Круговорот азота и фосфора в природе.
- •48) Гидриды типа эн3. Аммиак. Соли аммония. Аммиакаты. Гидроксиламин. Пептидная связь в белках.
- •49) Кислородсодержащие соединения азота. Оксиды азота. Физиологическое действие. Азотистая кислота и ее соли. Физиологическое действие.
- •51) Кислородсодержащие соединения фосфора. Оксиды фосфора (ііі) и (V). Кислородсодержащие кислоты фосфора и их соли. Фосфорная, фосфористая и фосфорноватистая кислоты. Роль в биологических процессах.
- •56) Кислородсодержащие соединения углерода. Оксиды углерода. Токсичность оксида углерода (іі). Роль оксида углерода(іv) в процессах жизнедеятельности. Парниковый эффект.
- •57) Угольная кислота и ее соли. Временная жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
- •59) Общая характеристика металлов. Общая характеристика валентных состояний металлов а и в групп. Значение и роль металлов в жизнедеятельности живых организмов.
- •60) Щелочные металлы. Общая характеристика оксидов, пероксидов, гидроксидов и солей. Калийные удобрения. Роль натрия и калия в жизнедеятельности живых организмов.
- •61) Бериллий. Магний. Щелочно-земельные металлы. Общая характеристика оксидов, гидроксидов, солей элементов группы iiа. Их роль в живой природе.
- •62) Алюминий. Подгруппа галлия. Общая характеристика оксидов, гидроксидов и солей элементов группы. Борная кислота и бораты. Амфотерность алюминия. Алюминаты. Гидролиз солей алюминия.
- •63) Металлы iva группы. Общая характеристика элементов. Токсичность свинца.
- •66) Общая характеристика элементов группы хрома. Свойства простых веществ. Соединения хрома (ііі) и их особенности. Соединения xpoмa (VI): хромовые кислоты и их соли. Роль в живой природе.
22) Растворимость веществ. Состав растворов.
|
Способы выражения состава раствора:
Массовая доля- отношение массы раствренного вещетва к массе раствора.
Молярная доля компонента раствора-- отношение количества данного данного компонента к общему количеству вещества раствора.
х1+х2=1 Молярная концентрация вещества эквивалента-- отношение количества эквивалентов раствора вещества к объёму раствора.
Молярная концентрация-
Моляльность раствора-- отношение химического количества вещества к массе растворителя.
Массовая концентрация вещества(титр)-- отношение массы растворенного вещества к объёму раствора.
|
|
Растворимостью - способность вещества растворяться в том или ином растворителе.
Хорошо растворимые(S меньше 1)
Малорастворимые (S=0,01-1г)
Нерастворимые( S больше 0.01г)
Насыщенный раствор-- раствор, наход в динамическом равнвесии с суб растворенного вещества.
Ненасыщенный раствор-- содержится меньше вещества
Перенасыщенный раствор-- больше, чем в насыщенном (неустойчивы) !меняя T/p
S зависит:
От природы растворяемого вещества и растворителя
Агрегатного состояния
Налич посторонних в-в
Т и р
Растворимость |
|
Тв вещества |
газов |
С увел Т-увел Не зависит от р |
Увел Т-умен Увел р- увелич |
Коэффицент растворимости(S)-величина, которая показывает какая мах масса в-ва может раствориться в 100г воды при данной температуре. (1л=1000г)

Закон
Дальтона:
растворимость каждого из компонентов
газовой смеси при постоянной температуре
пропорциональна парциальному давлению
компонента над жидкостью и не зависит
от общего давления смеси и индивидуальности
других компонентов.
23)Основные положения теории электролитической диссоциации.
при
растворении в воде электролиты
распадаются (диссоциируют) на положительно
и от рицательно заряженные ионы.
Положительно заряженные ионы--катионами;
Отрицательно заряженные ионы -- аннонами;
Основные
положения теории электролитической
диссоциации
1.
Электролиты при растворении в воде
распадаются (диссоциируют) на ионы –
положительные и отрицательные.
2.
Под действием электрического тока ионы
приобретают направленное движение:
положительно заряженные частицы
движутся к катоду, отрицательно
заряженные – к аноду. Поэтому положительно
заряженные частицы называются катионами,
а отрицательно заряженные – анионами.
3.
Направленное движение происходит в
результате притяжения их противоположно
заряженными электродами (катод заряжен
отрицательно, а анод – положительно).
4.
Ионизация – обратимый процесс:
параллельно с распадом молекул на ионы
(диссоциация) протекает процесс
соединения ионов в молекулы (ассоциация).