
- •1) Предмет и задачи общей и неорганической химии. Роль химии в системе естественных наук.
- •4) Важнейшие классы и номенклатура неорганических веществ.
- •8) Периодичность свойств химических элементов.
- •9) Природа химической связи. Основные типы химической связи.
- •10) Ковалентная химическая связь. Способы образования ковалентной связи. Валентность.
- •11) Свойства ковалентной связи. Степень окисления атома.
- •13) Основы метода молекулярных орбиталей.
- •14) Ионная и металлическая связь. Водородная связь. Межмолекулярное взаимодействие.
- •17)Влияние температуры на скорость химической реакции. Основные положения теории активации Аррениуса.
- •18) Катализ. Влияние катализатора на скорость химической реакции.
- •19) Необратимые и обратимые реакции. Химическое равновесие. Принцип Ле-Шателье.
- •20) Дисперсные системы. Коллоидные растворы.
- •21)Растворение как физико - химический процесс.
- •22) Растворимость веществ. Состав растворов.
- •23)Основные положения теории электролитической диссоциации.
- •24)Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
- •25)Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
- •26) Константа диссоциации слабых электролитов. Закон разбавления Оствальда.
- •27) Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
- •28) Диссоциация воды. Константа диссоциации, ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •29) Произведение растворимости. Условия образования и растворения осадков. Реакции обмена в растворах электролитов.
- •30) Гидролиз солей. Количественные характеристики гидролиза.
- •32) Ионно-электронный метод (метод полуреакций). Классификация окислительно-восстановительных реакций.
- •33) Электрохимические процессы. Электродный потенциал. Стандартные электродные потенциалы. Водородный электрод.
- •34) Электрохимический ряд напряжений металлов. Уравнение Нернста. Гальванический элемент и его э.Д.С. Влияние условий на протекание окислительно-восстановительных процессов.
- •36) Устойчивость комплексных соединений. Понятие о двойных солях. Биологическая роль комплексных соединений.
- •37) Общая характеристика водорода. Гидриды. Ион водорода и ион гидроксония.
- •39) Галогеноводороды. Галогениды. Особенности плавиковой кислоты. Соляная кислота. Роль соляной кислоты и хлоридов в живых организмах.
- •40) Кислородсодержащие соединения галогенов. Кислородные кислоты хлора и их соли. Хлорная известь. Бертолетова соль. Перхлораты. Кислородосодержащие кислоты брома, иода и их соли.
- •41) Общая характеристика элементов via группы. Особенности кислорода. Аллотропия и изоморфизм серы. Свойства простых веществ. Применение и биологическое значение халькогенов.
- •42) Гидриды типа н2э. Ассоциация молекул воды. Токсичность сероводорода и других халькогеноводородов, их физиологическое действие.
- •44) Халькогениды. Растворимость и гидролиз сульфидов металлов. Полисульфиды.
- •45) Оксиды халькогенов. Диоксиды и триоксиды элементов. Сернистая, селенистая и теллуристая кислоты.
- •47) Общая характеристика элементов va группы. Свойства простых веществ. Аллотропия фосфора. Круговорот азота и фосфора в природе.
- •48) Гидриды типа эн3. Аммиак. Соли аммония. Аммиакаты. Гидроксиламин. Пептидная связь в белках.
- •49) Кислородсодержащие соединения азота. Оксиды азота. Физиологическое действие. Азотистая кислота и ее соли. Физиологическое действие.
- •51) Кислородсодержащие соединения фосфора. Оксиды фосфора (ііі) и (V). Кислородсодержащие кислоты фосфора и их соли. Фосфорная, фосфористая и фосфорноватистая кислоты. Роль в биологических процессах.
- •56) Кислородсодержащие соединения углерода. Оксиды углерода. Токсичность оксида углерода (іі). Роль оксида углерода(іv) в процессах жизнедеятельности. Парниковый эффект.
- •57) Угольная кислота и ее соли. Временная жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
- •59) Общая характеристика металлов. Общая характеристика валентных состояний металлов а и в групп. Значение и роль металлов в жизнедеятельности живых организмов.
- •60) Щелочные металлы. Общая характеристика оксидов, пероксидов, гидроксидов и солей. Калийные удобрения. Роль натрия и калия в жизнедеятельности живых организмов.
- •61) Бериллий. Магний. Щелочно-земельные металлы. Общая характеристика оксидов, гидроксидов, солей элементов группы iiа. Их роль в живой природе.
- •62) Алюминий. Подгруппа галлия. Общая характеристика оксидов, гидроксидов и солей элементов группы. Борная кислота и бораты. Амфотерность алюминия. Алюминаты. Гидролиз солей алюминия.
- •63) Металлы iva группы. Общая характеристика элементов. Токсичность свинца.
- •66) Общая характеристика элементов группы хрома. Свойства простых веществ. Соединения хрома (ііі) и их особенности. Соединения xpoмa (VI): хромовые кислоты и их соли. Роль в живой природе.
66) Общая характеристика элементов группы хрома. Свойства простых веществ. Соединения хрома (ііі) и их особенности. Соединения xpoмa (VI): хромовые кислоты и их соли. Роль в живой природе.
Подгру́ппа
хро́ма — химические элементы 6-й группы
периодической таблицы химических
элементов (по устаревшей классификации
— элементы побочной подгруппы VI
группы)[1]. В группу входят хром Сr,
молибден Mo и вольфрам W[2]. На внешнем
энергетическом уровне у атомов хрома
и молибдена находится один электрон,
у вольфрама — два, поэтому характерным
признаком данных элементов является
металлический блеск, что и отличает
эту побочную подгруппу от главной.
Степень окисления в соединениях всех
элементов подгруппы хрома равна +6, а
также +5, +4, +3 и +2. По возрастанию порядкового
номера элементов возрастает и температура
плавления. Например, вольфрам — самый
тугоплавкий металл, его температура
плавления составляет 3390 °C. Элементы
подгруппы достаточно устойчивы к
внешним факторам (воздух, вода). По
физическим и химическим свойствам
молибден и вольфрам сходны, но отличаются
от хрома.
Соединения
Cr(+3)
Степени
окисления +3 соответствует амфотерный
оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного
цвета). Это — наиболее устойчивая
степень окисления хрома. Соединения
хрома в этой степени окисления имеют
цвет от грязно-лилового (в водных
растворах ион Cr3+ существует в виде
аквакомплексов [Cr(H2O)6]3+) до зелёного (в
координационной сфере присутствуют
анионы).
Cr3+
склонен к образованию двойных сульфатов
вида MICr(SO4)2·12H2O (квасцов)
Соединения
хрома (+6)
Степени
окисления +6 соответствует кислотный
оксид хрома (VI) CrO3 и целый ряд кислот,
между которыми существует равновесие.
Простейшие из них — хромовая H2CrO4 и
двухромовая H2Cr2O7. Они образуют два ряда
солей: жёлтые хроматы и оранжевые
дихроматы соответственно.
Оксид
хрома (VI) CrO3 образуется при взаимодействии
концентрированной серной кислоты с
растворами дихроматов. Типичный
кислотный оксид, при взаимодействии с
водой он образует сильные неустойчивые
хромовые кислоты: хромовую H2CrO4, дихромовую
H2Cr2O7 и другие изополикислоты с общей
формулой H2CrnO3n+1. Увеличение степени
полимеризации происходит с уменьшением
рН, то есть увеличением кислотности.
Хро́мовая
кислота́ — кристаллическое вещество
красного цвета. Химическая формула
H2CrO4. В водных растворах имеет жёлтый
цвет. Выделена в свободном состоянии
при охлаждении насыщенных водных
растворов хромата.
Соли
хромовой кислоты называются хроматами.
Сильный окислитель. Токсична, канцерогенна.
С
повышением степени окисления атомов
Сг в оксидах и гидроксидах их основный
характер ослабевает,а кислотный -
усиливается. В этом же направлении
происходит замена восстановительной
активности на окислительную.
Биологическая
роль и физиологическое действие :
Хром
— один из биогенных
элементов,
постоянно входит в состав тканей
растений и животных. У животных хром
участвует в обмене липидов,
белков
(входит в состав фермента
трипсина),
углеводов.
Снижение содержания хрома в пище и
крови приводит к уменьшению скорости
роста, увеличению холестерина
в крови.
В
чистом виде хром довольно токсичен[9],
металлическая пыль
хрома раздражает ткани лёгких.
Соединения хрома(III) вызывают дерматиты.
Пример
соединения хрома (VI): Оксид
хрома (VI)
Соединения
хрома в степени
окисления
+6 особо токсичны. Практически вся
хромовая руда обрабатывается через
преобразование в дихромат
натрия.
В 1985 году было произведено примерно
136 000 тонн шестивалентного хрома[10].
Другими источниками шестивалентного
хрома являются триоксид
хрома
и различные соли — хроматы
и дихроматы.
Шестивалентный хром используется при
производстве нержавеющих сталей,
текстильных красок, консервантов для
дерева, при хромировании
и пр.
Шестивалентный
хром является признанным канцерогеном
при вдыхании[11].
На многих рабочих местах сотрудники
подвержены воздействию шестивалентного
хрома, например, при гальваническом
хромировании или сварке нержавеющих
сталей[11].
В Европейском
союзе
использование шестивалентного хрома
существенно ограничено директивой
RoHS.
Шестивалентный
хром транспортируется в клетки
человеческого организма с помощью
сульфатного транспортного механизма
благодаря своей близости к сульфатам
по структуре и заряду. Трёхвалентный
хром, более часто встречающийся, не
транспортируется в клетки.
Внутри
клетки Cr(VI) восстанавливается до
метастабильного пятивалентного хрома
(Cr(V)), затем до трёхвалентного хрома
(Cr(III)). Трёхвалентный хром, присоединяясь
к протеинам, создаёт гаптены,
которые включают иммунную реакцию.
После их появления чувствительность
к хрому не пропадает. В этом случае даже
контакт с текстильными изделиями,
окрашенными хромсодержащими красками
или с кожей, обработанной хромом, может
вызвать раздражение кожи. Витамин
C
и другие агенты реагируют с хроматами
и образуют Cr(III) внутри клетки[12].
Продукты
шестивалентного хрома являются
генотоксичными
канцерогенами. Хроническое вдыхание
соединений шестивалентного хрома
увеличивает риск заболеваний носоглотки,
риск рака
лёгких.
(Лёгкие
особенно уязвимы из-за большого
количества мелких капилляров). Видимо,
механизм генотоксичности запускается
пяти- и трёхвалентным хромом.
В
США предельно допустимая концентрация
шестивалентного хрома в воздухе
составляет 5 мкг/м³ (0,005 мг/м³) В России
предельно допустимая концентрация
хрома (VI) существенно ниже — 1,5 мкг/м³
(0,0015 мг/м³).
Одним
из общепризнанных методов избежания
шестивалентного хрома является переход
от технологий гальванического
хромирования
к газотермическому
и вакуумному
напылению.
Основанный
на реальных событиях фильм «Эрин
Брокович»
режиссёра Стивена
Содерберга
рассказывает о крупном судебном
процессе, связанном с загрязнением
окружающей среды шестивалентным хромом,
в результате которого у многих людей
развились серьёзные заболевания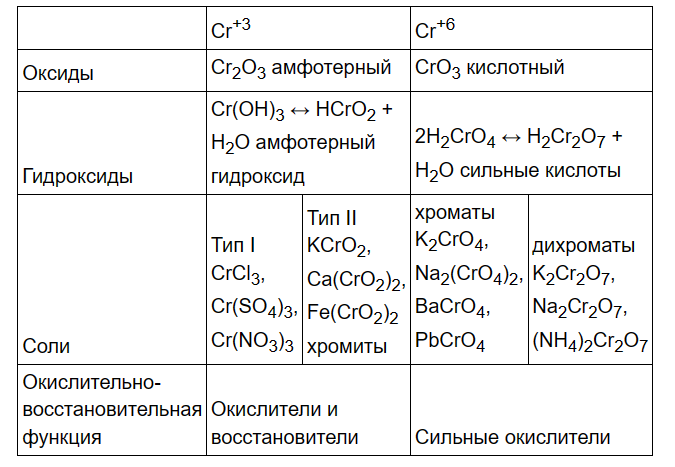
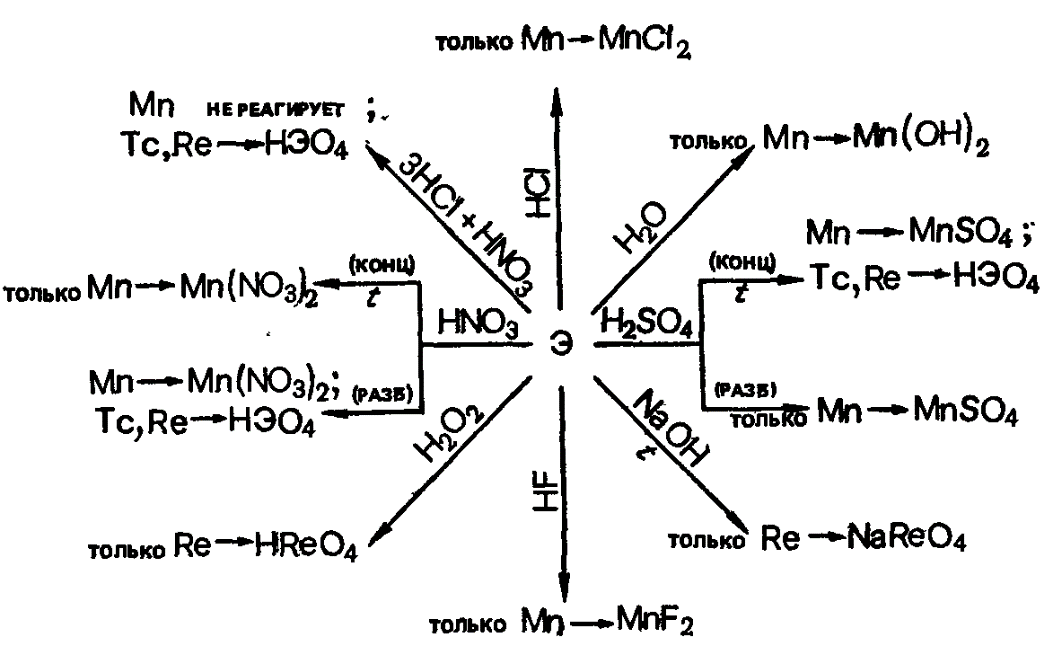
67) Общая характеристика элементов группы марганца. Свойства простых веществ. Соединения марганца(ІІ), (IV), (VI) и (VII). Окислительные свойства перманганат-иона в зависимости от кислотности среды. Значение марганца для жизнедеятельности живых организмов.
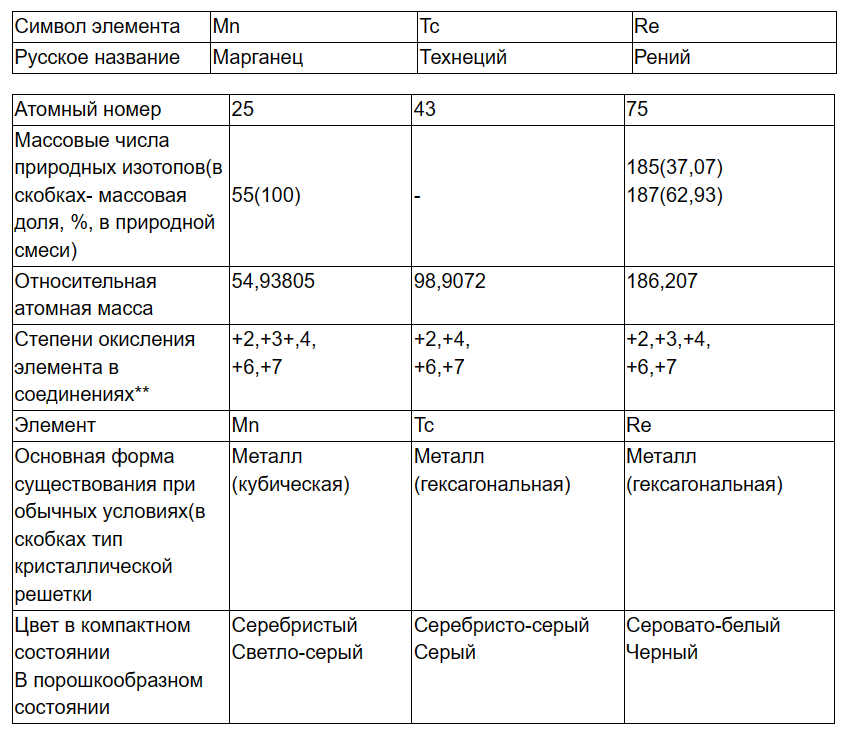
Способы
получения. Mn в свободном виде- термическое
восстановление оксидов или галогенидов
с помощью Н2, Na, Mg, Al, C или Si (кремнийтермия):
3Mn3O4+8Al
=9Mn+4Al2O3,
MnO2+Si
=Mn+SiO2
Наиболее
чистый Mn-электролиз водного раствора
MnSO4.
Химические
свойства. Mn, Tc, Re взаимодействуют со
многими реагентами, проявляя степень
окисления от +2 до +7. Это взаимодействие
особенно усиливается при нагревании
или измельчении. Химические свойства
элементов также в значительной степени
зависят от их чистоты.
Химическая
активность элементов понижается от Mn
к Re (Mn в ряду напряжений находится до
водорода, а Те и Re-после него).
При
комнатной температуре в порошкообразном
состоянии все они окисляются во влажном
воздухе. Металлический Mn в атмосфере
сухого воздуха окисляется только с
поверхности из-за образующейся тонкой
и плотной пленки оксид.
Mn+2H2O→Mn(OH)2+H2,
Mn+H2SO4(разб)→MnSO4+H2,
Mn+H2SO4(конц)→MnSO4+SO2+H2O,
3Mn+7HNO3(разб)→3HMnO4+7NO+2H2O,
Соединения
с водородом. Mn, Tc и Re не образуют соединений
определенного состава с водородом , но
довольно хорошо растворяет его уже при
относительно невысоких температурах.
Oксиды.
Ниже приведены основные оксидные
соединения Mn, Tc и Re:
Степень
окисления элемента
+2
+3
+4
+5
+6
+7
Mn
MnO
Mn2O3
MnO2
MnO3
Mn2O7
Tc
TcO2
Tc2O7
Re
ReO*H2O
Re2O3*H2O
ReO2
Re2O5
ReO3
Re2O7
Все
оксиды, исключая жидкий Mn2O7, при обычных
условиях - твердые вещества. Устойчивость
оксидов ЭО, Э2О3, и ЭО2 в ряду Mn-Re уменьшается,
а Э2О5, ЭО3 и Э2О7-наоборот, увеличивается.
Оксиды
Мn в степенях окисления +2, +3,+4 могут быть
получены непосредственным окислением
элемента. При взаимодействии Tc и Re с
кислородом образуются только оксиды
Э2О7.
Обычные
способы получения оксидов – термическое
разложение солей и гидроксидов,
восстановление или окисление соединений
соответствующих степеней окисления:
Mn(OH)2→MnO+H2O,
Mn(NO3)2→
MnO2+2NO2,
3Mn2O3+KClO3→6MnO2+KCl,
Оксиды
Mn, Tc и Re в воде практически не растворимы;
со щелочами и кислотами образуют
гидроксиды и соли. Оксиды элементов в
степенях окисления +3, +4 и выше являются
энергичными окислителями:
MnO2+4HCl→MnCl2+Cl2+2H2O,
Но
при действии сильных окислителей могут
окисляться сами:
3MnO2+KClO3+6KOH
3K2MnO4+KCl+3H2O
химические
свойства
Оксиды
Mn. Известны оксиды Mn, в которых он
находится в степенях окисления +2, +3,
+4, +7, а так же несколько смешанных,
например, Mn3O4. При увеличении степени
окисления происходит ослабление
основных и усиление кислотных свойств,
повышение окислительной активности.
Наример, оксид Mn (II) проявляет основные
и преобладающие восстановительные
свойства, а высший оксид Mn имеет кислотный
характер. У него ярко выражены
окислительные свойства. Оксиды Mn в
промежуточных степенях окисления
амфотерные и легко восстанавливаются
до Mn (II), проявляя свойства сильных
окислителей. Оксид Mn (II). Низший оксид
MnO представляет собой серо-зеленый
кристаллический порошок. Он встречается
в природе в виде минерала манганозита.
Высокодисперсная форма оксида обладает
значительной химической активностью
– воспламеняется на воздухе. Этот оксид
обладает преимущественно основным
характером. Он легко растворяется в
кислотах с образованием солей: MnO + 2HNO3
= Mn(NO3)2 + H2O. Оксид Mn (II) практически не
восстанавливается водородом, зато
реагирует с активными металлами. Реакция
с натрием протекает уже при комнатной
температуре. 3MnO + 2Al = 3Mn + Al2O3. В качестве
восстановителя могут быть так же
использованы углерод или угарный газ:
MnO + C = Mn + CO (при температуре 1200°C). MnO + CO
= Mn + CO2. Однако образующийся в результате
реакции металл сильно загрязнен карбидом
Mn7C3. Примесь его можно удалить добавлением
оксида Mn (II): Mn7C3 + 3MnO = 10Mn + 3CO. Данный оксид
является сильным восстановителем –
при повышенных температурах он реагирует
даже с таким слабым окислителем, как
оксид углерода (IV): 3MnO + CO2 = Mn3O4 + CO (при
температуре 600°С). Взаимодействие MnO со
F при температуре ниже 100°С приводит к
образованию трифторида MnF3, содержащего
небольшое количество MnF2. В среде
четыреххлористого углерода хлор
реагирует с MnO со вспышкой: 3MnO +Cl2 = MnCl2 +
Mn2O3. Бром быстро окисляет MnO до MnO2.
Пероксидами активных металлов MnO
окисляется до манганатов (IV): MnO + 2BaO2 =
BaMnO4 + BaO. Оксид Mn (III). Оксид Mn2O3 представляет
собой бурый порошок, при нагревании
разлагающийся. При хранении на воздухе
он медленно окисляется до оксида Mn
(IV). С водой не взаимодействует. Подобно
низшему оксиду Mn он обладает преимущественно
основным характером, но при определенных
условиях проявляет некоторые признаки
амфотерности. Окислительные свойства
Mn2O3 проявляют при кипячении с
концентрированной соляной кислотой:
Mn2O3 + 6HCl = 2MnCl2 + Cl2 + 3H2O. Оксид Mn (IV). MnO2 –
наиболее часто встречающийся в природе
минерал пиролюзит. Данный оксид –
порошок темно-коричневого цвета,
нерастворимый в воде. Среди многочисленных
реакций образования MnO2 только некоторые
предпочтительны. К ним относятся
окисление соединений Mn (II) растворами
хлоратов, перманганатов, хлором и
озоном: 3Mn(OH)2 + NaClO3 = 3MnO2 + NaCl + 3H2O. 3MnCl2 +
2KMnO4 + 2H2O = 5MnO2 + 4HCl + 2KCl. К ним так же относится
восстановление перманганатов действием
пероксида водорода, соляной кислоты,
сернистого газа, сульфитов, спиртов,
солями Mn (II): 2KMnO4 + 3SO2 + 2H2O = 2MnO2 + 2KHSO4 + H2SO4.
4KMnO4 + 3C2H5OH = 4MnO2 + KOH + 3CH3COOK + 4H2O. Большая
часть диоксида Mn выделяется в виде
бурого осадка, однако часть его остается
в виде коллоидного раствора. Диоксид
Mn как соединение промежуточной степени
окисления проявляет окислительные и
восстановительные свойства. Для него
более характерно поведение окислителя.
При нагревании данного оксида происходит
постепенное понижение степени окисления
Mn с последовательным образованием
разных оксидов. Водородом диоксид
восстанавливается до MnO; активные
металлы (кальций или алюминий), а так
же гидриды восстанавливают его до
металла: 3MnO2 + 4Al = 2Al2O3 + 3Mn; (при нагревании).
MnO2 + CaH2 = Mn+ CaO + H2O (при нагревании). С сухим
сероводородом реакция протекает очень
быстро уже при комнатной температуре:
MnO2 + 2H2S = MnS + S + 2H2O. При пропускании
сероводорода через водную суспензию
MnO2 образуется белесый осадок. Окислительные
свойства диоксида Mn сильнее всего
проявляются в сильнокислой среде.
Бромиды и иодиды в кислой среде
восстанавливают оксид Mn (IV) в соли Mn
(II), окисляясь до простых веществ. Реакция
с хлорид-ионами протекает лишь в
сильнокислых концентрированных
растворах при нагревании, например:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O. 2NaCl + 4HNO3 + MnO2 = 2NaNO3 +
Cl2 + Mn(NO3)2 + 2H2O. В плавиковой кислоте
диоксид Mn восстанавливается до
трифторида: 4MnO2 + 12HF = 4MnF3 + O2 + 6H2O. В азотной
и разбавленной серной кислотах MnO2
нерастворим, лишь при длительном
хранении его под раствором кислоты
наблюдается постепенное выделение
кислорода вследствие окисления воды.
Взаимодействие данного оксида со
щелочами протекает лишь в концентрированных
растворах и расплавах. Реакционная
способность MnO2 в реакциях ионного
обмена намного ниже его
окислительно-восстановительной
активности. Это является следствием
его инертности. Именно поэтому, несмотря
на амфотерный характер, это вещество
в мягких условиях не реагирует с
растворами кислот и щелочей, если при
этом невозможны окислительно-восстановительные
процессы.
Оксид Mn (VII). Марганцевый ангидрид Mn2O7
является одним из наиболее сильных
окислителей. Он представляет собой
густую летучую гигроскопическую
маслянистую жидкость темно-красного
цвета, в отраженном свете кажущуюся
зеленой с металлическим блеском. При
температуре 5.9°С она превращается в
красные кристаллы. В безводной серной
и фосфорной кислотах данный оксид
образует оливково-зеленые растворы.
Вещество очень неустойчиво, оно
разлагается со взрывом при сотрясении,
в присутствии органических веществ, а
также при нагревании выше 55°С. Оксид
Mn (VII) получают действием концентрированной
серной кислоты на перманганаты щелочных
металлов: 2KMnO4 + 2H2SO4 = 2KHSO4 + Mn2O7 + H2O.
Марганцевый ангидрид – один из немногих
оксидов металлов, имеющих молекулярное
строение. При растворении в воде оксид
образует темно-фиолетовый раствор
марганцевой кислоты HMnO4. Реакция
протекает настолько быстро, что над
сосудом часто возникает красно-фиолетовый
туман, состоящий из капелек раствора
HMnO4 и постепенно превращающийся в
коричневые частицы пиролюзита.
Марганцевый ангидрид термодинамически
нестабилен: он постепенно теряет
кислород даже при температуре 0°С. Оксид
окисляет большинство кислородсодержащих
органических соединений, во многих
случаях с воспламенением. На этом
основан один из способов зажигания
спиртовки в отсутствие спичек
Соединения
в степени окисления +2. Многие соединения
Mn(II) устойчивы в водных растворах.
Гидроксид Mn(II), выпадающий в виде белого
осадка при действии щелочей на водные
растворы солей Mn(II) на воздухе быстро
окисляется: 4Mn(OH)2 + O2 = 4MnOOH + 2H2O. Более
сильные окислители, такие как бромная
вода, переводят его в пиролюзит: Mn(OH)2 +
Br2 + 2NaOH = MnO2 + 2NaBr + 2H2O. Гидроксид Mn(II)
является основанием средней силы,
превосходящим аммиак. Взаимодействием
гидроксида Mn(II) с кислотами получают
разнообразные соли. В отличии от самого
гидроксида все они устойчивы к окислению
кислородом воздуха. Соли Mn(II) образуют
гидраты, окрашенные в бледно-розовый
цвет. Некоторые гидраты: MnSO4 * 7H2O, Mn(NO3)2
* 6H2O. В водных растворах солей Mn(II)
протекает гидролиз. 2. Соединения в
степени окисления +3. В этой степени
окисления Mn может быть стабилизирован
в виде оксида и гидроксида, практически
не растворимых в воде, а так же в форме
разнообразных комплексных соединений.
Гидроксид Mn(III) образуется в виде бурого
осадка переменного состава при окислении
гидроксида Mn(II) кислородом воздуха.
Оксогидроксид Mn(III) амфотерен. При
кипячении его со щелочами образуются
красные растворы, из которых кристаллизуются
гидроксоманганаты(III), например,
Na3[Mn(OH)6] * 2.5H2O, Na4[Mn(OH)7] * 5H2O. В твердой фазе
получены соединения состава NaMnO2,
Ca2Mn2O5. Наиболее распространенным методом
получения солей Mn(III) служат
окислительно-восстановительные
превращения. Например: 2MnSO4 + H2SO4 = Mn2(SO4)3
+ H2 (эл. ток). 2KMnO4 + 4H2SO4 = Mn2(SO4)3 + K2SO4 + 2O2 +
4H2O. Если тонко измельченный порошок
KMnO4 обработать ледяной уксусной кислотой,
постепенно происходит его восстановление,
ускоряющееся при нагревании. При кипении
интенсивно выделяется CO2. Если
образовавшийся красно-коричневый
раствор смешать с концентрированной
серной кислотой до растворения осадка
и прокипятить, то при охлаждении из
него выпадают красные кристаллы квасцов:
2KMnO4 + CH3COOH + 4H2SO4 + 18H2O = 2KMn(SO4)2 * 12H2O + 2CO2.
Оксалат Mn(III) существует только в форме
комплексных соединений. Исходный
комплекс готовят, восстанавливая
перманганат избытком щавелевой кислоты
и добавляя поташ как дополнительный
источник ионов калия: KMnO4 + 5H2C2O4 + K2CO3 =
K3[Mn(C2O4)3] + 5CO2 + 5H2O. Все соединения Mn(III)
являются сильными окислителями. Они
окисляют сероводород до серы, выделяют
иод из иодида калия: Mn2(SO4)3 + 2KI = 2MnSO4 + I2 +
K2SO4. 3. Соединения в степени окисления
+4. Данная степень окисления для Mn
представлена сравнительно небольшим
числом соединений, преимущественно
комплексных. Наиболее устойчивое
соединение Mn(IV) – диоксид MnO2. Образуемые
им гидраты легко теряют воду и по причине
химической инертности не вступают в
обменные реакции с кислотами и
основаниями. Неорганические соли Mn(IV)
крайне неустойчивы и мало изучены.
Например, сульфат Mn(IV) выделяется в виде
черных кристаллов из достаточно
концентрированных сернокислых растворов
сульфата Mn(II) при добавлении в них
перманганата калия: 3MnSO4 + 2KMnO4 + 8H2SO4 =
5Mn(SO4)2 + K2SO4 + 8H2O. Соль растворима в 70%-й
серной кислоте с образованием темного
раствора: Mn(SO4)2 + 2H2O = MnO2 + 2H2SO4. Амфотерный
характер гидратированного оксида
Mn(IV) проявляется в способности образовывать
оксо- и гидроксоанионы, называемые
манганатами(IV) или манганитами. Многие
комплексные соединения Mn(IV) обладают
сильными окислительными свойствами.
Неудивительно, так как для более высоких
степеней окисления Mn комплексы
нехарактерны. Для Mn характерно образование
полиядерных комплексов, в состав которых
одновременно входят несколько атомов
металла. 4. Соединения в степенях
окисления +5, +6, +7. Манганаты (V) (K3MnO4)
исторически называют гипоманганатами,
манганаты (VI) (K2MnO4) – манганаты, а
манганаты (VII) (KMnO4) – перманганатами.
Яркая окраска зависит от степени
окисления: гипоманганаты – синие,
манганаты – зеленые, перманганаты –
фиолетовые. Гипоманганаты присутствуют
в продуктах высокотемпературного
термического разложения перманганатов
или манганатов: 3K2MnO4 à 2K3MnO4 + MnO2 + O2 (при
температуре 500-850°С). Полученная таким
образом соль представляет собой
сине-зеленый кристаллический порошок,
устойчивый только в отсутствие следов
влаги. Впервые манганаты приготовил
Глаубер при растворении пиролюзита в
расплавленной селитре. Эти вещества
представляют собой темно-зеленые, почти
черные кристаллы, растворимые в растворах
щелочей с образованием изумрудно-зеленых
растворов. В нейтральных и слабокислых
растворах манганаты легко диспропорционируют:
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH, при этом выпадает
темно-коричневый осадок диоксида и
появление малинового окрашивания
раствора. Для ускорения процесса обычно
через раствор пропускают углекислый
газ или добавляют соль аммония. Среди
манганатов наибольшее значение имеет
калийная соль K2MnO4, служащая для
производства перманганата KMnO4. При
синтезе манганатов в качестве окислителей
могут быть использованы пероксиды и
азиды: BaO2 + MnO2 = BaMnO4. 4MnO2 + KN3 + 7KOH + H2O = 4K2MnO4
+ 3NH3. В лабораторных условиях манганаты
щелочных металлов удобно получать
окислением воды перманганатом в
сильнощелочном растворе. Для этого
перманганат помещают в концентрированный
раствор щелочи и нагревают. Манганаты
термически менее устойчивы, чем
гипоманганаты; K2MnO4 разлагается при
600°С, выделяя кислород. При увеличении
степени окисления Mn термическая
устойчивость оксоманганатов уменьшается,
а их окислительное действие усиливается.
Практического значения манганаты и
гипоманганаты не имеют, так как в водных
растворах легко диспропорционируют.
К методам синтеза перманганатов относят
диспропорционирование манганатов и
обменные реакции между солями: KMnO4 +
NH4Cl = NH4MnO4 + KCl. Таким же способом удается
получить растворы марганцевой кислоты
HMnO4: Ba(MnO4)2 + H2SO4 = BaSO4 + 2HMnO4. Марганцевая
кислота в чистом виде не получена. Она
относится к сильным кислотам. Разбавленные
свежеприготовленные водные растворы
марганцевой кислоты можно нагревать
до кипения без заметного разложения.
Однако при длительном хранении они
постепенно распадаются с осаждением
MnO2 и выделением кислорода: 4HMnO4 = 4MnO2 +
3O2 + 2H2O. Соли марганцевой кислоты – одни
из важнейших неорганических окислителей.
С их помощью можно окислить многие
органические и неорганические вещества.
При действии на подкисленный раствор
перманганата калия разных восстановителей
происходит его обесцвечивание: 10FeSO4 +
2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O.
Химические
свойства KMnO4: Является сильным окислителем.
В зависимости от pH раствора окисляет
различные вещества, восстанавливаясь
до соединений марганца разной степени
окисления. В кислой среде — до соединений
марганца (II), в нейтральной — до соединений
марганца (IV), в сильно щелочной — до
соединений марганца (VI). Примеры реакций
приведены ниже (на примере взаимодействия
с сульфитом калия: в кислой среде: 2KMnO4
+ 5K2SO3 + 3H2SO4 → 6K2SO4 + 2MnSO4 + 3H2O; в нейтральной
среде: 2KMnO4 + 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH; в
щелочной среде: 2KMnO4 + K2SO3 + 2KOH → K2SO4 +
2K2MnO4 + H2O; в щелочной среде на холоде:
KMnO4 + K2SO3 + KOH → K2SO4 + K3MnO4 + H2O. Однако надо
отметить, что последняя реакция (в
щелочной среде) идёт по указанной схеме
только при недостатке восстановителя
и высокой концентрации щёлочи, которая
обеспечивает замедление гидролиза
манганата калия.
Из
всех элементов группы VIIB наибольшее
применение находит Mn, прежде всего в
металлургии. Mn является одним из
важнейших компонентов при производстве
сталей (используется как раскислитель
для удаления серы и кислорода), а также
при производстве высокопрочных
сплавов. Соединения марганца широко
используется как окислители и катализаторы
в различных химических процессах. —
деполяризатор в химических источниках
тока.
Соединения
технеция могут применяться в качестве
ингибиторов коррозии в ядерных реакторах.
Рений
используется в радиоэлектронике, при
производстве специальных сплавов.
Рениевые катализаторы весьма эффективны
для процессов гидрирования.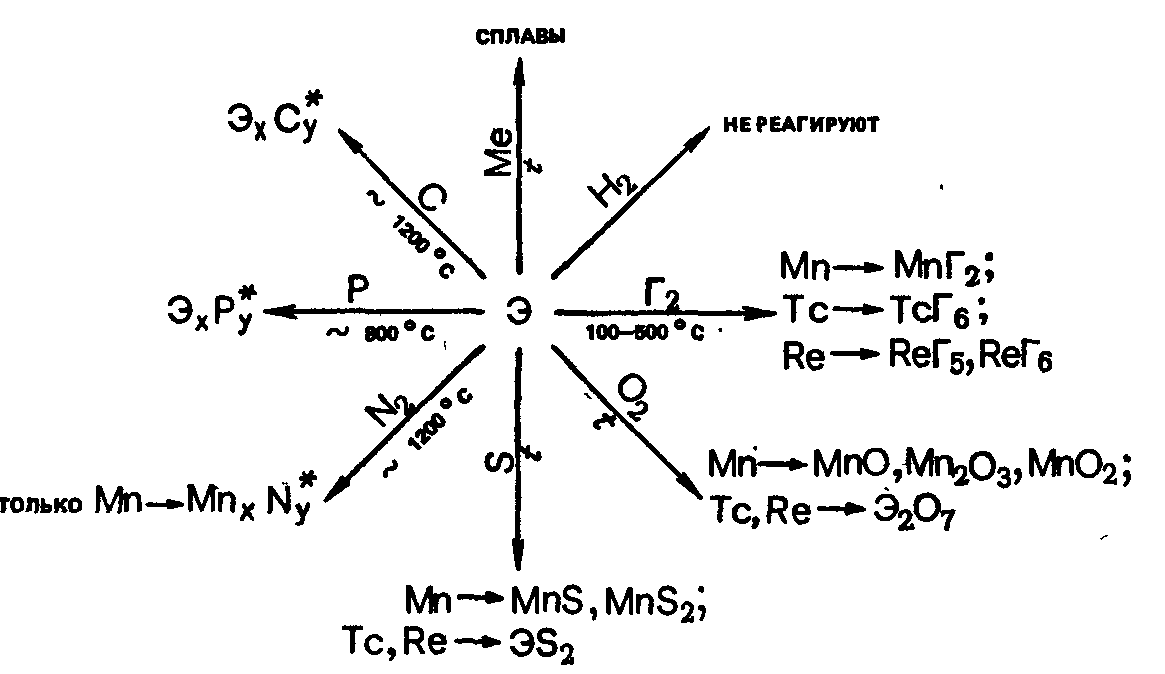
 В
бинарных соединениях Mn, Tc и Re проявляют
степени окисления от+2 до +7. Устойчивость
соединений с низшим степенями окисления
(+2,+3,+4) от Mn к Re снижается, а с высшими
(+6,+7) растет. Поэтому соединения Mn+6 и
Mn+7- сильные окислители, а соединения
Те и Re в низших степенях окисления-
хорошие восстановители.
В
бинарных соединениях Mn, Tc и Re проявляют
степени окисления от+2 до +7. Устойчивость
соединений с низшим степенями окисления
(+2,+3,+4) от Mn к Re снижается, а с высшими
(+6,+7) растет. Поэтому соединения Mn+6 и
Mn+7- сильные окислители, а соединения
Те и Re в низших степенях окисления-
хорошие восстановители.
68) Общая характеристика элементов семейства железа. Свойства простых веществ. Оксиды, гидроксиды и соли железа, кобальта и никеля. Гидролиз солей железа. Комплексные соединения железа и кобальта и их роль в процессах жизнедеятельности живых организмов.
Семейство
железа входит
в состав побочной подгруппы восьмой
группы и является в ней первой триадой,
включающей в себя железо,
кобальти
никель.
Эти элементы имеют два электрона на
наружном слое атома, все они являются
металлами. По свойствам все три элемента
похожи между собой. Для них характерна
степень окисления 2, 3, 4. Реже проявляются
более высокие степени окисления. Ни
один элемент из семейства железа не
проявляет максимальной степени окисления
+8. Все металлы триады образуют
разнообразные соединения, проявляя
степени окисления +2 и +3. Проявление
высокой степени окисления и амфотерных
свойств характерно для железа.
Температуры
плавления элементов триады железа
высокие, тем не менее, ниже, чем у
элементов, находящихся в серединах
серий переходных металлов.
Железо–
первый элемент в переходных рядах,
имеющий спаренный электрон на внутренней
d-орбитали. Спаренные электроны с такой
орбитали труднее участвуют в образовании
химической связи, чем неспаренные. У
триады железа существуют особенности
орбитального строения, проявляющиеся
в виде магнитных и ферромагнитных
свойств. В результате ориентированности
атомов металлы образуют постоянные
магниты. Все металлы семейства железа
проявляют электроположительное
поведение. Инертны в среде окислителя,
даже кислорода, так как образуют оксидные
пленки.
Химические
свойства железа:
1)
взаимодействует с кислородом при
высоких температурах;
2)
оксиды в низшей степени окисления MO;
3)
при взаимодействии с галогенами образует
галогениды, дигалогениды;
4)
образует комплексные соединения;
5)
образует карбонилы–
соединения, в которых переходный металл
образует связь с ионом металла или
водорода и координированными карбониловыми
группами(пентакарбонил
кобальта [Co(CO)5]);
6)
взаимодействуют с серой и сероводородом
при нагревании, образуя сульфиды.
Железо–
второй (после алюминия) по распространенности
металл, встречается в виде различных
руд, пригодных для переработки. Из них
получают почти чистый Fe3O4,
который вместе с известняком и коксом
используется для выплавки чугуна в
доменной печи.
Кобальт
выделяют
из руд, содержащих много мышьяка и
некоторой доли серебра, достаточной
для промышленной переработки.
Никель–
в руде много примесей: сульфиды никеля,
меди и железа. Половина получаемого
никеля расходуется в производстве
стали для повышения ее коррозионной
стойкости и твердости. Он используется
также для создания прочных покрытий
на стальных изделиях.
Оксид
железа FeO(II)
Физические
свойства FeO(II):
• кристаллы
черного цвета;
• плотность
5,7 г/см3;
• нерастворим
в воде.
Химические
свойства FeO(II):
• это
основной оксид;
• легко
вступает в реакции с кислотами, образуя
соли железа: FeO+H2SO4 = FeSO4+H2O; FeO+2HCl = FeCl2+H2O
• легко
окисляется кислородом воздуха: 4FeO+O2 =
2Fe2O3
• FeO(II)
получают восстановлением FeO(III) при
высоких температурах: Fe2O3+H2 = 2Fe+H2O;
Fe2O3+CO = 2FeO+CO2↑
Гидроксид
железа Fe(OH)2(II)
Физические
свойства Fe(OH)2:
• белый
порошок;
• на
воздухе частично окисляется, приобретая
зеленый оттенок;
• не
растворяется в воде.
Химические
свойства Fe(OH)2:
• Fe(OH)2
проявляет основные свойства;
• в
присутствии влаги окисляется, образуя
гидроксид железа (III), приобретая при
этом бурый цвет: 4Fe(OH)2+O2+2H2O = 4Fe(OH)3
• легко
реагирует с кислотами: Fe(OH)2+2HCl = FeCl2+2H2O
Fe(OH)2+H2SO4 = FeSO4+2H2O
• в
концентрированных растворах щелочей
образует ферраты (комплексные соли
железа) при кипячении: Fe(OH)2+2NaOH =
Na2[Fe(OH)4]
• разлагается
при нагревании: Fe(OH)2 = FeO+H2O
Получают
Fe(OH)2 из солей железа (II) при их взаимодействии
с щелочами: FeCl2+2NaOH = Fe(OH)2+2NaCl FeSO4+2NaOH =
Fe(OH)2+Na2SO4
Поскольку,
Fe+2 легко окисляется до Fe+3, все соединения
железа(II) являются восстановителями.
Также восстановительными свойствами
обладают и соли железа (II).
Качественная
реакция на катион железа (II):
• для
обнаружения Fe+2 используют красную
кровяную соль (гексацианоферрат калия):
3FeSO4+2K3[Fe(CN)6] = Fe3[Fe(CN)6]2↓+3K2SO4
• о
присутствии катионов железа судят по
образовавшемуся осадку темно-синего
цвета (турнбулева
синь):
3Fe2++2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓
Оксид
железа Fe2O3(III)
Физические
свойства Fe2O3:
• порошок
бурого цвета;
• может
существовать в трех модификациях: α,
β, γ
• нерастворим
в воде.
Химические
свойства Fe2O3:
• Fe2O3
проявляет амфотерные свойства;
• реагирует
с кислотами: Fe2O3+6HCl = 2FeCl3+3H2O Fe2O3+3H2SO4 =
Fe2(SO4)3+3H2O
• реагирует
с твердыми щелочами при высокой
температуре: Fe2O3+2NaOH = 2NaFeO2+H2O Fe2O3+2KOH =
2KFeO2+H2O
• реагирует
с карбонатами натрия и калия при высокой
температуре: Fe2O3+Na2CO3 = 2NaFeO2+CO2
• реагирует
с восстановителями: Fe2O3+2Al = 2Fe+Al2O3 3Fe2O3+CO
= 2Fe3O4+CO2↑
Fe2O3
получают:
• обжигом
пирита: 4FeS2+11O2 = 2Fe2O3+8SO2↑
• разложением
гидроксида железа (III): 2Fe(OH)3 = Fe2O3+3H2O
Fe2O3
содержится в буром и красном железняке,
являющихся исходным сырьем в производстве
чугуна.
Гидроксид
железа Fe(OH)3(III)
Физические
свойства Fe(OH)3:
• вещество
рыхлой консистенции красно-коричневого
цвета.
Химические
свойства Fe(OH)3:
• Fe(OH)3
является слабым основанием;
• Fe(OH)3
проявляет амфотерные свойства с
преобладанием оснОвных;
• реагирует
с разбавленными кислотами с образованием
солей: Fe(OH)3+3HCl = FeCl3+3H2O
• реагирует
с концентрированными растворами щелочей
при длительном нагревании с образованием
устойчивых гидроксокомплексов:
Fe(OH)3+3NaOH = Na3[Fe(OH)6]
• при
нагревании разлагается с образованием
оксида железа (III): 2Fe(OH)3 = Fe2O3+3H2O
• Fe(OH)3
получают из солей железа (III) при их
взаимодействии с щелочами: Fe(OH)3+3NaOH =
Fe(OH)3↓+3NaCl
Поскольку,
под действием восстановителей Fe+3
превращается в Fe+2, все соединения железа
со степенью окисления +3 являются
окислителями: 2Fe+3Cl3+2KI-1 = 2Fe+2Cl2+2KCl+I20
Качественные
реакции на катион железа (III):
• катионы
Fe+3 обнаруживаются действием желтой
кровяной соли
(гексацианоферрат калия) - реакция идет
с выпадением берлинской
лазури
(осадка темно-синего цвета):
4Fe+3Cl3+3K4[Fe(CN)6]-4 = Fe4[Fe(CN)6]3↓+12KCl
• катионы
Fe+3 обнаруживаются роданидом аммония
(в результате реакции образуется роданид
железа красного цвета): Fe+3Cl3+3NH4CNS- ↔
Fe(CNS)3+3NH4Cl
Соли
железа
• Соли,
в которых железо имеет степень окисления
+2 (FeCl2, FeSO4), обладают восстановительными
свойствами:
o
сульфат
железа FeSO4
применяют в качестве фунгицидов,
консерванта древесины, как компонент
электролитов;
o
хлорид
железа FeCl2
применяют для получения хлорида железа
(III), в качестве катализатора в органическом
синтезе.
• Соли,
в которых железо имеет степень окисления
+3 (FeCl3, Fe2(SO4)3), являются слабыми окислителями:
o
сульфат
железа Fe2(SO4)3
применяют для очистки воды, для получения
квасцов, как компонент электролитов;
o
хлорид
железа FeCl3
применяют в качестве коагулятора при
очистке воды, катализатора в органическом
синтезе, протравы при крашении текстиля.
Степень
окисления +2 характерна для кобальта и
никеля.
Оксиды
кобальта (II) CoO и никеля (II) NiO.
Оксид
кобальта (II) – серые, коричневые или
оливково-зеленые кристаллы с кубической
решеткой. Оксид никеля (II) – в зависимости
от способа получения изменяет цвет от
светло- до темно-зеленого и черного.
При обычных условиях устойчивы кристаллы
гексагональной сингонии, выше 252 °С –
кристаллы кубической сингонии.
Оксиды
обладают слабовыраженными амфотерными
свойствами с преобладанием основных.
Практически не растворяются в воде,
реагируют с кислотами с образованием
солей, например:
CoO
+ 2HCl = CoCl2 + H2O.
Растворяются
в расплавах щелочей, а при доступе
воздуха – в водном растворе аммиака:
NiO
+ Ba(OH)2 = BaNiO2 + H2O.
Получаются
при термическом разложении гидроксидов
в инертной атмосфере или при термическом
разложении смешанных оксидов:
Ni(OH)2
= NiO + H2O,
2Co3O4
= 6CoO + O2.
Гидроксиды
кобальта (II) Co(OH)2 и никеля (II) Ni(OH)2.
Гидроксид
кобальта (II) существует в двух аллотропных
модификациях: синей (α-форма) и розовой
(β-форма).
Гидроксид
никеля (II) осаждается в виде объемного
геля яблочного цвета.
Гидроксиды
практически не растворимы в воде,
проявляют в основном основные свойства.
Реагируют с кислотами, например:
Co(OH)2
+ 2HCl = CoCl2 + 2H2O.
Растворяются
в водных растворах аммиака с образованием
аммиачных комплексов, например:
Ni(OH)2
+ 6NH3 = [Ni(NH3)6](OH)2.
Гидроксид
кобальта растворяется в концентрированных
растворах щелочей с образованием
гексагидроксокобальтата (II) натрия,
что свидетельствует о проявлении
слабовыраженных кислотных свойств:
Co(OH)2
+ 4NaOH = Na4[Co(OH)6].
При
нагревании гидроксиды разлагаются,
например:
Ni(OH)2
= NiO + H2O.
Аналогично
гидроксиду железа (II), гидроксид кобальта
(II) медленно окисляется кислородом
воздуха:
4Сo(OH)2
+ O2 + 2H2O = 4Co(OH)3.
Гидроксид
никеля (II) на воздухе устойчив.
Получаются
при взаимодействии солей металлов (II)
с раствором щелочи:
CoSO4
+ 2NaOH = Co(OH)2 + Na2SO4
NiSO4
+ 2NaOH = Ni(OH)2 + Na2SO4
Соли
кобальта (II) и никеля (II).
Кобальт
(II) образует соли практически со всеми
анионами. Обычно соли кристаллизуются
в виде розовых или красных кристаллогидратов:
Co(NO3)2·6H2O, CoSO4·7H2O, CoCl2·6H2O и др. Растворы
солей имеют ярко-розовую окраску,
характерную для аквакомплексов кобальта
(II).
Никель
(II) также образует большое количество
солей. Обычно соли кристаллизуются в
виде зеленых кристаллогидратов
(различных оттенков): Ni(NO3)2·6H2O, NiSO4·6H2O,
Fe(ClO4)2·6H2O, K2Ni(SO4)2·6H2O и др. Растворы солей
имеют ярко-зеленую окраску, характерную
для аквакомплексов никеля (II).
Соли
кобальта (II) и никеля (II) проявляют все
свойства солей.
Гидролиз
солей железа. Рассмотрим на примере
FeCl3
Гидролиз
хлорида железа (III) FeCl3
FeCl3
- соль образованная слабым основанием
и сильной кислотой, поэтому реакция
гидролиза протекает по катиону. Первая
ступень (стадия) гидролиза.
Молекулярное
уравнение FeCl3 + HOH ⇄ FeOHCl2 + HCl
Полное
ионное уравнение Fe3+ + 3Cl- + HOH ⇄ FeOH2+ + 2Cl-
+ H+ + Cl-
Сокращенное
(краткое) ионное уравнение Fe3+ + HOH ⇄
FeOH2+ + H+
Вторая
ступень (стадия) гидролиза
Молекулярное
уравнение FeOHCl2 + HOH ⇄ Fe(OH)2Cl + HCl
Полное
ионное уравнение FeOH2+ + 2Cl- + HOH ⇄ Fe(OH)2+ +
Cl- + H+ + Cl-
Сокращенное
(краткое) ионное уравнение FeOH2+ + HOH ⇄
Fe(OH)2+ + H+
Третья
ступень (стадия) гидролиза
Молекулярное
уравнение Fe(OH)2Cl + HOH ⇄ Fe(OH)3 + HCl
Полное
ионное уравнение Fe(OH)2+ + Cl- + HOH ⇄ Fe(OH)3 +
H+ + Cl-
Сокращенное
(краткое) ионное уравнение Fe(OH)2+ + HOH ⇄
Fe(OH)3 + H+
В
результате гидролиза образовались
ионы водорода (H+), поэтому раствор имеет
кислую среду (pH < 7). У элементов триады
железа ярко проявляется способность
d-элементов образовывать комплексные
соединения.
Известны
катионные аквакомплексы [Э(H2O)6]2+ и
[Э(H2O)6]3+, аммиачные комплексы [Э(NH3)6]2+ и
[Э(NH3)6]3+. Устойчивость аммиачных комплексов
увеличивается в ряду Fe – Co – Ni.
[Fe(NH3)6]2+ и [Co(NH3)6]2+ устойчивы только в
твердой фазе и насыщенном водном
растворе аммиака, аммиачный комплекс
[Ni(NH3)6]2+ в водном растворе устойчив.
Аммиачный комплекс железа (III) не
устойчив, никеля (III) – не существует,
а [Co(NH3)6]2+ – устойчив.
Многочисленны
анионные комплексы элементов триады
железа. Характерны галогенидные
M+[Э2+Г3], M+2[Э2+Г4], M+3[Э2+Г6] и др., роданидные
M+2[Э2+(CNS)4], M+4[Э2+(CNS)6], оксалатные
M+2[Э2+(C2O4)2], M+3[Э3+(C2O4)3] комплексы. Особенно
устойчивы цианидные комплексы, например:
K3[Fe(CN)6] и K4[Fe(CN)6], которые используются
в аналитической химии для обнаружения
ионов Fe2+ и Fe3+.
Элементы
триады железа образуют большое количество
комплексных соединений с органическими
лигандами, например: диметилглиоксимат
никеля – реактив Чугаева и гемоглобин
– внутрикомплексное соединение железа
