
- •1) Предмет и задачи общей и неорганической химии. Роль химии в системе естественных наук.
- •4) Важнейшие классы и номенклатура неорганических веществ.
- •8) Периодичность свойств химических элементов.
- •9) Природа химической связи. Основные типы химической связи.
- •10) Ковалентная химическая связь. Способы образования ковалентной связи. Валентность.
- •11) Свойства ковалентной связи. Степень окисления атома.
- •13) Основы метода молекулярных орбиталей.
- •14) Ионная и металлическая связь. Водородная связь. Межмолекулярное взаимодействие.
- •17)Влияние температуры на скорость химической реакции. Основные положения теории активации Аррениуса.
- •18) Катализ. Влияние катализатора на скорость химической реакции.
- •19) Необратимые и обратимые реакции. Химическое равновесие. Принцип Ле-Шателье.
- •20) Дисперсные системы. Коллоидные растворы.
- •21)Растворение как физико - химический процесс.
- •22) Растворимость веществ. Состав растворов.
- •23)Основные положения теории электролитической диссоциации.
- •24)Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
- •25)Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
- •26) Константа диссоциации слабых электролитов. Закон разбавления Оствальда.
- •27) Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
- •28) Диссоциация воды. Константа диссоциации, ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •29) Произведение растворимости. Условия образования и растворения осадков. Реакции обмена в растворах электролитов.
- •30) Гидролиз солей. Количественные характеристики гидролиза.
- •32) Ионно-электронный метод (метод полуреакций). Классификация окислительно-восстановительных реакций.
- •33) Электрохимические процессы. Электродный потенциал. Стандартные электродные потенциалы. Водородный электрод.
- •34) Электрохимический ряд напряжений металлов. Уравнение Нернста. Гальванический элемент и его э.Д.С. Влияние условий на протекание окислительно-восстановительных процессов.
- •36) Устойчивость комплексных соединений. Понятие о двойных солях. Биологическая роль комплексных соединений.
- •37) Общая характеристика водорода. Гидриды. Ион водорода и ион гидроксония.
- •39) Галогеноводороды. Галогениды. Особенности плавиковой кислоты. Соляная кислота. Роль соляной кислоты и хлоридов в живых организмах.
- •40) Кислородсодержащие соединения галогенов. Кислородные кислоты хлора и их соли. Хлорная известь. Бертолетова соль. Перхлораты. Кислородосодержащие кислоты брома, иода и их соли.
- •41) Общая характеристика элементов via группы. Особенности кислорода. Аллотропия и изоморфизм серы. Свойства простых веществ. Применение и биологическое значение халькогенов.
- •42) Гидриды типа н2э. Ассоциация молекул воды. Токсичность сероводорода и других халькогеноводородов, их физиологическое действие.
- •44) Халькогениды. Растворимость и гидролиз сульфидов металлов. Полисульфиды.
- •45) Оксиды халькогенов. Диоксиды и триоксиды элементов. Сернистая, селенистая и теллуристая кислоты.
- •47) Общая характеристика элементов va группы. Свойства простых веществ. Аллотропия фосфора. Круговорот азота и фосфора в природе.
- •48) Гидриды типа эн3. Аммиак. Соли аммония. Аммиакаты. Гидроксиламин. Пептидная связь в белках.
- •49) Кислородсодержащие соединения азота. Оксиды азота. Физиологическое действие. Азотистая кислота и ее соли. Физиологическое действие.
- •51) Кислородсодержащие соединения фосфора. Оксиды фосфора (ііі) и (V). Кислородсодержащие кислоты фосфора и их соли. Фосфорная, фосфористая и фосфорноватистая кислоты. Роль в биологических процессах.
- •56) Кислородсодержащие соединения углерода. Оксиды углерода. Токсичность оксида углерода (іі). Роль оксида углерода(іv) в процессах жизнедеятельности. Парниковый эффект.
- •57) Угольная кислота и ее соли. Временная жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
- •59) Общая характеристика металлов. Общая характеристика валентных состояний металлов а и в групп. Значение и роль металлов в жизнедеятельности живых организмов.
- •60) Щелочные металлы. Общая характеристика оксидов, пероксидов, гидроксидов и солей. Калийные удобрения. Роль натрия и калия в жизнедеятельности живых организмов.
- •61) Бериллий. Магний. Щелочно-земельные металлы. Общая характеристика оксидов, гидроксидов, солей элементов группы iiа. Их роль в живой природе.
- •62) Алюминий. Подгруппа галлия. Общая характеристика оксидов, гидроксидов и солей элементов группы. Борная кислота и бораты. Амфотерность алюминия. Алюминаты. Гидролиз солей алюминия.
- •63) Металлы iva группы. Общая характеристика элементов. Токсичность свинца.
- •66) Общая характеристика элементов группы хрома. Свойства простых веществ. Соединения хрома (ііі) и их особенности. Соединения xpoмa (VI): хромовые кислоты и их соли. Роль в живой природе.
63) Металлы iva группы. Общая характеристика элементов. Токсичность свинца.
В
IV A группу входят следующие элементы:
углерод
(С), кремний (Si), германий (Ge), олово (Sn),
свинец (Pb).
Они принадлежат к семейству р-элементов
и встречаются в природе только в
связанном виде. Исключение составляет
углерод, который в значительных
количествах присутствует на Земле и в
свободном виде, образуя простые вещества:
алмаз, графит.
Из
элементов IV A группы наиболее распространены
на Земле кремний (массовая доля в земной
коре ≈ 27%) и углерод (≈ 0,1% по массе).
Кремний при этом занимает второе место
по распространенности среди всех
элементов, уступая только кислороду.
Германий, олово и свинец встречаются
в природе значительно реже (≈ 7 ∙ 10-4%,
4 ∙ 10-3% и 1,6 ∙ 10-3% по массе, соответственно).
Все
элементы IV A группы присутствуют на
Земле в виде нескольких стабильных
нуклидов. Причем больше всего нуклидов
(10) имеет олово; у свинца и германия их
– по 4 у каждого; у кремния – 3 и у углерода
– 2.
Физические
и химические свойства элементов iva
группы
По
своим физическим и химическим свойствам
углерод и кремний принадлежат к
неметаллам, германий является амфотерным
или переходным элементом, а олово и
свинец в целом характеризуются как
металлы.
Некоторые
физические свойства атомов элементов
IVA группы и образуемых ими простых
веществ представлены в таблице 7. Как
видно, с ростом атомного номера элемента
наблюдается увеличение радиусов его
атомов, уменьшение значения энергии
ионизации и относительной
электроотрицательности.
Таким
образом, для элементов IVA группы сверху
вниз происходит типичное усиление
металлических свойств, а, значит, и их
восстановительной способности.
Атомы
элементов IV A группы имеют одинаковое
строение внешнего электронного слоя
и содержат на нем 4 электрона:
Углерод
отличается от всех остальных элементов
тем, что на внешнем энергетическом
уровне у него отсутствует d-подуровень.
В
невозбужденном состоянии элементы IV
A группы имеют на внешнем слое только
2 неспаренных электрона. Значит,
валентность их в этом случае будет
равна 2 и по обменному механизму они
могут образовать только 2 ковалентные
связи. В возбужденном состоянии число
неспаренных электронов может увеличиваться
до 4 за счет распаривания электронной
пары:
Соответственно,
и валентность в этом случае тоже будет
равна 4.
Элементы
подгруппы углерода могут в соединениях
проявлять как положительную, так и
отрицательную степень окисления.
Положительную
степень окисления они проявляют при
взаимодействии с более электроотрицательными
атомами, чем сами, выступают в роли
восстановителей и отдают другим атомам
с внешнего слоя свои неспаренные
электроны. Величина степени окисления
при этом равна +2 в невозбужденном
состоянии или +4 в возбужденном состоянии.
Причем степень окисления +2 для элементов,
стоящих в начале группы (C, Si, Ge), мало
характерна. Такие их соединения
малочисленны, неустойчивы и в момент
образования легко превращаются в
соединения со степенью окисления +4.
Однако для элементов, стоящих в конце
группы, устойчивость таких соединений
повышается и они (например, для Pb, Sn)
легко могут быть получены.
Отрицательную
степень окисления элементы подгруппы
углерода проявляют при взаимодействии
с атомами менее электроотрицательных
элементов, чем сами. В этом случае они
выступают в роли окислителей и забирают
от других атомов 4 недостающих до
завершения своего внешнего слоя
электрона. Величина степени окисления
при этом равна –4.
С
водородом элементы подгруппы углерода
образуют соединения общего вида RH4.
Это газообразные вещества, плохо
растворимые в Н2О. Их водные растворы
не обладают ни кислотными, ни основными
свойствами. Устойчивость водородных
соединений в группе сверху вниз резко
уменьшается. Уже силан (SiH4) при обычных
условиях может самопроизвольно
разрушаться, а PbH4 выделить не удается.
Элементы
подгруппы углерода образуют с кислородом
оксиды общей формулы
Оксиды
RO2 обладают кислотными свойствами, им
соответствуют кислоты вида H2RO3. Сила
этих кислот в группе сверху вниз убывает,
что объясняется увеличением в той же
последовательности у ее элементов
металлических свойств. Причем чисто
кислотными свойствами обладают только
данные оксиды и гидроксиды углерода,
кремния и германия. Для всех остальных
элементов группы (Sn, Pb) гидраты их высших
оксидов и сами эти оксиды являются уже
амфотерными соединениями.
В
IVA группе закономерно изменяются
физические свойства и реакционная
способность простых веществ, образованных
ее элементами. Так, сверху вниз (табл.
5) увеличиваются их плотность,
восстановительная способность,
металлические свойства. Косвенным
подтверждением этому служит уменьшение
в этом же направлении температуры
плавления простых веществ.
Углерод
и кремний являются типичными неметаллами,
их простые вещества имеют атомную
кристаллическую решетку, образованную
ковалентными неполярными связями, и,
как следствие этого – высокую температуру
плавления.
При
переходе от германия к олову происходит
резкое изменение природы атомных связей
в кристаллах простых веществ от
ковалентных с небольшой примесью
металлических (германий), к чисто
металлическим (олово, свинец). Металлическая
связь в олове и свинце ввиду больших
размеров атомов сравнительно слабая,
поэтому значения температуры плавления
их простых веществ небольшие.
Следует
отметить, что металлические свойства
простых веществ элементов IVA группы
выражены сильнее, чем у ранее изученных
простых веществ галогенов, халькогенов
и пниктогенов. По сравнению с ними
простые вещества IVA группы являются
более слабыми окислителями, а гидраты
их высших оксидов обладают более слабыми
кислотными свойствами.
Токсичность
свинца :
Свинец
и многие его соединения токсичны.
Особенно ядовиты водорастворимые,
например, ацетат свинца(II) и летучие,
например, тетраэтилсвинец, соединения.
Токсичны и пары расплавленного свинца.
При остром отравлении наступают боли
в животе, в суставах, судороги, обмороки.
Отравлéние
свинцóм (сатурнизм, от лат. saturnus (по
имени планеты) — свинец)[2] — наиболее
распространённый вид отравлений
тяжёлыми металлами. Обычно заболевание
наблюдается у детей от года до пяти
лет. Свинец, как правило, попадает в
организм человека при вдыхании
свинецсодержащей пыли, копоти и паров,
что вызывает психотропное, нейротоксическое
и гемолитическое действия. Попадая в
организм, органические соединения
металла превращаются в неорганические,
что приводит к хронической интоксикации.
Характеризуется отравление поражением
всех отделов головного мозга
![]()
![]() и
и
![]()
![]() .
Оксиды RO для элементов, стоящих в начале
группы (С и Si), являются несолеобразующими,
а для остальных элементов группы –
амфотерными с постепенным нарастанием
основных свойств. Так, у GeO преобладают
кислотные свойства, а у PbO – основные.
.
Оксиды RO для элементов, стоящих в начале
группы (С и Si), являются несолеобразующими,
а для остальных элементов группы –
амфотерными с постепенным нарастанием
основных свойств. Так, у GeO преобладают
кислотные свойства, а у PbO – основные.
Понятие
переходный элемент обычно используется
для обозначения любого элемента с
валентными d- или f-электронами. Эти
элементы занимают в периодической
таблице переходное положение между
электроположительными s-элементами и
электроотрицательными p-элементами.
d-Элементы
принято называть главными переходными
элементами. Их атомы характеризуются
внутренней застройкой d-подоболочек.
Дело в том, что s-орбиталь их внешней
оболочки обычно заполнена уже до того,
как начинается заполнение d-орбиталей
в предшествующей электронной оболочке.
Это означает, что каждый новый электрон,
добавляемый в электронную оболочку
очередного d-элемента, в соответствии
с принципом заполнения, попадает не на
внешнюю оболочку, а на предшествующую
ей внутреннюю подоболочку. Химические
свойства этих элементов определяются
участием в реакциях электронов обеих
указанных оболочек.
d-Элементы
образуют три переходных ряда — в 4-м,
5-м и 6-м периодах соответственно. Первый
переходный ряд включает 10 элементов,
от скандия до цинка. Он характеризуется
внутренней застройкой 3d-орбиталей.
Орбиталь 4s заполняется раньше, чем
орбиталь 3d, потому что имеет меньшую
энергию (правило Клечковского).
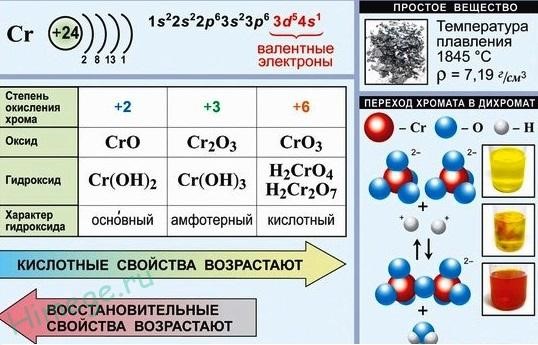
Следует,
однако, отметить существование двух
аномалий. Хром и медь имеют на своих
4s-орбиталях всего по одному электрону.
Дело в том, что полузаполненные или
полностью заполненные подоболочки
обладают большей устойчивостью, чем
частично заполненные подоболочки.
В
атоме хрома на каждой из пяти 3d-орбиталей,
образующих 3d-подоболочку, имеется по
одному электрону. Такая подоболочка
является полузаполненной. В атоме меди
на каждой из пяти 3d-орбиталей находится
по паре электронов. Аналогичная аномалия
наблюдается у серебра.
Все
d-элементы являются металлами.
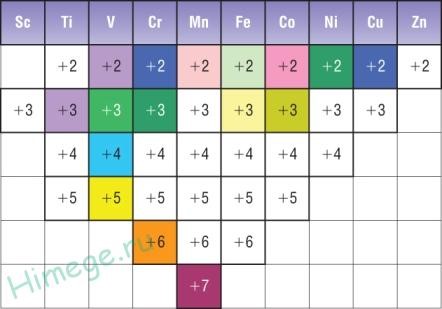
Характерные
степени окисления d элементов:
Являются
в организме человека в основном
микроэлементами.Наряду с
ферментами,гормонами,витаминами и
другими биологически активными
веществами микроэлементы участвуют в
процессах обмена нуклеиновых кислот,
белков,жиров и углеводов.Из d-элементов
важную роль в организме играют
железо,кобальт,цинк и молибден.Биологические
функции микроэлементов в живом организме
связаны главным образом с процессом
комплексообразования между
аминокислотами,белками, нуклеиновыми
кислотами и ионами соответствующих
металлов.Соединения d-элементов
используются в качестве лекарственных
препаратов, в избыточных концентрациях
они ядовиты(это связано с тем, что
d-элементы образуют с белками нерастворимые
соединения).
Цинк
входит в состав большого числа ферментов
и гормона инсулина.Он необходим для
нормальной концентрации витамина А в
плазме.Влияет на синтез нуклеиновых
кислот и участвует в передаче генетической
информации.Соли цинка обладают
антисептическим действием.
Марганец
в организме содержится в количестве
0,36 ммоль.Входит в состав
ферментов,катализирующих ОВР.Соединения
марганца участвуют в синтезе витамина
С в организме.Перманганат калия является
окислителем и обладает антисептическим
действием.
Железо
в организме содержится в количестве
равном приблизительно 5 граммам.Входит
в состав гемоглобина.Избыток железа
может привести к нарушению деятельности
сердечно-сосудистой системы,печени,лёгких.
Кобальт
входит в состав важных белковых
молекул,активирует действие ряда
ферментов.Дефицит кобальта в тканях
снижает способность организма защищаться
от различных инфекций.
Медь
содержится в организме в количестве
1,1 ммоль.Активирует синтез
гемоглобина,участвует в процессах
клеточного дыхания,синтезе белка,образовании
костной ткани и пигмента кожных
покровов.Ионы меди входят в состав
медьсодержащих ферментов(оксидаз),
которые катализируют ОВР. Накопление
меди в организме способствует развитию
хронического гепатита.Избыток меди
откладывается печени,мозге,почках,глазах,
вызывает тяжелые заболевания-болезнь
Вильсона.Все соли меди ядовиты.Токсичное
действие обуславливается тем, что медь
образует с белками нерастворимые
альбуминаты, образуя прочную связь с
аминным азотом и группой SH-белков.
Серебро-примесный
микроэлемент, в организме содержится
7,3 ммоль.В медицине препараты серебра
используют наружно, как вяжущее,
прижигающее, бактерицидное средство.Серебро
используется для получения "серебряной
воды", которую используют для лечения
ран,язв.Нитрат серебра в комплексе с
органическими соединениями образует
альбуминаты и вследствие денатурации
белков бактериальных клеток оказывают
бактерицидное действие.Нитрат серебра
применяют при начальном, поверхностном,среднем
кариесе, гиперестезии твёрдых тканей
зуба и для стерилизации канала корня
зуба.
Колларгол(серебро
коллоидное) содержит 70% серебра.1-2 %
раствор используют как антисептическое
средство для полоскания полости рта
при воспалительных процессах
Протаргол
содержит 8% серебра, применяется как
вяжущее, антисептическое и
противовоспалительное средство.Используется
в виде 1-5 % раствора для смазывания
слизистой оболочки и для полоскания
полости рта при воспалительных процессах
Цинк
Цинк
находится в 4-м периоде, во II-группе, в
побочной подгруппе. Цинк относится к
металлам средней активности, в своих
соединениях проявляет единственную
степень окисления +2. Оксид и гидроксид
цинка являются амфотерными.
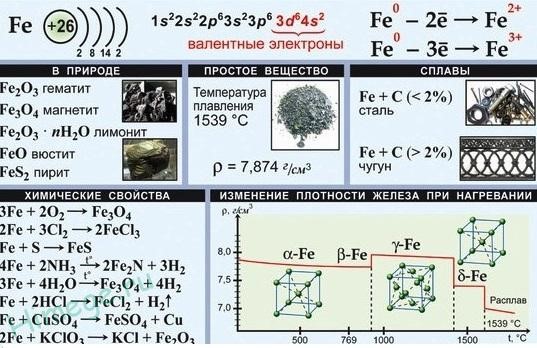
Железо
Железо
находится в 4-м периоде, в VIII группе, в
побочной подгруппе. Железо — металл
средней активности, в своих соединениях
проявляет наиболее характерные
степени окисления +2 и +3. Известны
также соединения железа, в которых оно
проявляет степень окисления +6, которые
являются сильными окислителями. FeO
проявляет основные, а Fe2O3 — амфотерные
с преобладанием основных свойств.
Медь
Медь
находится в 4-м периоде, в I группе, в
побочной подгруппе. Ее наиболее
устойчивые степени окисления +2 и +1. В
ряду напряжений металлов медь находится
после водорода, ее химическая активность
не очень велика. Оксиды меди: Cu2O CuO.
Последний и гидроксид меди Cu(OH)2 проявляют
амфотерные свойства с преобладанием
основных.
Подгру́ппа
ме́ди — химические элементы 11-й группы
периодической таблицы химических
элементов (по устаревшей классификации
— элементы побочной подгруппы I группы)
В
группу входят переходные металлы, из
которых традиционно изготавливают
монеты: медь Cu, серебро Ag и золото Au. На
основании строения электронной
конфигурации, к этой же группе относится
и рентгений Rg, но в «монетную группу»
он не попадает (это недолго живущий
трансактинид с периодом полураспада
26 сек). Название монетные металлы
официально не применяется к 11 группе
элементов, поскольку для изготовления
монет используются и другие металлы,
такие как алюминий, свинец, никель,
нержавеющая сталь и цинк.
Свойства:
Все
элементы подгруппы являются относительно
химически инертными металлами.
Характерны также высокие значения
плотности,
но относительно небольшие температуры
плавления
и кипения,
высокая тепло-
и электропроводность.
Свойства
металлов подгруппы меди[2]
Атомный
номер
Название,
символ
Электронная
конфигурация
Степени
окисления
p,
г/см³
tпл,
°C
tкип,
°C
29
Медь
Cu
[Ar]
3d104s1
0,
+1, +2
8,96[3][4]
1083[3][4]
2543[3][4]
Подгру́ппа
ци́нка
— химические элементы 12-й группы
периодической
таблицы химических элементов
(по устаревшей
классификации
— элементы побочной подгруппы II
группы)[1].
В группу входят цинк
Zn, кадмий
Cd и ртуть
Hg[2][3][4].
На основании электронной конфигурации
атома к этой же группе относится и
искусственно синтезированный элемент
коперниций
Cn, эксперименты с отдельными атомами
которого начали проводиться совсем
недавно[5][6].
Цинк
Электронная
конфигурация
[Ar]3d104s2
Металлический
радиус,
пм
134
Ионный
радиус,
пм (M2+)
74
Электроотрицательность
1.6
Температура
плавления,
°C
419.5
Температура
кипения,
°C
907
Все
элементы этой группы являются металлами.
Близость металлических радиусов кадмия
и ртути обусловлено косвенным влиянием
лантаноидного
сжатия.
Таким образом, тренд в этой группе
отличается от тренда в группе 2
(щёлочноземельные
металлы),
в которой металлический радиус плавно
увеличивается от верхней к нижней части
группы. Все три металла имеют сравнительно
низкие температуры плавления и кипения,
что говорит о том, что металлическая
связь
относительно слабая, с относительно
небольшим перекрытием между валентной
зоной
и зоной
проводимости.
Таким образом, цинк близок к границе
между металлами и металлоидами,
которая обычно помещается между галлием
и германием,
хотя галлий присутствует в полупроводниках,
таких как арсенид
галлия.
Цинк
является наиболее электроположительным
элементом в группе, следовательно, он
является хорошим восстановителем.
Окислительно-восстановительный статус
группы равен +2, причём ионы имеют
достаточно стабильную d10 электронную
конфигурацию, с заполненными подуровнями.
Однако, ртуть легко переходит к статусу
+1. Обычно, как, например, в ионах Hg22+, два
иона ртути (I) соединяются в виде
металл-металл и образуют диамагнитный
образец. Кадмий может также формировать
связи, такие как [Cd2Cl6]4−, в которых
окислительно-восстановительный статус
металла равен +1. Так же как и для ртути,
в результате формируется связь
металл-металл в виде диамагнитного
соединения, в котором нет непарных
электронов, делающих соединение сильно
химически активным. Цинк (I) известен
только в виде газа, в таких соединениях
как вытянутые в линию Zn2Cl2, аналогичные
каломели.
СОЕДИНЕНИЯ
МЕДИ
Оксид
меди (I) Cu2O3
и закись меди (I) Cu2O,
как и другие соединения меди (I) менее
устойчивы, чем соединения меди (II). Оксид
меди (I), или закись меди Cu2O в природе
встречается в виде минерала куприта.
Кроме того, она может быть получена в
виде осадка красного оксида меди (I) в
результате нагревания раствора соли
меди (II) и щелочи в присутствии сильного
восстановителя.
Оксид
меди (II),
или окись
меди, CuO
- черное вещество, встречающееся в
природе (например в виде минерала
тенерита). Его получают прокаливанием
гидроксокарбоната меди (II) (CuOH)2CO3 или
нитрата меди (II) Cu(NO2)2. Оксид меди (II)
хороший окислитель.
Гидроксид меди (II) Cu(OH)2
осаждается из растворов солей меди
(II) при действии щелочей в виде голубой
студенистой массы. Уже при слабом
нагревании даже под водой он разлагается,
превращаясь в черный оксид меди (II).
Гидроксид меди (II) - очень слабое
основание. Поэтому растворы солей меди
(II) в большинстве случаев имеют кислую
реакцию, а со слабыми кислотами медь
образует основные соли.
Сульфат
меди (II) CuSO4
в безводном состоянии представляет
собой белый порошок, который при
поглощении воды синеет. Поэтому он
применяется для обнаружения следов
влаги в органических жидкостях. Водный
раствор сульфата меди имеет характерный
сине-голубой цвет. Эта окраска свойственна
гидратированным ионам [Cu(H2O)4]2+, поэтому
такую же окраску имеют все разбавленные
растворы солей меди (II), если только они
не содердат каких-либо окрашенных
анионов. Из водных растворов сульфат
меди кристаллизуется с пятью молекулами
воды, образуя прозрачные синие кристаллы
медного купороса. Медный купорос
применяется для электролитического
покрытия металлов медью, для приготовления
минеральных красок, а также в качестве
исходного вещества при получении других
соединений меди. В сельском хозяйстве
разбавленный раствор медного купороса
применяется для опрыскивания растений
и протравливания зерна перед посевом,
чтобы уничтожить споры вредных грибков.
Хлорид
меди (II) CuCl2. 2H2O.
Образует темно-зеленые кристаллы, легко
растворимые в воде. Очень концентрированные
растворы хлорида меди (II) имеют зеленый
цвет, разбавленные - сине-голубой.
Нитрат
меди (II) Cu(NO3)2.3H2O.
Получается при растворении меди в
азотной кислоте. При нагревании синие
кристаллы нитрата меди сначала теряют
воду, а затем легко разлагаются с
выделением кислорода и бурого диоксида
азота, переходя в оксид меди (II).
Гидроксокарбонат
меди (II) (CuOH)2CO3.
Встречается в природе в виде минерала
малахита, имеющего красивый
изумрудно-зеленый цвет. Искусственно
приготовляется действием Na2CO3 на растворы
солей меди (II). 2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ +
2Na2SO4 + CO2↑ Применяется для получения
хлорида меди (II), для приготовления
синих и зеленых минеральных красок, а
также в пиротехнике.
Ацетат
меди (II) Cu (CH3COO)2.H2O.
Получается обработкой металлической
меди или оксида меди (II) уксусной
кислотой. Обычно представляет собой
смесь основных солей различного состава
и цвета (зеленого и сине-зеленого). Под
названием ярь-медянка применяется для
приготовления масляной краски.
Комплексные
соединения меди
образуются в результате соединения
двухзарядных ионов меди с молекулами
аммиака. Из солей меди получают
разноообразные минеральные краски.
Все соли меди ядовиты. Поэтому, чтобы
избежать образования медных солей,
медную посуду покрывают изнутри слоем
олова (лудят).
Окись
цинка ZnO представляет собой рыхлый
порошок белого цвета. Применяется в
качестве наполнителя каучука, пластмасс,
в косметике и медицине. Цинковые белила,
полученные из окиси цинка, не становятся
тёмными на воздухе, как это происходит
со свинцовыми белилами, и абсолютно
безвредны. В качестве люминофора, для
изготовления красок (литопон) используется
сульфид цинка ZnS. Хлоридом цинка ZnCl2
пропитывают дерево, используют при
травлении металлов., а также как
обезвоживающее вещество. В производстве
вискозы, в медицине, для производства
красок и как микроудобрение для травы
применяют цинковый купорос ZnSO4 • 7Н2О
(сульфат цинка).
В
периодической системе Д.И. Менделеева
химический элемент Цинк (Zinkum) Zn, известный
ещё с древности, находится во II группе
четвёртого периода. Порядковый номер
цинка в таблице равен 30, а его атомная
масса 65,37. Цинк представляет собой
металл синевато-белого цвета. Обладает
свойством покрываться на воздухе
плотной защитной плёнкой, предотвращающей
дальнейшее окисление цинка.
Сфалерит
ZnS, называемый цинковой обманкой,
является его главным минералом. Вступая
в соединение с другими химическими
элементами, цинк проявляет валентность
2+. Попадая в кислоты или щёлочи, цинк
растворяется, при этом выделяется
водород. Химическая реакция растворения
цинка в щелочах имеет следующий вид:
Zn
+ 2NaOH = Na2ZnO2 + H2
На
сегодняшний день известны соли, цинкаты
(Na [Zn (ОН)3], Na2[Zn(OH)4] и др.) Гидроокись цинка
является амфотерной. Вступая в химическую
реакцию со щелочами, она растворяется
и образует комплексные ионы [Zn(NH3)4]2+.
Являясь сильным восстановителем, цинк
вытесняет из растворов содержащиеся
в них металлы (медь, кадмий, железо и
др.).
Металлический
цинк применяют для предохранения от
коррозии изделий из стали, в гальванических
элементах, для получений латуни, а также
для оцинковывания железа.
Биологическая
роль :
Продукты,
богатые медью.
Метаболизм
меди у человека. Поступление в энтероцит
с помощью транспортёра CMT1, перенос с
помощью ATOX1 в сеть транс-Гольджи, при
росте концентрации — высвобождение с
помощью АТФ-азы ATP7A в воротную вену.
Поступление в гепатоцит, где ATP7B нагружает
ионами меди белок церулоплазмин, а
избыток выводит в желчь.
Медь
является необходимым элементом для
всех высших растений и животных. В токе
крови медь переносится главным образом
белком церулоплазмином. После усваивания
меди кишечником она транспортируется
к печени с помощью альбумина.
Медь
встречается в большом количестве
ферментов, например, в цитохром-с-оксидазе,
в содержащем медь и цинк ферменте
супероксид дисмутазе и в переносящем
молекулярный кислород белке гемоцианине.
В крови всех головоногих и большинства
брюхоногих моллюсков и членистоногих
медь входит в состав гемоцианина в виде
имидазольного комплекса иона меди,
роль, аналогичная роли порфиринового
комплекса железа в молекуле белка
гемоглобина в крови позвоночных
животных.
Предполагается,
что медь и цинк конкурируют друг с
другом в процессе усваивания в
пищеварительном тракте, поэтому избыток
одного из этих элементов в пище может
вызвать недостаток другого элемента.
Здоровому взрослому человеку необходимо
поступление меди в количестве 0,9 мг в
день.
При
недостатке меди в хондро- и остеобластах
снижается активность ферментных систем
и замедляется белковый обмен, в результате
замедляется и нарушается рост костных
тканей.
Биологическая
роль :
В
организме взрослого человека содержится
в среднем около 2 г цинка, в виде его
соединений, который концентрируется
преимущественно в простате,мышцах,
печени и поджелудочной железе.В 50
миллилитрах человеческой спермы
содержится около 10 миллиграмов
цинка.Более 400 ферментов содержат цинк.
Среди них ферменты, катализирующие
гидролиз пептидов, белков и сложных
эфиров, образование альдегидов,
полимеризацию ДНК и РНК. Ионы Zn2+ в
составе ферментов вызывают поляризацию
молекул воды и органических веществ,
содействуя их депротонированию по
реакции:
Zn2+
+ H2O = ZnOH+ + H+
Наиболее
изучен фермент карбоангидраза — белок,
содержащий цинк и состоящий примерно
из 260 аминокислотных остатков. Этот
фермент содержится в эритроцитах крови
и способствует превращению углекислого
газа, образующегося в тканях в процессе
их жизнедеятельности, в гидрокарбонат-ионы
и угольную кислоту, которая кровью
переносится в легкие, где выводится из
организма в виде углекислого газа. В
отсутствие фермента превращение СО2 в
анион HCO3- протекает с очень низкой
скоростью. В молекуле карбоангидразы
атом цинка связан с тремя имидазольными
группами остатков аминокислоты гистидина
и молекулой воды, которая легко
депротонируется, превращаясь в
координированный гидроксид. Атом
углерода молекулы углекислого газа,
на котором находится частичный
положительный заряд, вступает во
взаимодействие с атомом кислорода
гидроксильной группы. Таким образом,
координированная молекула СО2 превращается
в гидрокарбонат-анион, который покидает
активный центр фермента, замещаясь на
молекулу воды. Фермент ускоряет эту
реакцию гидролиза в 10 миллионов раз.
Цинк:
необходим
для продукции спермы и мужских
гормонов[14]
необходим
для метаболизма витамина E.
важен
для нормальной деятельности простаты.
участвует
в синтезе разных анаболических гормонов
в организме, включая инсулин, тестостерон
и гормон роста[14].
необходим
для расщепления алкоголя в организме,
так как входит в состав алкогольдегидрогеназы.
Токсичность
:
Кадмий
и многие его соединения ядовиты (в
больших концентрациях). Особенно опасным
случаем является вдыхание паров его
оксида (CdO). Вдыхание в течение 1 минуты
воздуха с содержанием 2,5 г/м3 оксида
кадмия, или 30 секунд при концентрации
5 г/м3 является смертельным. Кадмий
является канцерогеном.
Механизм
токсического действия кадмия заключается,
по-видимому, в связывании карбоксильных,
аминных и особенно сульфгидрильных
групп белковых молекул, в результате
чего угнетается активность ферментных
систем[16]. Растворимые соединения кадмия
после всасывания в кровь поражают
центральную нервную систему, печень и
почки, нарушают фосфорно-кальциевый
обмен. Хроническое отравление приводит
к анемии и разрушению костей.
Кадмий
в норме в небольших количествах
присутствует в организме здорового
человека. Кадмий легко накапливается
в быстроразмножающихся клетках
(например, в опухолевых или половых).
Он связывается с цитоплазматическим
и ядерным материалом клеток и повреждает
их. Он изменяет активность многих
гормонов и ферментов. Это обусловлено
его способностью связывать сульфгидрильные
(-SH) группы.
Ртуть
и многие её соединения ядовиты.Воздействие
ртути — даже в небольших количествах
— может вызывать серьёзные проблемы
со здоровьем и представляет угрозу для
внутриутробного развития плода и
развития ребёнка на ранних стадиях
жизни. Ртуть может оказывать токсическое
воздействие на нервную, пищеварительную
и иммунную системы, а также на легкие,
почки, кожу и глаза. ВОЗ рассматривает
ртуть в качестве одного из десяти
основных химических веществ или групп
химических веществ, представляющих
значительную проблему для общественного
здравоохранения[
Наиболее
ядовиты пары́ и растворимые соединения
ртути. Сама металлическая ртуть менее
опасна, однако она постепенно испаряется
даже при комнатной температуре[34]. Пары
могут вызвать тяжёлое отравление, для
чего достаточно, например, ртути из
одного разбитого медицинского термометра.
Ртуть и её соединения (сулема, каломель,
киноварь, цианид ртути) поражают нервную
систему, печень, почки, желудочно-кишечный
тракт, при вдыхании — дыхательные пути
(а проникновение ртути в организм чаще
происходит именно при вдыхании её
паров, не имеющих запаха). По классу
опасности ртуть относится к первому
классу (чрезвычайно опасное химическое
вещество). Опасный загрязнитель
окружающей среды, особенно опасны
выбросы в воду, поскольку в результате
деятельности населяющих дно микроорганизмов
происходит образование растворимой в
воде и токсичной метилртути, накапливающейся
в рыбе. Ртуть — типичный представитель
кумулятивных ядов.
Органические
соединения ртути (диметилртуть и др.)
в целом намного токсичнее, чем
неорганические, прежде всего из-за их
липофильности и способности более
эффективно взаимодействовать с
элементами ферментативных систем
организма.
