- •1) Предмет и задачи общей и неорганической химии. Роль химии в системе естественных наук.
- •4) Важнейшие классы и номенклатура неорганических веществ.
- •8) Периодичность свойств химических элементов.
- •9) Природа химической связи. Основные типы химической связи.
- •10) Ковалентная химическая связь. Способы образования ковалентной связи. Валентность.
- •11) Свойства ковалентной связи. Степень окисления атома.
- •13) Основы метода молекулярных орбиталей.
- •14) Ионная и металлическая связь. Водородная связь. Межмолекулярное взаимодействие.
- •17)Влияние температуры на скорость химической реакции. Основные положения теории активации Аррениуса.
- •18) Катализ. Влияние катализатора на скорость химической реакции.
- •19) Необратимые и обратимые реакции. Химическое равновесие. Принцип Ле-Шателье.
- •20) Дисперсные системы. Коллоидные растворы.
- •21)Растворение как физико - химический процесс.
- •22) Растворимость веществ. Состав растворов.
- •23)Основные положения теории электролитической диссоциации.
- •24)Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
- •25)Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
- •26) Константа диссоциации слабых электролитов. Закон разбавления Оствальда.
- •27) Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
- •28) Диссоциация воды. Константа диссоциации, ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •29) Произведение растворимости. Условия образования и растворения осадков. Реакции обмена в растворах электролитов.
- •30) Гидролиз солей. Количественные характеристики гидролиза.
- •32) Ионно-электронный метод (метод полуреакций). Классификация окислительно-восстановительных реакций.
- •33) Электрохимические процессы. Электродный потенциал. Стандартные электродные потенциалы. Водородный электрод.
- •34) Электрохимический ряд напряжений металлов. Уравнение Нернста. Гальванический элемент и его э.Д.С. Влияние условий на протекание окислительно-восстановительных процессов.
- •36) Устойчивость комплексных соединений. Понятие о двойных солях. Биологическая роль комплексных соединений.
- •37) Общая характеристика водорода. Гидриды. Ион водорода и ион гидроксония.
- •39) Галогеноводороды. Галогениды. Особенности плавиковой кислоты. Соляная кислота. Роль соляной кислоты и хлоридов в живых организмах.
- •40) Кислородсодержащие соединения галогенов. Кислородные кислоты хлора и их соли. Хлорная известь. Бертолетова соль. Перхлораты. Кислородосодержащие кислоты брома, иода и их соли.
- •41) Общая характеристика элементов via группы. Особенности кислорода. Аллотропия и изоморфизм серы. Свойства простых веществ. Применение и биологическое значение халькогенов.
- •42) Гидриды типа н2э. Ассоциация молекул воды. Токсичность сероводорода и других халькогеноводородов, их физиологическое действие.
- •44) Халькогениды. Растворимость и гидролиз сульфидов металлов. Полисульфиды.
- •45) Оксиды халькогенов. Диоксиды и триоксиды элементов. Сернистая, селенистая и теллуристая кислоты.
- •47) Общая характеристика элементов va группы. Свойства простых веществ. Аллотропия фосфора. Круговорот азота и фосфора в природе.
- •48) Гидриды типа эн3. Аммиак. Соли аммония. Аммиакаты. Гидроксиламин. Пептидная связь в белках.
- •49) Кислородсодержащие соединения азота. Оксиды азота. Физиологическое действие. Азотистая кислота и ее соли. Физиологическое действие.
- •51) Кислородсодержащие соединения фосфора. Оксиды фосфора (ііі) и (V). Кислородсодержащие кислоты фосфора и их соли. Фосфорная, фосфористая и фосфорноватистая кислоты. Роль в биологических процессах.
- •56) Кислородсодержащие соединения углерода. Оксиды углерода. Токсичность оксида углерода (іі). Роль оксида углерода(іv) в процессах жизнедеятельности. Парниковый эффект.
- •57) Угольная кислота и ее соли. Временная жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
- •59) Общая характеристика металлов. Общая характеристика валентных состояний металлов а и в групп. Значение и роль металлов в жизнедеятельности живых организмов.
- •60) Щелочные металлы. Общая характеристика оксидов, пероксидов, гидроксидов и солей. Калийные удобрения. Роль натрия и калия в жизнедеятельности живых организмов.
- •61) Бериллий. Магний. Щелочно-земельные металлы. Общая характеристика оксидов, гидроксидов, солей элементов группы iiа. Их роль в живой природе.
- •62) Алюминий. Подгруппа галлия. Общая характеристика оксидов, гидроксидов и солей элементов группы. Борная кислота и бораты. Амфотерность алюминия. Алюминаты. Гидролиз солей алюминия.
- •63) Металлы iva группы. Общая характеристика элементов. Токсичность свинца.
- •66) Общая характеристика элементов группы хрома. Свойства простых веществ. Соединения хрома (ііі) и их особенности. Соединения xpoмa (VI): хромовые кислоты и их соли. Роль в живой природе.
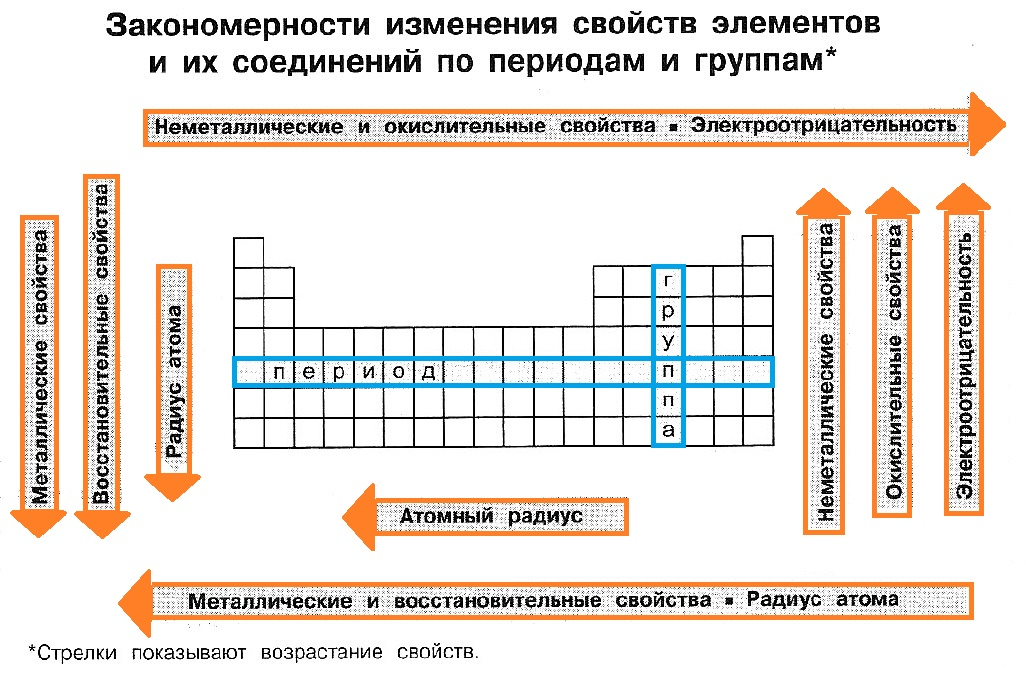
8) Периодичность свойств химических элементов.
Важнейшие
свойства элементов:
Радиусы
Энергия
ионизации
Сродство
к электрону
Электоотрицательность
На
размер радиуса оказывают влияние
структура в-ва, характер связи, СО.
Поэтому различают атомные (ковалентные
и металлические) и ионные радиусы.
Металлический
радиус – половина расстояния между
ядрами соседних атомов Ме.
Ковалентный
радиус – половина расстояния между
атомами соседних атомов неМе.
Ионный
радиус – характерный размер шарообразных
ионов, применяемый для вычисления
межатомных расстояний в ионных
соединениях. Понятие "ионный радиус"
основано на предположении, что размеры
ионов не зависят от состава молекул, в
которые они входят. На него влияет
количество электронных оболочек и
плотность упаковки атомов и ионов в
кристаллической решётке.
Радиусы
положительных ионов всегда меньше
радиусов отриц ионов и наоборот.
Изменение
атомных радиусов в группах меньше, чем
в периодах; в группах изменение
немонотонно.
Энергия
ионизации – это минимальная энергия
для удаления электрона. Максимальное
значение имеют инертные газы, минимальное
– щелочные Ме.
Сродство
к электрону – называют энергию,
выделяющуюся или поглощающуюся в
процессе присоединения электрона к
свободному атому в его основном состоянии
с превращением его в отрицательный ион
A-.
Электроотрицательность
– способность атомов удерживать внешние
электроны. Не является абсолютной
константой и зависит от эффективного
заряда ядра атома, который может меняться
под влиянием соседних атомов, типов
атомных орбиталей и характера их
гибридизации.
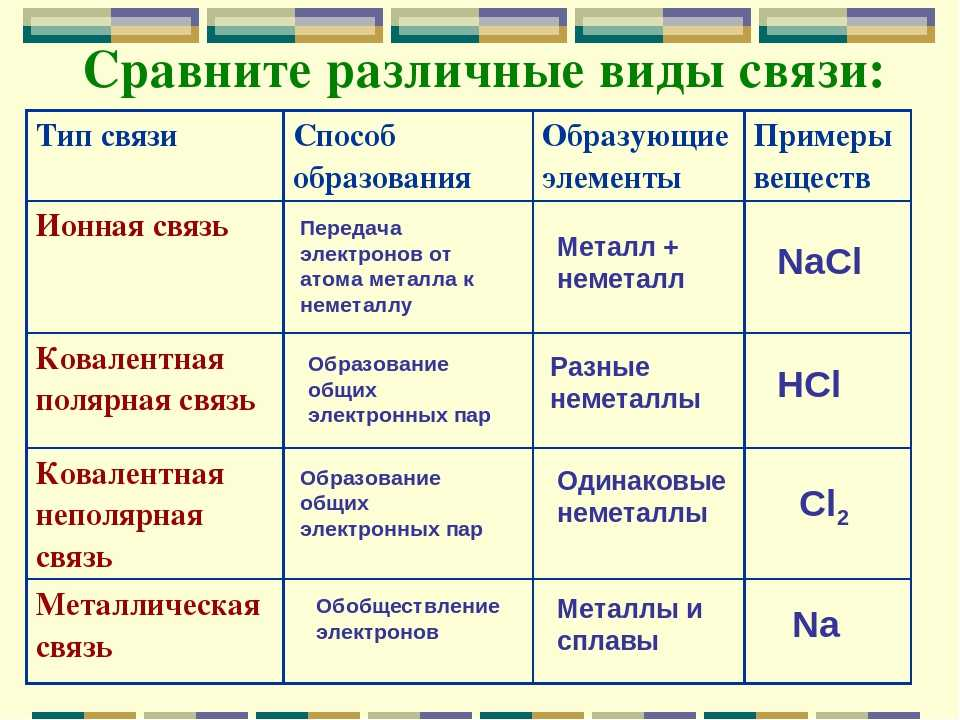
9) Природа химической связи. Основные типы химической связи.
Химическая связь - это взаимодействие, которое связывает отдельные атомы в молекулы, ионы, радикалы, кристаллы.
Основным условием образования химической связи является понижение полной энергии Е многоатомной системы по сравнению с энергией изолированных атомов, т. е. Еaв < Еa + Ев в случае образования вещества АВ из атомов А и В.
Природа химической связи, согласно современным представлениям, объясняется взаимодействием электрических полей, образуемых электронами и ядрами атомов, которые участвуют в образовании химического соединения. Поэтому более точно химическую связь можно определить как взаимодействие атомов, обусловленное перекрыванием их электронных облаков и сопровождающееся уменьшением полной энергии системы.
В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную, ионную и металлическую.
Основными параметрами химической связи являются ее длина, прочность и валентные углы, характеризующие строение веществ, которые образованы из отдельных атомов.
Длина связи - это межъядерное расстояние между химически связанными атомами.
Угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов, называется углом связи или валентным углом.
Важнейшей характеристикой химической связи, определяющей ее прочность, является энергия связи. Количественно она обычно оценивается с помощью энергии, затрачиваемой на разрыв такой связи.