
- •1) Предмет и задачи общей и неорганической химии. Роль химии в системе естественных наук.
- •4) Важнейшие классы и номенклатура неорганических веществ.
- •8) Периодичность свойств химических элементов.
- •9) Природа химической связи. Основные типы химической связи.
- •10) Ковалентная химическая связь. Способы образования ковалентной связи. Валентность.
- •11) Свойства ковалентной связи. Степень окисления атома.
- •13) Основы метода молекулярных орбиталей.
- •14) Ионная и металлическая связь. Водородная связь. Межмолекулярное взаимодействие.
- •17)Влияние температуры на скорость химической реакции. Основные положения теории активации Аррениуса.
- •18) Катализ. Влияние катализатора на скорость химической реакции.
- •19) Необратимые и обратимые реакции. Химическое равновесие. Принцип Ле-Шателье.
- •20) Дисперсные системы. Коллоидные растворы.
- •21)Растворение как физико - химический процесс.
- •22) Растворимость веществ. Состав растворов.
- •23)Основные положения теории электролитической диссоциации.
- •24)Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
- •25)Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
- •26) Константа диссоциации слабых электролитов. Закон разбавления Оствальда.
- •27) Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
- •28) Диссоциация воды. Константа диссоциации, ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •29) Произведение растворимости. Условия образования и растворения осадков. Реакции обмена в растворах электролитов.
- •30) Гидролиз солей. Количественные характеристики гидролиза.
- •32) Ионно-электронный метод (метод полуреакций). Классификация окислительно-восстановительных реакций.
- •33) Электрохимические процессы. Электродный потенциал. Стандартные электродные потенциалы. Водородный электрод.
- •34) Электрохимический ряд напряжений металлов. Уравнение Нернста. Гальванический элемент и его э.Д.С. Влияние условий на протекание окислительно-восстановительных процессов.
- •36) Устойчивость комплексных соединений. Понятие о двойных солях. Биологическая роль комплексных соединений.
- •37) Общая характеристика водорода. Гидриды. Ион водорода и ион гидроксония.
- •39) Галогеноводороды. Галогениды. Особенности плавиковой кислоты. Соляная кислота. Роль соляной кислоты и хлоридов в живых организмах.
- •40) Кислородсодержащие соединения галогенов. Кислородные кислоты хлора и их соли. Хлорная известь. Бертолетова соль. Перхлораты. Кислородосодержащие кислоты брома, иода и их соли.
- •41) Общая характеристика элементов via группы. Особенности кислорода. Аллотропия и изоморфизм серы. Свойства простых веществ. Применение и биологическое значение халькогенов.
- •42) Гидриды типа н2э. Ассоциация молекул воды. Токсичность сероводорода и других халькогеноводородов, их физиологическое действие.
- •44) Халькогениды. Растворимость и гидролиз сульфидов металлов. Полисульфиды.
- •45) Оксиды халькогенов. Диоксиды и триоксиды элементов. Сернистая, селенистая и теллуристая кислоты.
- •47) Общая характеристика элементов va группы. Свойства простых веществ. Аллотропия фосфора. Круговорот азота и фосфора в природе.
- •48) Гидриды типа эн3. Аммиак. Соли аммония. Аммиакаты. Гидроксиламин. Пептидная связь в белках.
- •49) Кислородсодержащие соединения азота. Оксиды азота. Физиологическое действие. Азотистая кислота и ее соли. Физиологическое действие.
- •51) Кислородсодержащие соединения фосфора. Оксиды фосфора (ііі) и (V). Кислородсодержащие кислоты фосфора и их соли. Фосфорная, фосфористая и фосфорноватистая кислоты. Роль в биологических процессах.
- •56) Кислородсодержащие соединения углерода. Оксиды углерода. Токсичность оксида углерода (іі). Роль оксида углерода(іv) в процессах жизнедеятельности. Парниковый эффект.
- •57) Угольная кислота и ее соли. Временная жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
- •59) Общая характеристика металлов. Общая характеристика валентных состояний металлов а и в групп. Значение и роль металлов в жизнедеятельности живых организмов.
- •60) Щелочные металлы. Общая характеристика оксидов, пероксидов, гидроксидов и солей. Калийные удобрения. Роль натрия и калия в жизнедеятельности живых организмов.
- •61) Бериллий. Магний. Щелочно-земельные металлы. Общая характеристика оксидов, гидроксидов, солей элементов группы iiа. Их роль в живой природе.
- •62) Алюминий. Подгруппа галлия. Общая характеристика оксидов, гидроксидов и солей элементов группы. Борная кислота и бораты. Амфотерность алюминия. Алюминаты. Гидролиз солей алюминия.
- •63) Металлы iva группы. Общая характеристика элементов. Токсичность свинца.
- •66) Общая характеристика элементов группы хрома. Свойства простых веществ. Соединения хрома (ііі) и их особенности. Соединения xpoмa (VI): хромовые кислоты и их соли. Роль в живой природе.
45) Оксиды халькогенов. Диоксиды и триоксиды элементов. Сернистая, селенистая и теллуристая кислоты.
В
соединениях с кислородом сера, селен
и теллур проявляют тенденцию к отдаче
электронов, т. е. существуют в положительных
степенях окисления. Каждый из элементов
образует два ряда наиболее важных
оксидов: ЭО2 и ЭО3.
За
исключением газообразного диоксида
серы, все остальные оксиды в стандартном
состоянии - твердые полимерные вещества
Молекула
SО2 - уголковая, кратность связи S—О
приближается к двум. Диоксид серы ниже
-10 °С образует молекулярную жидкость,
используемую как неводный апротонный
растворитель. В кристалле диоксида
селена существуют бесконечные цепи, а
диоксид теллура образует кристаллическую
решетку с большой степенью ионности.
Триоксиды
образуют в твердом состоянии полимерные
структуры. В частности, в кристаллах
SO3 существуют бесконечные цепи, состоящие
из тетраэдров S04, связанных вершинами:
Диоксиды
получают при сжигании простых веществ
в кислороде или на воздухе:
Другим
способом получения является дегидратация
соответствующих кислот:
В
лаборатории небольшие количества S02
получают, действуя серной кислотой на
сульфиты
или
восстанавливая концентрированную
серную кислоту медью:
Диоксид
серы (сернистый газ) — бесцветный газ
с резким запахом, вызывает раздражение»
слизистой оболочки и тяжелый кашель.
Он довольно хорошо растворим в воде -
один объем воды при стандартных условиях
растворяет 40 объемов S02. Твердый диоксид
селена растворяется в воде еще лучше,
но Те02 растворим плохо.
Диоксид
серы применяется для обеззараживания
помещений, для обесцвечивания органических
красителей, в частности при отбеливании
тканей, но основная его масса
перерабатывается в S03 и затем в серную
кислоту.
Выделение
S02 в атмосферу - одна из причин образования
смога и кислотных дождей.
Диоксиды
селена и теллура используются в основном
в процессах производства полупроводниковых
материалов.
Триоксиды
не получаются при горении халькогенов:
выделяющаяся при образовании диоксидов
энергия приводит к повышению температуры
в зоне горения до 1 500-2 000 К, и в результате
равновесие
Триоксиды
селена и теллура получают дегидратацией
соответствующих кислот. Триоксид серы
- серный ангидрид - получают в громадных
количествах каталитическим окислением
сернистого газа как промежуточный
продукт при производстве серной кислоты.
В качестве катализаторов используют
платину или оксиды ванадия:
Серный
ангидрид жадно реагирует с водой,
образуя серную кислоту:
Аналогично
ведет себя Se03, но Те03 с водой реагирует
плохо.
Все
оксиды — как Э02, так и Э03 — проявляют
кислотные свойства и, взаимодействуя
с растворами щелочей, образуют
соответствующие анионы, т. е. являются
ангидридами кислот:
Триоксиды,
в которых элементы находятся в высшей
степени окисления, являются довольно
сильными окислителями, особенно
Se03,однако из-за их активного взаимодействия
с водой в ее присутствии в
окислительно-восстановительных реакциях
участвуют соответствующие кислоты.
Диоксиды,
в которых степень окисления элементов
промежуточная (+4), могут проявлять как
окислительные, так и восстановительные
свойства. Например, сернистый газ при
обычных условиях может быть восстановлен
сероводородом или окислен диоксидом
азота:
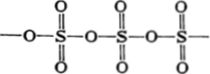
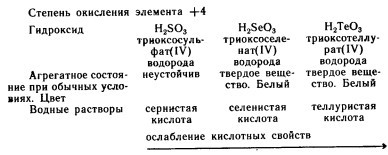
Кислоты.
H2SO3
— сернистая кислота (кислота средней
силы) H2SeO3 — селенистая кислота (кислота
средней силы) H2TeO3 — теллуристая кислота
(слабая кислота) Все эти кислоты, за
исключением H2TeO3, хорошо растворимы в
воде. Насчет устойчивости: сернистая
кислота неустойчива, остальные
устойчивые. H2TeO3 и H2SO3 существуют только
в разбавленных водных растворах.
Теллуристая кислота амфотерна и склона
к полимеризации из концентрированных
растворов. Кислотные свойства уменьшаются
при движении слева направо в ряду
H2SO3-H2SeO3-H2TeO3.
Окислительно-восстановительные
свойства:

![]()
 Основную
массу диоксида серы получают при
окислении сульфидных руд, чаще всего
пирита FeS2 :
Основную
массу диоксида серы получают при
окислении сульфидных руд, чаще всего
пирита FeS2 :
![]()

![]()

![]()

![]()
![]()
 практически
полностью смещается влево. При понижении
температуры окисление диоксидов
оказывается заторможенным из-за большой
энергии активации этой реакции.
практически
полностью смещается влево. При понижении
температуры окисление диоксидов
оказывается заторможенным из-за большой
энергии активации этой реакции.
![]()

![]()

![]()

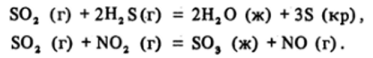

46) Серная, селеновая и теллуровая кислоты. Свойства разбавленной и концентрированной серной кислоты. Промышленные способы получения серной кислоты. Олеум. Сульфаты и гидросульфаты. Купоросы и квасцы. Полисерные, пероксосерные, политионовые кислоты.
Селеновая
кислота при стандартных
условиях
представляет собой бесцветное
кристаллическое вещество,
хорошо растворимое в воде[1].
Ядовита, гигроскопична,
является сильным окислителем.
Селеновая кислота — одно из немногих
соединений, растворяющих золото (наряду
с хлорной кислотой, царской
водкой,
раствором
Люголя,
цианидами
и др.).[2]
В твёрдом состоянии она кристаллизуется
в ромбическую
структуру.
Соответствующие
высшей степени окисления селена и
теллура селеновая и теллуровая кислоты
получаются при действии сильных
окислителей (хлорноватой кислоты,
хромовой кислоты) на селенистую или
теллуристую кислоты. Они выделены в
свободном состоянии и представляют
собой бесцветные кристаллические
вещества, хорошо растворимые в воде.
Известно два кристаллогидрата селеновой
кислоты: H2SeO4*H2O и H2SeO4*4Н2О. Чистую селеновую
кислоту можно получить, действуя серной
кислотой на селенат бария: BaSeO4 + H2SO4 =
BaSO4 + H2SeO4.
Концентрированная
селеновая кислота — сильный окислитель,
превосходящий в этом отношении
концентрированную серную кислоту (так
H2SeO4 растворяет не только серебро, но и
золото). При выпаривании растворов
теллуровой кислоты выделяется
кристаллогидрат Н2TeO4*2Н2О. Характерной
особенностью водородных атомов, входящих
в состав этого кристаллогидрата,
является способность частично или
полностью замещаться на металл. Известна,
например, соль Ag6TeO6, отвечающая
шестиосновной (так называемой
ортотеллуровой) кислоте H6TeO6. В отличие
от селеновой кислоты, теллуровая кислота
— весьма слабая. Теллуровая кислота
восстанавливается сернистым газом до
элементарного теллура. Между тем
селеновая кислота восстанавливается
этим восстановителем только до селенистой
кислоты. Это может быть использовано
для разделения теллура и селена.
Се́рная
кислота́
H2SO4
— сильная двухосновная кислота,
отвечающая высшей степени окисления
серы
(+6). При обычных условиях концентрированная
серная кислота — тяжёлая маслянистая
жидкость
без цвета
и запаха,
с сильнокислым «медным» вкусом. В
технике серной кислотой называют её
смеси как с водой, так и с серным
ангидридом SO3.
Если молярное
отношение
SO3 : H2O < 1, то это водный раствор серной
кислоты, если > 1 — раствор SO3
в серной кислоте (олеум).
Токсична, и относится к высокоопасным
веществам
H2SO4
— сильная двухосновная кислота, одна
из самых сильных минеральных кислот,
из-за высокой полярности связь Н – О
легко разрывается.
1)
В
водном растворе серная кислота
диссоциирует,
образуя ион водорода и кислотный
остаток: H2SO4 = H+ + HSO4—; HSO4— = H+ + SO42-.
Суммарное уравнение: H2SO4 = 2H+ + SO42-.
2)
Взаимодействие серной кислоты с
металлами:
Разбавленная серная кислота растворяет
только металлы, стоящие в ряду напряжений
левее водорода: Zn0 + H2+1SO4(разб) → Zn+2SO4 +
H2
3)
Взаимодействие серной кислоты с
основными оксидами:
CuO + H2SO4 → CuSO4 + H2O
4)
Взаимодействие серной кислоты с
гидроксидами:
H2SO4 + 2NaOH → Na2SO4 + 2H2O H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
5)
Обменные реакции с солями:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl Образование белого
осадка BaSO4 (нерастворимого в кислотах)
используется для обнаружения серной
кислоты и растворимых сульфатов
(качественная реакция на сульфат ион).
Разбавленная
серная кислота не проявляет окислительных
свойств, при ее взаимодействии с
металлами выделяется водород и соль,
содержащая металл в низшей степени
окисления. На холоде кислота инертна
по отношению к таким металлам, как
железо, алюминий и даже барий.
Особые
свойства концентрированной H2SO4 :
1)
Концентрированная
серная кислота является сильным
окислителем;
при взаимодействии с металлами (кроме
Au, Pt) восстанавливаться до S+4O2, S0 или
H2S-2 в зависимости от активности металла.
Без нагревания не реагирует с Fe, Al, Cr –
пассивация. При взаимодействии с
металлами, обладающими переменной
валентностью, последние окисляются до
более высоких степеней окисления,
чем в случае с разбавленным раствором
кислоты: Fe0
→
Fe3+,
Cr0 →
Cr3+,
Mn0 →
Mn4+,Sn0
→
Sn4+
2)
Концентрированная серная кислота
окисляет некоторые неметаллы как
правило до максимальной степени
окисления, сама восстанавливается до
S+4O2:
С
+ 2H2SO4(конц) → CO2 + 2SO2 + 2H2O
S+
2H2SO4(конц) → 3SO2 + 2H2O
2P+
5H2SO4(конц)→5SO2 + 2H3PO4 + 2H2O
3)
Окисление сложных веществ:
Серная кислота окисляет HI и НВг до
свободных галогенов: 2 КВr + 2Н2SO4 = К2SО4 +
SO2 + Вr2 + 2Н2О 2 КI + 2Н2SО4 = К2SO4 + SO2 + I2 + 2Н2О
Концентрированная серная кислота не
может окислить хлорид-ионы до свободного
хлора, что дает возможность получать
НСl по реакции обмена: NаСl + Н2SO4(конц.) =
NаНSO4 + НСl
Серная
кислота отнимает химически связанную
воду от органических соединений,
содержащих гидроксильные группы.
Дегидратация этилового спирта в
присутствии концентрированной серной
кислоты приводит к получению этилена:
С2Н5ОН = С2Н4 + Н2О.
Обугливание
сахара, целлюлозы, крахмала и др.
углеводов при контакте с серной кислотой
объясняется также их обезвоживанием:
C6H12O6 + 12H2SO4 = 18H2O + 12SO2↑ + 6CO2↑
В
промышленности серную кислоту получают
окислением диоксида
серы
(сернистый газ, образующийся в процессе
сжигания серы или серного колчедана)
до триоксида
(серного ангидрида) с последующим
взаимодействием SO3
с водой. Получаемую данным способом
серную кислоту также называют контактной
(концентрация 92-94 %):
2SO2+O2=2SO3
H2O+SO3=H2SO4
О́леум
(лат.
Oleum)
— раствор
серного
ангидрида
SO3
в 100%-й серной
кислоте H2SO4.
Олеум
представляет собой вязкую маслянистую
бесцветную жидкость или легкоплавкие
кристаллы, которые, однако, могут
приобретать самые различные оттенки
вследствие наличия примесей. На воздухе
«дымит», реагирует с водой с выделением
огромного количества тепла. Концентрация
серного ангидрида может варьироваться
в очень широких пределах: от единиц до
десятков процентов. Олеум обладает ещё
большим окислительным действием. Олеум
содержит также пиросерные кислоты,
получающиеся по реакциям:
H2SO4+SO3=H2S2O7
H2SO4+2SO3=H2S3O10
Применяется
в промышленности при производстве
серной кислоты,
капролактама
и многих других веществ. В органической
химии
применяется как сульфирующий,
водоотнимающий или окисляющий реагент.
Сульфаты
— кристаллические вещества,
бесцветные (если катион
бесцветен), в большинстве случаев хорошо
растворимые в воде.
Малорастворимые сульфаты встречаются
в виде минералов:
гипса
CaSO4×2H2O, целестина SrSO4, англезита PbSO4 и
др. (см. Сульфаты природные). Практически
нерастворимы барит
BaSO4 и RaSO4. Кислые сульфаты выделены в
твёрдом состоянии лишь для наиболее
активных металлов
— Na, К и др. Они хорошо растворимы в
воде,
легко плавятся. Нормальные сульфаты
можно получить растворением
металлов
в H2SO4, действием H2SO4 на окиси, гидроокиси,
карбонаты
металлов
и др. Гидросульфаты
получают нагреванием нормальных
сульфатов с концентрированной H2SO4:
K2SO4
+ H2SO4 = 2KHSO4.
Кристаллогидраты
сульфатов некоторых тяжёлых металлов
называются купоросами.
Широкое
применение во многих отраслях
промышленности находят сульфаты
природные.
Гидросульфаты,
бисульфаты,
кислые соли
серной
кислоты
H2SO4, например NaHSO4. Известны только
гидросульфаты щелочных
металлов.
Их получают умеренным нагреванием
сульфатов
с серной
кислотой:
K2SO4+H2SO4=2KHSO4. Гидросульфаты
калия
и натрия
при плавлении
теряют воду,
превращаясь в пиросульфаты, например:
2KHSO4=K2S2O7+H2O; последние при дальнейшем
нагревании разлагаются: K2S2O7=K2SO4+SO3. Этим
пользуются для перевода в растворимые
нерастворимых в кислотах
сильно прокалённых окисей
алюминия,
хрома
и железа,
которые при сплавлении с гидросульфатами
(или пиросульфатами) превращаются в
сульфаты,
например: Al2O3+3K2S2O7=Al2(SO4)3+3K2SO4.
Квасцы́[1]
— двойные
соли,
кристаллогидраты
сульфатов
трёх- и одновалентных
металлов
Квасцы
могут быть получены смешением горячих
эквимолярных водных растворов сульфатов
соответствующих металлов. При охлаждении
таких растворов из них кристаллизуются
квасцы.
Квасцы
хорошо растворимы в горячей воде.
Растворимость снижается с увеличением
атомного номера одновалентного катиона
(то есть от натрия до цезия). Обладают
вяжущим вкусом.
Купоро́с,
реже — витрио́л
(фр.
couperose)
— общее название кристаллогидратов
сульфатов
некоторых двухвалентных металлов.
В
промышленности, сельском хозяйстве,
медицине широко применяются следующие
купоросы:
• ванадиевый
купорос
(VSO4·7H2O);
• железный
купорос
(FeSO4·7H2O);
• кобальтовый
купорос
(CoSO4·7H2O);
• медный
купорос
(CuSO4·5H2O);
• никелевый
купорос
(NiSO4·7H2O);
• свинцовый
купорос
(PbSO4);
• хромовый
купорос
(CrSO4·7H2O);
• цинковый
купорос
(ZnSO4·7H2O);
• марганцевый
купорос
(MnSO4·5H2O);
Пиросерная
и пероксодисерная кислоты и их соли
При
дегидратации серной кислоты или при
насыщении ее серным ангидридом образуется
пиросерная кислота, ее соли — ииросульфаты
— образуются при обезвоживании
гидросульфатов:
В
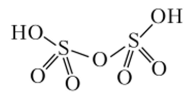
молекуле пиросерной кислоты два
тетраэдра SO2- связываются общим атомом
кислорода в вершине тетраэдра (рис.
16.3).
Известны
и полисерные кислоты H2Sw03w+1 (п
=
1,2, 3...). Они образуют олеум, который
формально рассматривается как раствор
S03 в серной кислоте.
При
замещении мостикового атома кислорода
в молекуле пиросерной кислоты на
пероксидную группу —О—О— образуется
пероксодисерная кислота H2S208. Она
представляет собой бесцветные кристаллы,
легко растворяющиеся в воде. Синтезируют
пероксодисерную кислоту электролизом
водного раствора H2S04, а ее соли персульфаты
— анодным окислением сульфатов:
Реакция
пероксодисерной кислоты с водой
используется при синтезе пероксида
водорода:
Персульфаты
используют в лабораторной практике
как окислители, при небольшом нагревании
они отщепляют кислород и переходят в
пиросульфаты:
Соединения
со связями между двумя и более атомами
серы
По
способности образовывать цепочки или
кольца из атомов серу можно сравнить
с углеродом.
Формула
наиболее устойчивых аллотропных
модификаций серы — S8, молекула имеет
циклическое строение. В молекулах
иолисульфидов, выделяемых в индивидуальном
состоянии, также может содержаться до
восьми атомов серы:
Атом
серы может присоединяться и к
четырехвалентной сере, при этом она
переходит в шестивалентное состояние,
образуется тиосульфат:
Тиосерная
кислота, соответствующая соли, неустойчива
и при попытке получения разлагается:
В
молекуле тиосерной кислоты центральный
атом находится в шестивалентном
состоянии со степенью окисления (+4), а
присоединенный — двухвалентен и имеет
нулевую степень окисления.
Из
производных тиоссрной кислоты большое
значение имеет лишь натриевая соль.
Тиосульфат натрия используется как
комплексообразователь и восстановитель.
В реакции со слабым окислителем в
нейтральной среде тиосульфат переходит
в тетратионат натрия:
Тетратионовая
кислота имеет следующую структуру:
С
более сильными окислителями тиосульфат
натрия окисляется до сульфата:
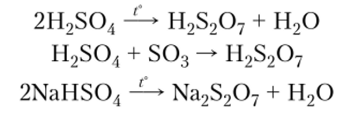


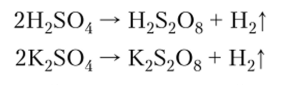

![]()


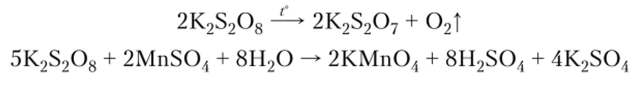

![]()

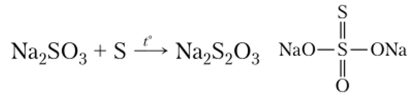

![]()

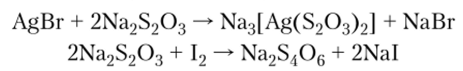

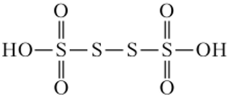

![]()
