
- •1) Предмет и задачи общей и неорганической химии. Роль химии в системе естественных наук.
- •4) Важнейшие классы и номенклатура неорганических веществ.
- •8) Периодичность свойств химических элементов.
- •9) Природа химической связи. Основные типы химической связи.
- •10) Ковалентная химическая связь. Способы образования ковалентной связи. Валентность.
- •11) Свойства ковалентной связи. Степень окисления атома.
- •13) Основы метода молекулярных орбиталей.
- •14) Ионная и металлическая связь. Водородная связь. Межмолекулярное взаимодействие.
- •17)Влияние температуры на скорость химической реакции. Основные положения теории активации Аррениуса.
- •18) Катализ. Влияние катализатора на скорость химической реакции.
- •19) Необратимые и обратимые реакции. Химическое равновесие. Принцип Ле-Шателье.
- •20) Дисперсные системы. Коллоидные растворы.
- •21)Растворение как физико - химический процесс.
- •22) Растворимость веществ. Состав растворов.
- •23)Основные положения теории электролитической диссоциации.
- •24)Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
- •25)Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
- •26) Константа диссоциации слабых электролитов. Закон разбавления Оствальда.
- •27) Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
- •28) Диссоциация воды. Константа диссоциации, ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •29) Произведение растворимости. Условия образования и растворения осадков. Реакции обмена в растворах электролитов.
- •30) Гидролиз солей. Количественные характеристики гидролиза.
- •32) Ионно-электронный метод (метод полуреакций). Классификация окислительно-восстановительных реакций.
- •33) Электрохимические процессы. Электродный потенциал. Стандартные электродные потенциалы. Водородный электрод.
- •34) Электрохимический ряд напряжений металлов. Уравнение Нернста. Гальванический элемент и его э.Д.С. Влияние условий на протекание окислительно-восстановительных процессов.
- •36) Устойчивость комплексных соединений. Понятие о двойных солях. Биологическая роль комплексных соединений.
- •37) Общая характеристика водорода. Гидриды. Ион водорода и ион гидроксония.
- •39) Галогеноводороды. Галогениды. Особенности плавиковой кислоты. Соляная кислота. Роль соляной кислоты и хлоридов в живых организмах.
- •40) Кислородсодержащие соединения галогенов. Кислородные кислоты хлора и их соли. Хлорная известь. Бертолетова соль. Перхлораты. Кислородосодержащие кислоты брома, иода и их соли.
- •41) Общая характеристика элементов via группы. Особенности кислорода. Аллотропия и изоморфизм серы. Свойства простых веществ. Применение и биологическое значение халькогенов.
- •42) Гидриды типа н2э. Ассоциация молекул воды. Токсичность сероводорода и других халькогеноводородов, их физиологическое действие.
- •44) Халькогениды. Растворимость и гидролиз сульфидов металлов. Полисульфиды.
- •45) Оксиды халькогенов. Диоксиды и триоксиды элементов. Сернистая, селенистая и теллуристая кислоты.
- •47) Общая характеристика элементов va группы. Свойства простых веществ. Аллотропия фосфора. Круговорот азота и фосфора в природе.
- •48) Гидриды типа эн3. Аммиак. Соли аммония. Аммиакаты. Гидроксиламин. Пептидная связь в белках.
- •49) Кислородсодержащие соединения азота. Оксиды азота. Физиологическое действие. Азотистая кислота и ее соли. Физиологическое действие.
- •51) Кислородсодержащие соединения фосфора. Оксиды фосфора (ііі) и (V). Кислородсодержащие кислоты фосфора и их соли. Фосфорная, фосфористая и фосфорноватистая кислоты. Роль в биологических процессах.
- •56) Кислородсодержащие соединения углерода. Оксиды углерода. Токсичность оксида углерода (іі). Роль оксида углерода(іv) в процессах жизнедеятельности. Парниковый эффект.
- •57) Угольная кислота и ее соли. Временная жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
- •59) Общая характеристика металлов. Общая характеристика валентных состояний металлов а и в групп. Значение и роль металлов в жизнедеятельности живых организмов.
- •60) Щелочные металлы. Общая характеристика оксидов, пероксидов, гидроксидов и солей. Калийные удобрения. Роль натрия и калия в жизнедеятельности живых организмов.
- •61) Бериллий. Магний. Щелочно-земельные металлы. Общая характеристика оксидов, гидроксидов, солей элементов группы iiа. Их роль в живой природе.
- •62) Алюминий. Подгруппа галлия. Общая характеристика оксидов, гидроксидов и солей элементов группы. Борная кислота и бораты. Амфотерность алюминия. Алюминаты. Гидролиз солей алюминия.
- •63) Металлы iva группы. Общая характеристика элементов. Токсичность свинца.
- •66) Общая характеристика элементов группы хрома. Свойства простых веществ. Соединения хрома (ііі) и их особенности. Соединения xpoмa (VI): хромовые кислоты и их соли. Роль в живой природе.
36) Устойчивость комплексных соединений. Понятие о двойных солях. Биологическая роль комплексных соединений.
Биологическая роль КС:
Гемоглобин(комплекс порфирина с железом (II) ) и хлорофилл
Комплексонометрия
Лекарственное сырье
инсулин - комплекс ионов цинка с белками
витамин В12 - комплекс кобальта с порфирином
Двойные
соли – это кристаллические комплексные
соединения, образованные из простых
солей и имеющие малоустойчивую внутреннюю
сферу. Часто формулу двойной соли
обозначают перечислением формул простых
солей, разделяя их точкой. Например,
соль К2[CuCl4] представляют формулой
CuCl2•2KCl. Такая формула не означает смеси
двух солей! Двойные соли образуют
отдельную область среди комплексных
соединений.
Получают
двойные соли кристаллизацией из раствора
(например, KCl•MgCl2, 2NaCl•CoCl2, CaCl2•BaCl2) или
твердофазным синтезом.
К
двойным солям относят также комплексные
соли, малорастворимые в воде, например,
известные вам криолит или малахит.
K3[Fe(CN)6]=3K+ +[Fe(CN)6]3-
Вторичная диссоциация-- диссоциация внутренней сферы комплекса
[Ag(NH3)2]+=[Ag(NH3)]+ +NH3 [Ag(NH3)]+=Ag+ +2NH3


37) Общая характеристика водорода. Гидриды. Ион водорода и ион гидроксония.
Н
(лат. hydrogenium), самый легкий газообразный
химический элемент - член IA подгруппы
периодической системы элементов, иногда
его относят к VIIA подгруппе.
Валентность
водорода в соединениях
В
соединениях водород проявляет валентность
I.
Физические
свойства водорода
Простое
вещество водород (Н2) – это газ, легче
воздуха, без цвета, без запаха, без
вкуса, tкип = – 2530С, водород в воде
нерастворим , горюч. Собирать водород
можно путем вытеснения воздуха из
пробирки или воды. При этом пробирку
нужно перевернуть вверх дном.
Получение
водорода
В
лаборатории водород получают в результате
реакции
Видео
- Эксперимент "Получение водорода и
проверка его на чистоту"
Zn
+ H2SO4 = ZnSO4 + H2 .
Вместо
цинка можно использовать железо,
алюминий и некоторые другие металлы,
а вместо серной кислоты – некоторые
другие разбавленные кислоты. Образующийся
водород собирают в пробирку методом
вытеснения воды или просто в перевернутую
колбу.
В
промышленности в больших количествах
водород получают из природного газа
(в основном это метан) при взаимодействии
его с парами воды при 800 °С в присутствии
никелевого катализатора:
CH4
+ 2H2O = 4H2 +CO2 (t, Ni)
или
обрабатывают при высокой температуре
парами воды уголь:
2H2O
+ С = 2H2 + CO2. (t)
Чистый
водород получают из воды, разлагая ее
электрическим током (подвергая
электролизу):
2H2O
= 2H2+ O2(электролиз).
Гидри́ды
— соединения водорода
с металлами
и с имеющи мименьшую электроотрицательность,
чем водород, неметаллами.
Иногда к гидридам причисляют соединения
всех элементов с водородом.
Классификация
В
зависимости от характера химической
связи водорода с другими химическими
элементами различают три типа гидридов:
ионные
гидриды (солеобразные гидриды);
металлические
гидриды;
ковалентные
гидриды.
К
ионным гидридам относятся соединения
водорода с щелочными и щёлочноземельными
металлами. Ионные гидриды — это вещества
белого цвета, устойчивые при нормальных
условиях,
но разлагающиеся при нагревании на
металл и водород без плавления, исключение
составляют LiH и CaH2, которые плавятся
без разложения и при дальнейшем
нагревании разлагаются.
Металлические
гидриды — это соединения переходных
металлов, в большинстве случаев являются
бертоллидами.
По сути являются твёрдым раствором
водорода в металле, атомы водорода
внедряются в кристаллическую решётку
металла.
К
ковалентным гидридам относятся гидриды,
образованные неметаллами, например,
метан
CH4 и силан
SiH4.
Химические
свойства:
Взаимодействие
ионных гидридов с водой:
NaH
+ H2O = NaOH + H2
CaH2
+ 2H2O = Ca(OH)2 + 2H2
Взаимодействие
с оксидами металлов:
2CaO
+ CaH2 = 2Ca + Ca(OH)2
Термическое
разложение: 2NaH
→ H2 + 2Na
2LiH
= 2Li + H2
Взаимодействие
с азотом: 3CaH2+N2= Ca3N2+3H2
Получение
Ионные
гидриды получают взаимодействием
простых веществ:
2Na
+ H2 = 2NaH
Молекулярный
ион водорода — простейший двухатомный
ион H2+, образуется при ионизации молекулы
водорода. В молекулярном ионе H2+
образуется одноэлектронная химическая
связь. Молекулярный ион водорода H2+
содержит два протона, заряженных
положительно, и один электрон, заряженный
отрицательно.
Гидроксоний
(оксоний, гидроний) H3O+— комплексный
ион, соединение протона с молекулой
воды.
Водородные
ионы в водных и спиртовых растворах
кислот существуют в виде гидратированных
или сольватированных ионов гидроксония.
Для измерения концентрации водородных
ионов используется водородный электрод.
Ион гидроксония был обнаружен также в
газовой фазе. Этот катион часто
используется для представления природы
протонов в водном растворе
Стандартная
энтропия иона гидроксония составляет
192,25 Дж/(моль·K).
![]()
VIIА-группу
образуют р-элементы: фтор F, хлор Cl, бром
Br, иод I и астат At. Название элементов
VIIА-группы – «галогены», т. е. «рождающие
соли» – связано с тем, что большинство
их соединений с металлами представляет
собой типичные соли (CaF2, NaCl, MgBr2, KI),
которые могут быть получены при
непосредственном взаимодействии
металла с галогеном.
Общая
формула валентных электронов – ns2 np5.
Все элементы легко образуют простые
однозарядные анионы Г – .
Простые
вещества
Простые
вещества - галогены - состоят из
двухатомных молекул, в которых атомы
связаны ковалентной неполярной связью.
Галогены
- вещества молекулярного строения;
плохо растворимы в воде (происходит
обратимая химическая реакция), но хорошо
растворимы в неполярных и малополярных
растворителях, таких как CCl4, гексан
С6Н14, сероуглерод CS2 и т.п.
Простые
вещества галогенов образованы
двухатомными молекулами Г2. В простых
веществах при переходе от F2 к I2 с
увеличением числа электронных слоев
и возрастанием поляризуемости атомов
происходит усиление межмолекулярного
взаимодействия, приводящее к изменению
агрегатного состояния при стандартных
условиях. Некоторые
характеристики молекулярных галогенов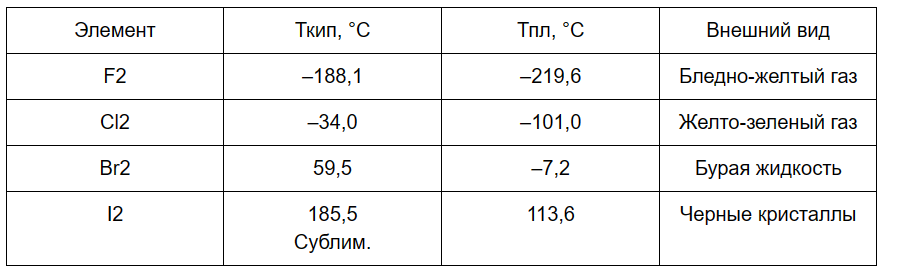
Все
простые вещества имеют резкий запах и
являются ядовитыми. Вдыхание их паров
вызывает раздражение слизистых оболочек
и дыхательных органов, а при больших
концентрациях – удушье.
Во
время первой мировой войны хлор применяли
в качестве отравляющего вещества.
Газообразный
фтор и жидкий бром вызывают ожоги кожи.
Работая с галогенами, следует соблюдать
меры предосторожности.
Йод
открыт в 1811 г. Куртуа. Свое название
элемент получил от слова «иоеидес»,
что по-гречески означает «окрашенный
в фиолетовый цвет».
Высокая
реакционная способность F2 создает
трудности с выбором конструкционных
материалов для работы с ним. Обычно для
этих целей используют никель и медь,
которые, окисляясь, образуют на своей
поверхности плотные защитные пленки
фторидов. Название F связано с его
агрессивным действием.
Молекулы
простых веществ — галогенов состоят
из двух атомов.
Фтор
F2 при нормальных условиях представляет
собой светло-зелёный газ с очень резким
запахом. Чрезвычайно ядовит.
Хлор
Cl2 — жёлто-зелёный газ с резким запахом.
Ядовит . Во время Первой мировой войны
армия Германии применила хлор как
боевое отравляющее вещество. В результате
многие тысячи солдат армий Антанты
получили отравление.
Хлор
растворяется в воде. При нормальных
условиях в одном объёме воды может
раствориться до двух объёмов хлора.
Раствор хлора в воде называется хлорной
водой.
Бром
Br2 — красно-бурая жидкость с резким
запахом. Пары брома ядовиты.
Йод
I2 — твёрдое вещество. При нормальных
условиях представляет собой кристаллы
тёмно-серого цвета с металлическим
блеском, которые при нагревании легко
переходят в газообразное состояние,
практически минуя жидкое (возгоняются).
Раствор йода (5%-ный) в спирте применяется
в медицине для обеззараживания ран
(йодная настойка).
Свойства
простого вещества астата практически
не изучены, так как его атомы короткоживущие.
Рассмотрим
химические свойства галогенов.
Галогены
– типичные неметаллы. Они реагируют с
металлами и водородом, выступая в роли
окислителей. При взаимодействии
галогенов с металлами образуются соли
– галогениды.
Например,
при взаимодействии меди с хлором
образуется хлорид меди(II):
Cu
+ Cl2 = CuCl2
Кристаллический
йод бурно реагирует с алюминием при
добавлении капли воды (вода в данной
реакции – катализатор):
2Al
+ 3I2 = 2AlI3
Рассмотрим
реакции галогенов с водородом. Фтор
реагирует с водородом со взрывом. В
результате образуется фтороводород:
F2
+ H2 = 2HF + Q
Водород
может гореть в атмосфере хлора. Эта
реакция интересна тем, что водород и
хлор в темноте не взаимодействуют, но
их смесь взрывается от вспышки света:
H2
+ Cl2 = 2HCl + Q
Бром
и иод с водородом реагируют не так
энергично, как фтор и хлор.
Окислительная
способность галогенов в ряду F2 – Cl2 –
Br2 – I2 убывает. Это закономерность могут
подтвердить и другие экспериментальные
факты. Более активный галоген может
вытеснить менее активный из его соли.
Например, фтор вытесняет хлор, бром,
йод из соответствующих галогенидов:
F2
+ 2NaCl = 2NaF + Cl2
F2
+ 2NaBr = 2NaF + Br2
F2
+ 2NaI= 2NaF + I2
Хлор
может вытеснять только бром и йод, а
бром вытесняет из солей только йод.
