
- •1) Предмет и задачи общей и неорганической химии. Роль химии в системе естественных наук.
- •4) Важнейшие классы и номенклатура неорганических веществ.
- •8) Периодичность свойств химических элементов.
- •9) Природа химической связи. Основные типы химической связи.
- •10) Ковалентная химическая связь. Способы образования ковалентной связи. Валентность.
- •11) Свойства ковалентной связи. Степень окисления атома.
- •13) Основы метода молекулярных орбиталей.
- •14) Ионная и металлическая связь. Водородная связь. Межмолекулярное взаимодействие.
- •17)Влияние температуры на скорость химической реакции. Основные положения теории активации Аррениуса.
- •18) Катализ. Влияние катализатора на скорость химической реакции.
- •19) Необратимые и обратимые реакции. Химическое равновесие. Принцип Ле-Шателье.
- •20) Дисперсные системы. Коллоидные растворы.
- •21)Растворение как физико - химический процесс.
- •22) Растворимость веществ. Состав растворов.
- •23)Основные положения теории электролитической диссоциации.
- •24)Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
- •25)Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
- •26) Константа диссоциации слабых электролитов. Закон разбавления Оствальда.
- •27) Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
- •28) Диссоциация воды. Константа диссоциации, ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •29) Произведение растворимости. Условия образования и растворения осадков. Реакции обмена в растворах электролитов.
- •30) Гидролиз солей. Количественные характеристики гидролиза.
- •32) Ионно-электронный метод (метод полуреакций). Классификация окислительно-восстановительных реакций.
- •33) Электрохимические процессы. Электродный потенциал. Стандартные электродные потенциалы. Водородный электрод.
- •34) Электрохимический ряд напряжений металлов. Уравнение Нернста. Гальванический элемент и его э.Д.С. Влияние условий на протекание окислительно-восстановительных процессов.
- •36) Устойчивость комплексных соединений. Понятие о двойных солях. Биологическая роль комплексных соединений.
- •37) Общая характеристика водорода. Гидриды. Ион водорода и ион гидроксония.
- •39) Галогеноводороды. Галогениды. Особенности плавиковой кислоты. Соляная кислота. Роль соляной кислоты и хлоридов в живых организмах.
- •40) Кислородсодержащие соединения галогенов. Кислородные кислоты хлора и их соли. Хлорная известь. Бертолетова соль. Перхлораты. Кислородосодержащие кислоты брома, иода и их соли.
- •41) Общая характеристика элементов via группы. Особенности кислорода. Аллотропия и изоморфизм серы. Свойства простых веществ. Применение и биологическое значение халькогенов.
- •42) Гидриды типа н2э. Ассоциация молекул воды. Токсичность сероводорода и других халькогеноводородов, их физиологическое действие.
- •44) Халькогениды. Растворимость и гидролиз сульфидов металлов. Полисульфиды.
- •45) Оксиды халькогенов. Диоксиды и триоксиды элементов. Сернистая, селенистая и теллуристая кислоты.
- •47) Общая характеристика элементов va группы. Свойства простых веществ. Аллотропия фосфора. Круговорот азота и фосфора в природе.
- •48) Гидриды типа эн3. Аммиак. Соли аммония. Аммиакаты. Гидроксиламин. Пептидная связь в белках.
- •49) Кислородсодержащие соединения азота. Оксиды азота. Физиологическое действие. Азотистая кислота и ее соли. Физиологическое действие.
- •51) Кислородсодержащие соединения фосфора. Оксиды фосфора (ііі) и (V). Кислородсодержащие кислоты фосфора и их соли. Фосфорная, фосфористая и фосфорноватистая кислоты. Роль в биологических процессах.
- •56) Кислородсодержащие соединения углерода. Оксиды углерода. Токсичность оксида углерода (іі). Роль оксида углерода(іv) в процессах жизнедеятельности. Парниковый эффект.
- •57) Угольная кислота и ее соли. Временная жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
- •59) Общая характеристика металлов. Общая характеристика валентных состояний металлов а и в групп. Значение и роль металлов в жизнедеятельности живых организмов.
- •60) Щелочные металлы. Общая характеристика оксидов, пероксидов, гидроксидов и солей. Калийные удобрения. Роль натрия и калия в жизнедеятельности живых организмов.
- •61) Бериллий. Магний. Щелочно-земельные металлы. Общая характеристика оксидов, гидроксидов, солей элементов группы iiа. Их роль в живой природе.
- •62) Алюминий. Подгруппа галлия. Общая характеристика оксидов, гидроксидов и солей элементов группы. Борная кислота и бораты. Амфотерность алюминия. Алюминаты. Гидролиз солей алюминия.
- •63) Металлы iva группы. Общая характеристика элементов. Токсичность свинца.
- •66) Общая характеристика элементов группы хрома. Свойства простых веществ. Соединения хрома (ііі) и их особенности. Соединения xpoмa (VI): хромовые кислоты и их соли. Роль в живой природе.
34) Электрохимический ряд напряжений металлов. Уравнение Нернста. Гальванический элемент и его э.Д.С. Влияние условий на протекание окислительно-восстановительных процессов.
Если
из всего ряда стандартных электродных
потенциалов выделить только те
электродные процессы, которые отвечают
общему уравнению М г+ + z e ~ = М то получим
ряд напряжений металлов. В этот ряд
всегда помешают, кроме металлов, также
водород, что позволяет видеть, какие
металлы способны вытеснять водород из
водных растворов кислот.
Уравнение
Нернста —
уравнение, связывающее
окислительно-восстановительный
потенциал системы с активностями
веществ, входящих в электрохимическое
уравнение, и стандартными электродными
потенциалами окислительновосстановительных
пар.
Если
в формулу Нернста подставить числовые
значения констант
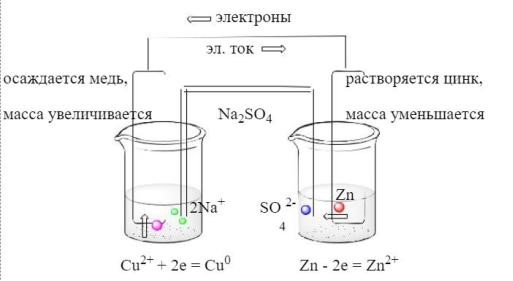
Гальванический
элемент – это устройство, в котором на
основе ОВР получают электрический ток.
Гальванический
элемент состоит из электродов, внешней
цепи и электролитического ключа.
Описание
работы гальванического элемента. При
замыкании цепи под влиянием разности
потенциалов в цепи начинает течь
электрический ток. Так, катион цинка
покидает кристаллическую фазу и
переходит в раствор (цинковая
пластинка
начинает растворяться), а электроны
движутся по проводнику по внешней цепи
к медной пластинке. При этом электроны
могут совершить работу. Обратите
внимание: электроны в нашей системе
двигаются от цинка к меди, т.е. справа
налево,
а
электрический ток течет наоборот, слева
направо, так как за направление
электрического тока принято направление
движения положительных зарядов.
В
тот момент, когда ион цинка переходит
из пластинки в раствор, в растворе
оказывается больше положительных
ионов, чем отрицательных (нарушается
уравнение электронейтральности),
вследствие чего часть анионов соли
электролитического ключ мигрирует из
геля в раствор соли цинка. Тогда в
растворе соли меди также возникает
избыток катионов, в результате чего
катион меди осаждается на медную
пластинку (масса медной пластинки
увеличивается), принимая два электрона
из внешней цепи.
Таким
образом, измерив изменение массы
металлической пластинки, можно сделать
вывод о том, какое количество вещества
израсходовалось (образовалось), а также
определить, какой из электродов был
катодом, а какой – анодом.

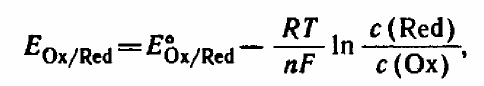
![]() — электродный
потенциал,
— электродный
потенциал,
![]() — стандартный электродный потенциал,
измеряется в вольтах;
— стандартный электродный потенциал,
измеряется в вольтах;
![]() — универсальная газовая постоянная,
равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная,
равная 8.31 Дж/(моль·K);
![]() — абсолютная температура;
— абсолютная температура;
![]() — постоянная Фарадея, равная 96485,35
Кл·моль−1;
— постоянная Фарадея, равная 96485,35
Кл·моль−1;
![]() — число моль электронов, участвующих
в процессе;
— число моль электронов, участвующих
в процессе;![]() и
и
![]() — активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
— активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.![]() и
и
![]() и перейти от натуральных логарифмов к
десятичным, то при
и перейти от натуральных логарифмов к
десятичным, то при
![]() получим
получим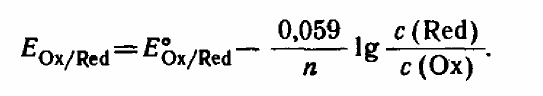
1893г Вернер--координационная теория
оновные положения:
Коордмнационные связи
М, центральный атом Комплексообразователи(М)– катионы переходных металлов (d-элементы).
Лиганды(L) – доноры электронной пары за счет не поделённой электронный пары.
Координационное число
Внешняя и внутренняя сферы
Заряд М


Классификация:
1.По
заряду внутренней сферы:
а)
Катионные [Cu(NH3)4]2+
б)
Анионные [Fe(CN)6]3-
в)
Нейтральные [Pt (NH3)2Cl]
2.По
природе лигандов:
а)
аквокомплексы [Сu(H2O)4]SO4
б)
амминокомплексы
[Cu(NH3)4]SO4
в)
ацидокомплексы
К2[Cu(Cl)4]
г)
гидроксокомплексы K2[Cu(OH)4]
д)
хелаты (гемоглобин, хлорофилл, витамин
В12 )
е)
смешаннолигандные комплексы






