
Добавил:
Daimler15
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:khimia
.docx010
Положительный заряд ядра атома равен числу протонов в ядре Главное квантовое число характеризует энергию электрона в атоме Число орбиталей в подуровне равно числу значений магнитного квантового числа Энергия электрона в атоме возрастает в порядке увеличения n+ℓ Форма орбитали определяется орбитальным квантовым числом Число электронов в ионе кобальта Сo2+ равно 25 Число неспаренных электронов в атоме железа в невозбужденном состоянии 4 Высшая положительная степень окисления элементов возрастает в следующем ряду – Li, Be, B Химический элемент образует высший оксид RO3. Электронная конфигурация внешнего энергетического уровня атома этого элемента в невозбужденном состоянии ns2np4
020
Ряд химических элементов, в котором радиус атома увеличивается – Cl, P, Si, Ge Электроотрицательность элементов увеличивается в ряду As, Se, S Основные свойства оксидов усиливаются в ряду Al2O3 → MgO → Na2O Легче всего присоединяет электроны атом серы Атомный номер элемента в Периодической системе равен положительному заряду ядра атома Атомы элементов, принадлежащих одной и той же подгруппе, имеют одинаковый (-ую, -ое) число валентных электронов Атомы элементов одного периода имеют одинаковый (-ую, -ое) число электронных слоев В периоде с увеличением порядкового номера элемента увеличивается(-ются) кислотные свойства оксидов Неметаллические свойства возрастают в ряду Sb, As, P
040
Веществом молекулярного строения является озон Ионы являются структурной единицей каждого из двух веществ – хлорид калия и сульфид натрия Из суждений А. Расплавы веществ с ионной кристаллической решеткой проводят электрический ток Б. Алмаз и графит имеют атомную кристаллическую решетку верны оба суждения Пространственное строение молекулы, центральный атом которой находится в sp2-гибридном состоянии – треугольник Из суждений А. Молекула CH4 имеет форму тетраэдра Б. Молекула CH4 неполярна верны оба суждения Молекулой-радикалом является NO Угол между связями в молекуле BeBr2 1800 Гибридизация атомных орбиталей в принципе невозможна у элемента H
110
При изобарическом нагревании аргон совершил работу A = 8 Дж. Количество теплоты в Джоулях, сообщенное газу, равно 20 НЕВЕРНОЕ утверждение: Тепловой эффект реакции зависит от числа промежуточных стадий реакции
120
выражение
второго начала термодинамики для
открытой
системы
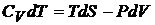
130
При протекании самопроизвольного процесса энтропия и изобарно-изотермический потенциал изменяются следующим образом – DS>0; DG<0
140
Выражение
для константы равновесия реакции 4HCl
+ O2
Û 2Cl2
+ 2H2O
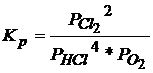 Число
степеней свободы (вариантность состояния)
системы, состоящей из К
компонентов и Ф
фаз, на которую из внешних условий влияют
только давление и температура
– К-Ф+2
Число
степеней свободы (вариантность состояния)
системы, состоящей из К
компонентов и Ф
фаз, на которую из внешних условий влияют
только давление и температура
– К-Ф+2
150
Метод исследования разбавленных растворов, основанный на измерении избыточного давления, прилагаемого к раствору и останавливающего самопроизвольный переход молекул растворителя через полупроницаемую мембрану в раствор, называется осмометрия
210
Единицы измерения молярной концентрации моль/л Масса хлорида кальция в 400 г 8 % -го раствора составляет 32г. Один литр раствора гидроксида натрия (См =2 моль/л) содержит 80г NaOH. Температуры кипения воды (t1) и 10%-го раствора глюкозы (t2) связаны соотношением +3) t1 < t2
220
Электролитом является Н3PO4 Электролитами являются все вещества в ряду Na2SO4, H2SO3, BaCl2 Сильным электролитом является HNO3 Сильными электролитами являются все вещества в ряду KOH, NaHTe, HNO3 Последовательность кислот в порядке увеличения их силы: HCN HClO HClO2
Диссоциации
Sr(OH)2
соответствует уравнение Sr(OH)2
= Sr2+
+ 2OH-
Выражение
константы диссоциации H2СO3
по первой ступени
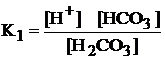 230
230
В ионных уравнениях в форме ионов записывают FeCl3 и H2SO4 Превращение CuSO4 → Cu(NO3)2 можно осуществить добавлением Ba(NO3)2 Сокращенное ионное уравнение реакции Ni(NO3)2 + 2 NaOH = Ni(OH)2 + 2 NaNO3 Ni2+ + 2 OH– = Ni(OH)2 Взаимодействуют водные растворы K2CO3 и HNO3 Сокращенное ионное уравнение H+ + OH– = H2O соответствует взаимодействию H2SO4 и NaOH Сумма коэффициентов в сокращенном ионном уравнении реакции между карбонатом калия и нитратом бария равна 3
240
Последовательность
сульфидов в порядке уменьшения их
растворимости:
 ZnS
CdS
CuS
ПР
(AgCl)
= 1∙10–10
Концентрация
ионов Ag+
(моль/л) в насыщенном растворе AgCl
1∙10–5
ZnS
CdS
CuS
ПР
(AgCl)
= 1∙10–10
Концентрация
ионов Ag+
(моль/л) в насыщенном растворе AgCl
1∙10–5
250
Кислая среда в растворе соли Al2(SO4)3 Полностью и необратимо гидролизуется соль Al2S3 Совместный гидролиз протекает при сливании растворов NH4NO3 и K2SiO3 Порядок растворов равной молярной концентрации по увеличению значения pH: HCl Na2SO4 Na2CO3 NaOH Значением рН < 7 характеризуются водные растворы солей: Pb(NO3)2 NH4Cl Степень гидролиза MgCl2 увеличивается при: разбавлении раствора, нагревании раствора Раствор, с концентрацией ионов Н+ 0,01 моль/л характеризуется pH = 2
310
Соединение,
в котором азот проявляет степень
окисления +3 HNO2
Одинаковую
степень окисления проявляют подчеркнутые
элементы ряда SO32–,
TiO2+,
MnO2
В
окислительно-восстановительной
реакции
MnSO4
+ Cl2
+ KOH
 MnO42–
+ Cl–
окислитель
Сl2
восстановитель Mn2+
Коэффициент
перед HNO3
в уравнении окислительно-восстановительной
реакции
HCl
+ HNO3
Cl2
+ NO
+ … равен 2
Коэффициент
перед окислителем в уравнении
окислительно-восстановительной
реакции
KMnO4
+ KI
+ H2SO4
Mn2+
+ I2
равен
2
Превращению
Cr2O72-
Cr3+
соответствует уравнение Cr2O72–
+ 14 Н+
+ 6ē
2
Cr3+
+ 7 Н2О
MnO42–
+ Cl–
окислитель
Сl2
восстановитель Mn2+
Коэффициент
перед HNO3
в уравнении окислительно-восстановительной
реакции
HCl
+ HNO3
Cl2
+ NO
+ … равен 2
Коэффициент
перед окислителем в уравнении
окислительно-восстановительной
реакции
KMnO4
+ KI
+ H2SO4
Mn2+
+ I2
равен
2
Превращению
Cr2O72-
Cr3+
соответствует уравнение Cr2O72–
+ 14 Н+
+ 6ē
2
Cr3+
+ 7 Н2О
320
Продукты
взаимодействия Cu
+ HNO3(разб.)
 Cu(NO3)2
+ NO
+ H2O
Продукты
взаимодействия Mg
+ H2O
(на основании данных окислительно-восстановительных
потенциалов) Mg(OH)2
+ H2
Окислителем
при коррозии гальванопары Cd
/ Sn
в среде HCl
является H+
Продукты
коррозии гальванопары Al
/ Cu
+ HCl
: H2
Al3+
С
соляной кислотой взаимодействуют: Al
Cd
С
водой взаимодействуют: Na
Ca
Протекторами
по отношению к кадмию в нейтральной
среде (согласно значениям
окислительно-восстановительных
потенциалов) являются: Mg
Zn
Cu(NO3)2
+ NO
+ H2O
Продукты
взаимодействия Mg
+ H2O
(на основании данных окислительно-восстановительных
потенциалов) Mg(OH)2
+ H2
Окислителем
при коррозии гальванопары Cd
/ Sn
в среде HCl
является H+
Продукты
коррозии гальванопары Al
/ Cu
+ HCl
: H2
Al3+
С
соляной кислотой взаимодействуют: Al
Cd
С
водой взаимодействуют: Na
Ca
Протекторами
по отношению к кадмию в нейтральной
среде (согласно значениям
окислительно-восстановительных
потенциалов) являются: Mg
Zn
330
Уравнение катодной полуреакции при электролизе водного раствора CuSO4 с инертными электродами Cu2+ + 2 ē = Cu Только водород выделится на катоде при электролизе водных растворов: NaCl KOH Электролизом водного раствора соли можно получить: Pb Sn Продукт окисления иона SO32– при электролизе водного раствора соли SO42– Электролизом водного раствора соли можно получить Sn
Соседние файлы в предмете Химия
