

Травматический шок определяется как наиболее часто встречающаяся клиническая форма тяжёлого состо яния раненого, развивающаяся вследствие тяжёлой механической травмы или ранения и проявляющаяся си ндромом низкого минутного объёма кровообращения и системных расстройств микроциркуляции.
.
1 Тяжесть состояния раненого - интегративный показатель, рассчитываемый путем суммирования наиболее информативных симптомов с помощью шкал "ВПХ-СП" или "ВПХ-СГ" (см. Приложение 1). Клиническими формами тяжёлого состояния раненых являются травматический шок и терминальное состояние (63%), травматическая кома (18%), острая дыхательная недостаточность (13%), острая сердечная недостаточность (6%).
Частота травматического шока у раненых в современных условиях ведения боевых действий возрастает, достигая 25%. Это обусловлено увеличением поражающей силы оружия, неблагоприятными климатическими условиями (жаркий климат, горно-пустынная местность и др.) и связанными с ними трудностями адаптации, широкомасштабным использованием авиамедицинской эвакуации - в лечебные учреждения доставляются раненые с крайне тяжёлой боевой травмой, многие из которых не смогли бы перенести длительную эвакуацию наземными видами транспорта.
ЭВОЛЮЦИЯ ВЗГЛЯДОВ НА ШОК И СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О ЕГО ПАТОГЕНЕЗЕ
Первые наблюдения необычной заторможенности при тяжёлых ранениях принадлежат Амбруазу Паре (ХVI в.). Медицинский термин "шок" (shock) появился при переводе на английский язык хирургом Джеймсом Латта изданной в 1737 г. книги французского военного хирурга Анри Ледрана, в которой аналогичным словом ("secouse", фр. - удар, потрясение) описывалось тяжёлое состояние раненых при огнестрельных ранениях.
В истории учения о травматическом шоке можно выделить три периода - описательный, теоретической разработки концепции и современный - научно-практический, когда изучение патофизиологических процессов в ответ на тяжёлые травмы было перенесено из экспериментальных лабораторий в специализированные "противошоковые" центры.
Среди многих хирургов разных стран, описывавших травматический шок, возвышается фигура Н.И. Пирогова, который ярко и глубоко представил картину травматического шока у раненых. "С оторванною ногою или рукою лежит такой окоченелый на перевязочном пункте неподвижно; он не кричит, не вопит и не жалуется; не принимает ни в чём участия и ничего не требует; тело его холодно, лицо бледно, как у трупа; взгляд неподвижен и обращён вдаль, пульс, как нитка, едва заметен под пальцем и с частыми перемежками. На вопросы окоченелый или вовсе не отвечает, или только про себя чуть слышным шёпотом, дыхание тоже едва приметно. Рана и кожа почти вовсе нечувствительны; но если большой нерв, висящий из раны, буде чем-нибудь раздражён, то раненый одним лёгким сокращением личных мускулов обнаруживает признак чувства. Иногда это состояние проходит через несколько часов от употребления возбуждающих средств, иногда же оно продолжается до самой смерти"1.
1 Пирогов Н.И. Начала общей военно-полевой хирургии, взятые из наблюдений военно-госпитальной практики и воспоминаний о Крымской войне и Кавказской экспедиции. Дрезден, 1864 // Собрание сочинений. - Т. 5. - М., 1961. - С. 71.
Особую роль в формировании учения о шоке сыграли теории травматического шока: нейрогенная, кровоплазмопотери и токсическая.
Нейрогенную теорию травматического шока выдвинул в 1890-х гг. американский хирург Г. Крайль. В ХХ в. её всесторонне разрабатывал отечественный патофизиолог И.Р. Петров. Сторонники нейрогенной (нервно-рефлекторной) теории связывали "первичную поломку", происходящую в организме после тяжёлых ранений и травм, с мощной нервно-болевой импульсацией из зон тяжёлых механических повреждений в

центральную нервную систему (ЦНС) и в органы-мишени (надпочечники и другие эндокринные органы). Действительно, современными методами подтверждается возникновение при тяжёлой травме патологических изменений в ЦНС, происходящих на субклеточном уровне. Не исключено, что они закладывают основу для развития более поздних осложнений. Однако основные положения нейрогенной теории травматического шока не подтвердились: она утверждает чрезмерную роль нервно-болевых влияний, но для доказательства ведущей роли нервно-болевых факторов использовались неадекватные экспериментальные модели (многочасовые раздражения электротоком крупных нервных стволов или многочисленные удары тяжёлыми металлическими предметами по конечности). Кроме того, исследования всех отделов нервной системы не обнаружили признаков её угнетения при травматическом шоке. Торможение больших полушарий действительно наступает на заключительной стадии терминального состояния - агонии и клинической смерти, но как прямое следствие критического снижения кровообращения в головном мозге. Вместе с тем указание на ограниченную роль болевых импульсов в механизмах развития травматического шока не должно давать повода к недооценке обезболивания.
В самом начале ХХ в. английский исследователь А. Малколм отвёл ведущую роль в механизме развития травматического шока острой кровоплазмопотере. Последующая разработка и широкое применение объективных методов определения объёма кровопотери [прямые измерения объёма циркулирующей крови (ОЦК) и др.] подтвердили абсолютно приоритетную роль острой кровопотери в патогенезе травматического шока. Тяжёлым механическим повреждениям, сопровождающимся снижением артериального давления, как правило, сопутствует острая кровопотеря, пропорциональная уровню гипотензии. Именно массивная кровопотеря формирует симптомокомплекс травматического шока. Теория кровоплазмопотери оказалась наиболее плодотворной для совершенствования лечебной тактики, поскольку нацеливает врачей на поиск источника острого кровотечения, вызывающего гемодинамическую катастрофу (травматический шок).
Признание ведущей роли острой кровопотери в патогенезе травматического шока всё же не даёт основания для отождествления шока травматического и геморрагического. При тяжёлых механических повреждениях к патологическому влиянию острой кровопотери неизбежно присоединяется негативное действие боли - ноцицептивная импульсация, последствия висцеральных повреждений, а при ранах, сопровождающихся образованием обширных очагов первичного некроза (огнестрельные ранения), раздавливанием или размозжением тканей, - выраженный эндотоксикоз. В системный кровоток поступают в большом количестве продукты разрушенных тканей, нарушенного метаболизма, рассасывающихся обширных гематом и даже бактерии. Все эти субстанции отрицательно воздействуют на вегетативные центры в головном мозге, сердце, лёгкие, обеспечивающие адекватное кровообращение и дыхание. При нарушении целости полых органов живота в кровоток поступают токсические продукты, всасывающиеся через обширную поверхность брюшины. Перечисленные токсические вещества оказывают угнетающее действие на гемодинамику, газообмен и способствуют формированию необратимых изменений в клетках. Впервые на большую роль токсического фактора при тяжёлых механических повреждениях обратили внимание в годы Первой мировой войны французские врачи Э. Кеню и П. Дельбе -
авторы токсической теории травматического шока.
Такимобразом, клиническую и патогенетическую основу травматического шока составляет синдром остр ого нарушения кровообращения (гипоциркуляции), возникающий вследствие сочетанного воздействия на ор ганизм раненого жизнеугрожающих последствий травмы - острой кровопотери, повреждения жизненно в ажных органов, эндотоксикоза, а также нервно-болевых влияний. К этому выводу пришли отечественные учёные из "Группы № 1", изучавшие травматический шок на полях сражений Великой Отечественной войны (Н.Н. Еланский. М.Н. Ахутин, 1945).
Взгляды на травматический шок как синдром гипоциркуляции подтвердились в третьем историческом периоде развития учения о шоке, хронологически совпавшем с формированием в 1960-х гг. новой медицинской специальности - реаниматологии. В эти годы стали организовываться специализированные отделения и центры, где концентрировались тяжело пострадавшие с явлениями травматического шока, а в их лечении принимали участие не только хирурги и реаниматологи, но и клинические физиологи. В нашей

стране первый такой центр - научно-исследовательскую лабораторию по изучению шока и терминальных состояний при кафедре и клинике военно-полевой хирургии Военно-медицинской академии им. С.М. Кирова - создал известный хирург А.Н. Беркутов в 1961 г. С этого периода клинические проявления и патогенетические механизмы развития травматического шока стали изучаться непосредственно у раненого человека в зависимости от методов его лечения. В 1970-е гг. прекращается дискуссия по поводу основополагающей теории развития травматического шока. Травматический шок определяется как синдром гипоциркуляции и гипоперфузии тканей, развивающийся вследствие тяжёлой механической травмы. Исследуемый в непосредственной связи с лечением, травматический шок стал рассматриваться не как научная теория, а как лечебно-тактическая концепция, т.е. методология патогенетически обоснованного лечения.
На сегодняшний день патогенез травматического шока упрощённо представляется следующим образом.
В результате тяжёлого ранения или травмы у раненого формируется один либо несколько (при множественных или сочетанных травмах) очагов повреждения тканей либо органов. При этом повреждаются сосуды различного калибра - возникает кровотечение; происходит раздражение обширного рецепторного поля - возникает массивное афферентное воздействие на центральную нервную систему; повреждается более или менее обширный объём тканей, продукты их распада всасываются в кровь - возникает эндотоксикоз. При повреждении жизненно важных органов происходит нарушение соответствующих жизненно важных функций: повреждение сердца
сопровождается снижением сократительной функции миокарда; повреждение лёгкого - снижением объёма лёгочной вентиляции; повреждение глотки, гортани, трахеи - асфиксией. Таким образом, механизм развития травматического шока моноэтиологический (травма), но полипатогенетичес
кий (перечисленные патогенетические факторы) в отличие от геморрагического шока (например, при колото-резаных ранениях с повреждением крупных сосудов), где патогенетический фактор один - острая кровопотеря.
Массивное афферентное воздействие на центральную нервную систему (ноцицептивная афферентная импульсация) из очага (очагов) повреждения и информационное воздействие через барорецепторы стенок артериальных сосудов на центры вегетативной нервной системы (гипоталамус) об объёме кровопотери являются пусковым механизмом для запуска неспецифической адаптационной программы защиты организма. Основной задачей её является
выживание организма в экстремальной ситуации. Непосредственным "организатором" и "исполнителем" этой программы является гипоталамо-гипофизарно-надпочечниковая система, реализующая эволюционно сформированные механизмы нейроэндокринной регуляции, направленные на спасение жизни раненого.
Получив информацию из центра и периферии, гипоталамус запускает адаптационную программу путём выделения стрессорных рилизинг-факторов, воздействующих на соответствующие зоны гипофиза. Гипофиз в свою очередь резко усиливает инкрецию стрессорных гормонов, и прежде всего адренокортикотропного гормона. Таким образом, в ответ на травму запускается стрессорный каскад нейрогуморальных взаимодействий, итогом которых является резкая активация адреналовой и кортикальной систем надпочечников. Они выделяют в кровь большое количество адреналина, норадреналина и глюкокортикоидов.
Вслед за этим реализуются эффекторные механизмы адаптационной программы. В результате усиления нервной симпатической эфферентации и резкого выброса в кровоток большого количества катехоламинов (адреналина и норадреналина) развивается генерализованный спазм мелких сосудов на периферии (конечности, таз, брюшная полость). Первой по времени реакцией, компенсирующей кровопотерю, является спазм ёмкостных сосудов вен. Веноконстрикция, снижающая ёмкость венозного резервуара, мобилизует для циркуляции до 1 л крови. Венозная ёмкостная система содержит 75-80% всей крови, богата адренорецепторами и поэтому является эффектором первой очереди аварийной компенсации кровопотери. Второй по времени компенсаторной реакцией на травму и кровопотерю
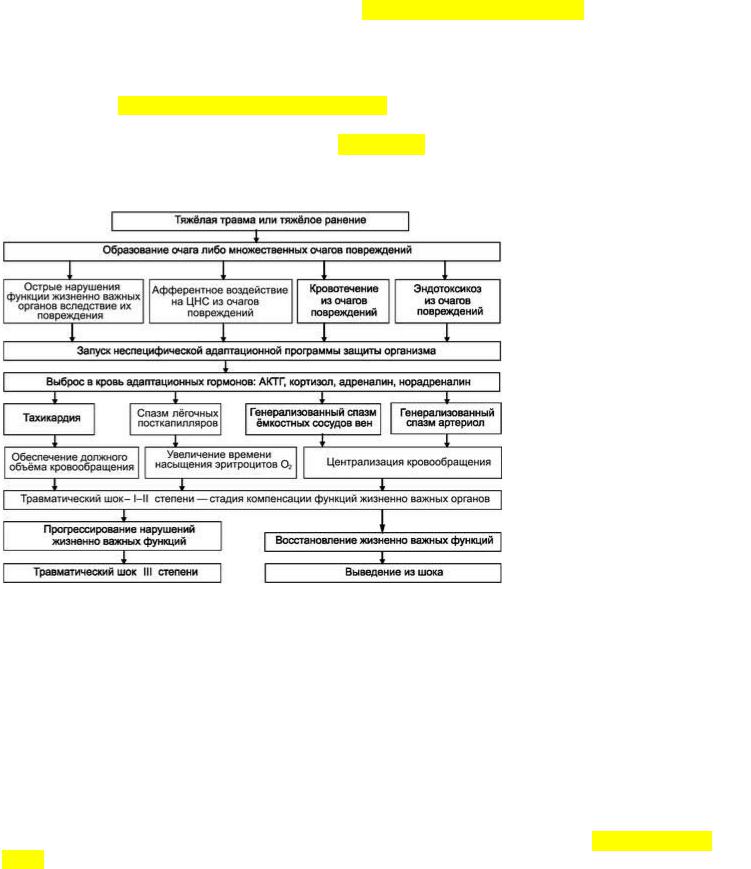
является спазм артериол и прекапиллярных сфинктеров. Развивающееся в результате этого повышение общего периферического сопротивления направлено на поддержание минимально достаточного артериального давления. Биологический смысл этих процессов состоит, прежде всего, в мобилизации крови из кровяных депо, мобилизации жидкости в сосудистое русло, перераспределении крови для поддержания перфузии головного мозга и сердца за счёт умирания периферии, в остановке либо снижении интенсивности кровотечения. Эти процессы получили определение централизация кровообращения. Они являются наиболее важным и ранним механизмом защиты, направлены на возмещение ОЦК и стабилизацию АД. Благодаря централизации кровообращения организм может самостоятельно компенсировать кровопотерю до 20% ОЦК.
При прогрессировании кровотечения и действии других факторов травматического шока снижается ОЦК и АД, развивается циркуляторная и тканевая гипоксия. Включается второй уровень защиты. Для компенсации дефицита ОЦК, циркуляторной гипоксии, обеспечения должного объёма кровообращения учащаются сердечные сокращения - развивается тахикардия, выраженность которой прямо пропорциональна тяжести шока. Компенсация гипоксии осуществляется и за счёт замедления кровотока в лёгких в результате спазма посткапиллярных сфинктеров; замедление прохождения крови через лёгочные капилляры увеличивает время насыщения эритроцитов кислородом (рис. 6-1).
Рис. 6-1. Схема патогенеза травматического шока I-II степени.
Перечисленные выше защитно-приспособительные реакции реализуются в течение первого часа после травмы, в патогенетическом отношении представляют собой стадию компенсации, а в
клиническом - травматический шок I и II степени.
При тяжёлых черепно-мозговых ранениях или травмах обязательным компонентом травмы является первичное либо вторичное (вследствие отёка и дислокации головного мозга) повреждение структур межуточного мозга и ствола, где сосредоточены многочисленные центры нейрогуморальной регуляции всех жизненно важных функций человеческого организма. Главным результатом такого повреждения является несостоятельность адаптационной программы защиты организма. В повреждённом гипоталамусе нарушаются процессы образования рилизинг-факторов, нарушаются обратные связи между гипофизом и эффекторными эндокринными железами, прежде всего надпочечниками. Вследствие этого не развиваются централизация кровообращения и тахикардия, а обмен веществ приобретает невыгодный для организма гиперкатаболический характер. Развивается патогенетическая и клиническая картина травматической комы, для которой характерны утрата сознания и рефлекторной деятельности, мышечный гипертонус

вплоть до судорог, артериальная гипертензия и брадикардия, т.е. симптомокомплекс, противоположный проявлениям травматического шока.
Если патогенетические факторы шока продолжают действовать, а медицинская помощь запаздывает либо не эффективна, защитные реакции приобретают противоположное качество и становятся патологическими
, усугубляя патогенез травматического шока. Начинается стадия декомпенсации. В результате длительного генерализованного спазма мелких сосудов развивается микроциркуляторная гипоксия,
обусловливающая генерализованное гипоксическое повреждение клеток - главный фактор патогенеза, зат янувшегося в динамике травматического шока III степени.
Прогрессирующие расстройства транспорта кислорода в клетках сопровождаются выраженным снижением содержания аденозинтрифосфата - основного переносчика энергии, возникновением энергетического дефицита в клетках. Выработка энергии в клетках переходит на путь анаэробного гликолиза, и в организме накапливаются недоокисленные метаболиты (молочная, пировиноградная кислоты и др.). Развивается лактатный метаболический ацидоз. Тканевая гипоксия ведёт к усилению перекисного окисления липидов, которое вызывает повреждение клеточных мембран. В результате деструкции клеточных мембран и энергетического дефицита прекращает работать высокоэнергетический калийнатриевый насос. Натрий проникает в клетку из интерстициального пространства, за натрием в клетку перемещается вода. Клеточный отёк вслед за деструкцией мембран завершает цикл клеточной гибели.
В результате деструкции лизосомальных мембран высвобождаются и поступают в кровоток лизосомальные ферменты, которые активируют образование вазоактивных пептидов (гистамин, брадикинин). Эти биологически активные вещества вместе с кислыми анаэробными метаболитами вызывают стойкий паралич прекапиллярных сфинктеров. Общее периферическое сопротивление критически падает, и артериальная гипотензия становится необратимой. Следует помнить, что при снижении систолического АД ниже 70 мм рт.ст. почки прекращают вырабатывать мочу - развивается острая почечная недостаточность. Нарушения микроциркуляции усугубляет диссеминированное внутрисосудистое свёртывание (ДВС). Первоначально являясь защитной
реакцией по остановке кровотечения, на последующих стадиях патологического процесса ДВС-синдром становится причиной микротромбообразования в лёгких, печени, почках, сердце, сопровождающегося нарушением функции (дисфункцией) этих органов (ДВС I, II степени), либо причиной развития тяжёлых фибринолизных кровотечений (ДВС III степени). Развивается полиорганная дисфункция жизненно важных органов, т.е. одновременное нарушение функции лёгких, сердца, почек, печени и других органов желудочно-кишечного тракта, не достигшее пока ещё критического уровня.
Патологические процессы, происходящие в стадии декомпенсации, характерны для затянувшихся (на часы) случаев травматического шока. Они реализуются на микрососудистом (артериолы, прекапилляры, капилляры) уровне при активном участии цитокиновой
системы, сосудистой эндотелиальной системы и ДВС и обозначаются как синдром системного воспалительного ответа, последовательно переходящий при прогрессировании
процесса в полиорганную дисфункцию, полиорганную недостаточность, висцеральные и генерализованные инфекционные осложнения.
Быстро начатые и правильно проводимые реанимационные мероприятия часто бывают эффективными при травматическом шоке III степени, реже - при терминальном состоянии (в случаях изолированных ранений). Поэтому в широкую практику скорой помощи вошло правило "золотого часа", смысл которого состоит в том, что медицинская помощь при тяжёлых травмах эффективна только в течение первого часа; за это время раненому должна быть оказана догоспитальная реаниматологическая помощь и он должен быть доставлен в стационар.
Последней стадией развития патологических процессов при затянувшемся травматическом шоке III степени является прогрессирование нарушений функции жизненно важных органов и систем. При этом нарушение их функции достигает критических значений, за порогом которых функция органов уже недостаточна для обеспечения жизнедеятельности организма -
развивается полиорганная недостаточность (ПОН) (рис. 6-2).
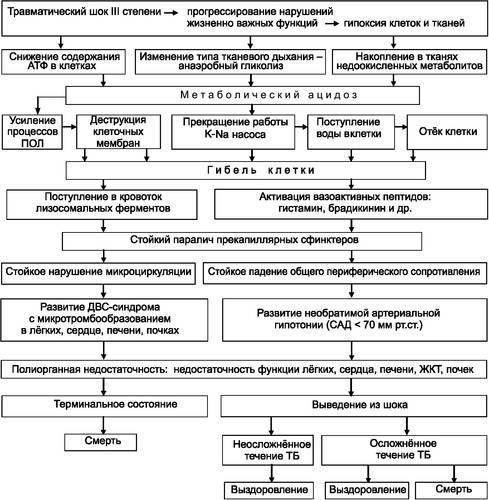
Рис. 6-2. Схема патогенеза травматического шока III степени.
Вподавляющем большинстве случаев исходом её является терминальное состояние и смерть. В отдельных ситуациях при великолепно организованной реаниматологической помощи в специализированных центрах по лечению тяжёлых травм возможна коррекция полиорганной дисфункции жизненно важных органов и даже полиорганной недостаточности с помощью сложных дорогих и высокотехнологичных методов: ИВЛ аппаратами III-IV поколений с многочисленными режимами искусственного дыхания, многократные санационные фибробронхоскопии, большеобъёмная экстракорпоральная оксигенация крови, различные методы экстракорпоральной детоксикации, гемофильтрация, гемодиализ, упреждающее хирургическое лечение, направленная антибактериальная профилактика, коррекция нарушений в иммунной системе и т.п.
При успешной реанимации ПОН в большинстве случаев трансформируется в целый ряд осложнений,
которые имеют свою этиологию и патогенез, т.е. являются уже новыми этиопатогенетическими процессами. Наиболее типичными из них являются жировая эмболия, тромбоэмболия, пневмония, желудочно-кишечные кровотечения, различные виды аэробной и анаэробной инфекции различной локализации. В 40% случаев ближайшим исходом ПОН является сепсис.
В30% случаев при сепсисе, в 60% - при тяжёлом сепсисе и в 90% - при септическом шоке исходом является смерть. Таким образом, героические усилия специалистов (реаниматологов, хирургов, анестезиологов и др.) при использовании дорогих и современных методов лечения могут вернуть к жизни только 30-40% пострадавших, перенёсших полиорганную недостаточность, развившуюся в результате затянувшегося травматического шока III степени.
Возможности излечения раненых и пострадавших с тяжёлыми ранениями и травмами, сопровождавшимися шоком III степени, появились в 60-е гг. ХХ столетия в связи со стремительным
развитием анестезиологии и реаниматологии и с появлением специализированных многопрофильных центров для лечения тяжёлых травм. Наша страна была лидером в этом направлении. В эти же годы сформировался очевидный парадокс: чем быстрее и эффективнее раненым с тяжёлыми травмами оказывается медицинская помощь на догоспитальном этапе и в противошоковых отделениях специализированных центров, тем выше вероятность их ближайшей выживаемости, т.е. по формальным показателям (систолическое АД) они выводятся из состояния шока. Но этот факт не означает выздоровления. После выведения раненых из состояния шока III степени у 70% из них в последующие периоды развиваются тяжёлые осложнения, лечение которых нередко сложнее, чем выведение из шока.
Таким образом, при тяжёлых и крайне тяжёлых травмах или
ранениях выведение раненых из состояния травматического шока, особенно III степени, является только первым этапом лечения. В последующем у этих раненых развиваются новые этиопатогенетические процессы, определяемые как недостаточность органов или осложнения, лечение которых является сложной проблемой и имеет серьёзную специфику. Тем не менее все защитные и патологические процессы, развивающиеся у раненых после тяжёлых травм или ранений, детерминированы травмой и связаны между собой причинно-следственными отношениями. Все они составляют патогенетическую сущность травматической болезни.
ТРАВМАТИЧЕСКАЯ БОЛЕЗНЬ. ОПРЕДЕЛЕНИЕ И ПЕРИОДИЗАЦИЯ
В 70-е гг. ХХ столетия в нашей стране стали формироваться теоретические и клинические предпосылки новой тактики лечения раненых и пострадавших с тяжёлыми ранениями и травмами. В основу их была положена концепция травматической болезни, основоположниками которой являются российские учёные, прежде всего патофизиолог С.А. Селезнёв и военно-полевой хирург И.И. Дерябин.
Травматическая болезнь определяется как лечебнотактическая концепция, т.е. методология лечения тяжёлых ранений и травм от момента травмы до о
кончательного исхода. Как концепция, она объясняет механизмы и последовательность развития защитных и патологических процессов, а на их основе - обеспечивает возможность прогнозирования динамики их развития, своевременной профилактики и лечения.
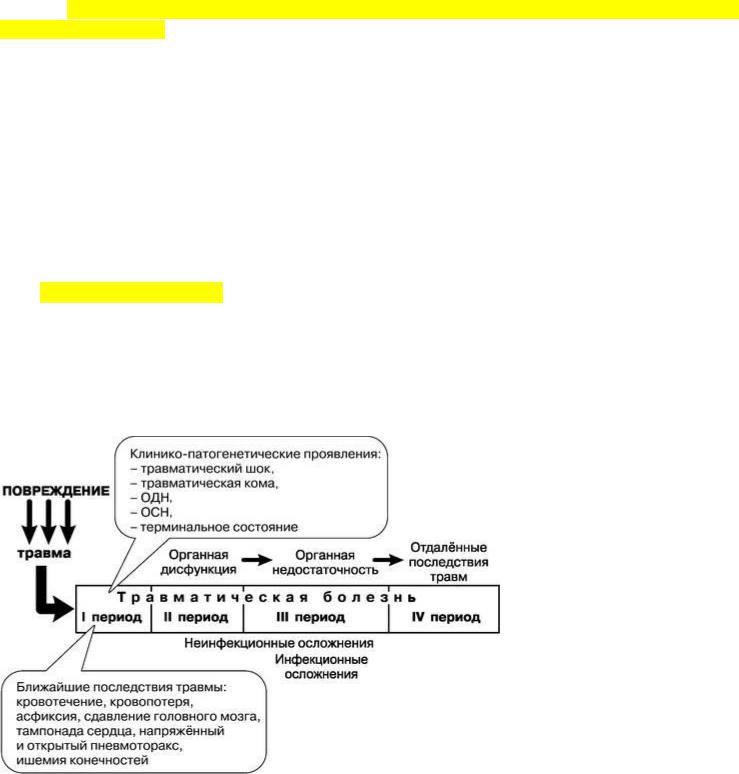
Следовательно, травматический шок как лечебно-
тактическая концепция является методологией спасения жизни раненых в первые часы после тяжёлых ра нений и травм, а травматическая болезнь - методологией их лечения до окончательного исхода (рис. 6-3).
Рис. 6-3. Клинико-патогенетическая характеристика травматической болезни.

В течении травматической болезни выделяются четыре периода.
Первый период, острый - период острого нарушения жизненно важных функций. В 63% случаев нарушение жизненно важных функций проявляется в виде травматического шока или терминального состояния, в 18% - травматической комой при тяжёлых повреждениях головного мозга, в 13% - острой дыхательной недостаточностью при тяжёлых повреждениях груди, в 6% - острой сердечной недостаточностью при повреждении сердца. Он начинается сразу же после травмы и продолжается 6-12 ч в зависимости от тяжести травмы и эффективности лечебных мероприятий. В этом периоде раненые получают догоспитальную помощь и реаниматологическую помощь в противошоковых отделениях специализированных центров либо в отделении реанимации и интенсивной терапии районных (областных) больниц, омедб, МОСН, военных госпиталей. Основной лечебной задачей в этот период является выявление причин нарушения жизненно важных функций, систем, в которых они произошли; активная, в том числе инструментальная, диагностика повреждений; выполнение неотложных и срочных оперативных вмешательств и консервативных реанимационных мероприятий: пункция и катетеризация крупных вен и даже артерий, инфузионно-трансфузионная терапия, ИВЛ, мониторирование жизненно важных функций и т.п. Именно в этом периоде осуществляется выведение раненых из состояния травматического шока. Оптимальным местом лечения раненых в первом периоде травматической болезни являются против
ошоковые операционные, где возможно создать условия для одномоментного проведения инструментальной инвазивной диагностики (плевральная, люмбальная и др. виды пункций, лапароцентез, лапаро- и торакоскопия и т.п.); выполнения неотложных и срочных оперативных вмешательств; инвазивных мероприятий интенсивной терапии (пункции и катетеризации вен и артерий, трахеостомия). В этом периоде умирают до 10% тяжелораненых или пострадавших от жизнеугрожающих последствий травм. Первый период травматической болезни завершается окончательной диагностикой повреждений, устранением причин нарушений жизненно важных функций, возмещением кровопотери и относительной стабилизацией основных показателей систем дыхания и кровообращения.
Второй период - период относительной стабилизации жизненно важных функций. В этот период формальные показатели жизненно важных функций (АД, пульс, напряжение кислорода в крови, показатели крови) приближаются к нормальным значениям или отклоняются незначительно, но компенсация функций неустойчива, возможны срывы. Этот период продолжается от 12 до 48 ч. Значение этого периода очень велико в лечении раненых, так как именно в это время создаются условия для профилактики тяжёлых угрожающих жизни осложнений преи
мущественно хирургическим путём: операции на магистральных сосудах конечностей, длинных костях, костях и органах таза, позвоночнике и спинном мозге. Особенно это важно при сочетанных травмах (политравмах), когда одновременно повреждаются несколько областей тела, а множественные очаги повреждений и множественные переломы являются источниками ферментативной агрессии, кровопотери, избыточной афферентной импульсации и гиподинамии. Оперативные вмешательства выполняются в специально оборудованных операционных, часто одномоментно на нескольких областях тела многопрофильными хирургическими бригадами, наркоз и интенсивная терапия проводятся специально подготовленными анестезиологами с мониторированием жизненно важных функций. Такая активная лечебная тактика получила определение хирургическая реанимация, а оперативные вмешательства относятся к категории отсроченных. Местом лечения раненых во втором периоде травматической болезни являются отделения реанимации и интенсивной терапии (рис. 6-4).
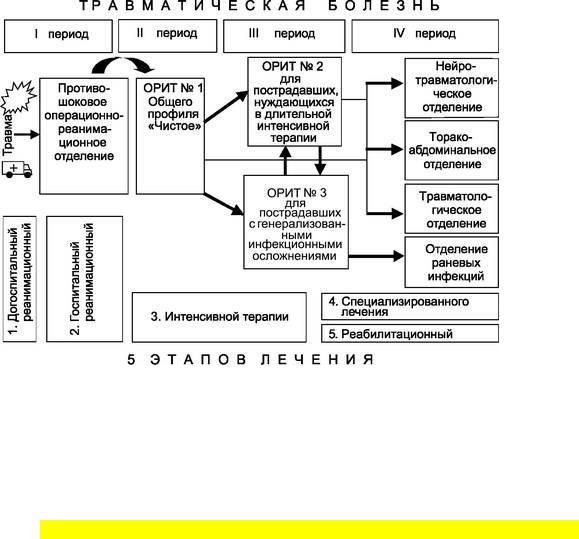
Рис. 6-4. Соотношение периодов травматической болезни, этапов лечения политравм и функциональных отделений травмоцентра 1-го уровня.
В этом периоде умирают до 5% тяжелораненых и пострадавших преимущественно от ранней полиорганной недостаточности1.
1 Ранняя ПОН - это недостаточность функции жизненно важных органов, достигшая критических уровней и обусловленная системным воспалительным ответом, а также другими последствиями травмы. Поздняя ПОН
-это недостаточность функции жизненно важных органов, обусловленная генерализацией инфекционных осложнений (сепсисом).
Третий период - период максимальной вероятности развития осложнений. В этот период создаются оптимальные условия для развития осложнений: вследствие большой кровопотери, эндотоксикоза, ДВС-синдрома во внутренних органах (лёгкие, сердце, селезёнка, печень, кишечник, почки) сформировались множественные очаги микротромбозов. Эти очаги являются мишенью для микроорганизмов, поступивших в кровоток из ран, верхних дыхательных путей и кишечника; клеточных и кровяных макрофагов, фиксирующихся вместе с бактериями на эндотелии сосудистой стенки и нарушающих тем самым уже скомпрометированную микроциркуляцию в органах. Таким образом, после перенесённого травматического шока III степени уже к началу второго периода травматической болезни развивается синдром системного воспалительного ответа на травму, а к началу третьего периода - формируется ранняя полиорганная дисфункция/недостаточность, являющиеся основой для развития висцеральных и генерализованных инфекционных осложнений.
Особенно неблагоприятные условия в отношении развития тяжёлых осложнений создаются в лё
гких.
• Микротромбы и жировые эмболы поражают лёгкие на уровне артериол, прекапилляров, капилляров
-при достижении критического уровня развиваются такие жизнеопасные неинфекционные осложнения,
как тромбоэмболия мелких ветвей лёгочной артерии или жировая эмболия с летальностью до 50%.
• Биологически активные вещества, жир, клеточные ферменты разрушенных клеток, цитокины иммунокомпетентных клеток, токсины различного происхождения, циркулирующие в крови, проходя через лёгочные капиллярно-альвеолярные комплексы, воздействуют на базальную мембрану альвеол и вызывают в ней воспаление - повышается проницаемость стенки капилляров, белок и нейтрофильные лейкоциты проникают в базальную мембрану, и она становится непроницаемой для кислорода - нарушается диффузия газов в альвеолах, снижается напряжение кислорода в артериальной крови - развивается синдром острого
повреждения лёгких, а затем и его крайняя степень - острый респираторный дистресс-синдром с летальностью до 90%.
При затянувшемся травматическом шоке III степени защитная сосудистая реакция в лёгких (спазм лёгочных посткапилляров), направленная на замедление скорости прохождения эритроцитов через лёгочные капилляры для увеличения времени их обогащения кислородом, переходит в свою противоположность и становится патологической. В результате затянувшегося спазма лёгочных посткапилляров повышается давление в системе лёгочной артерии. Гиповолемия, перемещение ионов Na+ в клетки, клеточная гипергидратация, внутрисосудистая дегидратация приводят к снижению осмотического давления в сосудистом секторе - осмотический градиент направляется в сторону альвеол. В результате этих двух процессов в альвеолы пропотевает жидкость из капилляров, происходит снижение активности сурфактанта (поверхностно-активное вещество, препятствующее слипанию стенок альвеолы), снижается воздушность альвеол, затем они слипаются или заполняются жидкостью - формируются микроателектазы. При прогрессировании процесса на фоне развившегося системного воспалительного ответа микроателектазы сливаются в более крупные очаги ателектазирования - формируется очаговая пневмония. Средний срок развития пневмоний у раненых с тяжёлой травмой - 3-6 сут. При крайне тяжёлых травмах, при острой массивной кровопотере патологические процессы в лёгких проходят более стремительно и драматично: альвеолы быстро заполняются жидкостью - формируется синдром "влажного" ("мокрого", "шокового") лёгкого, который при прогрессировании процесса переходит в отёк лёгкого, как правило, завершающийся летальным исходом.
Системные нарушения микроциркуляции и процессы микротромбообразования происходят не только в повреждённых, но и во всех внутренних органах, сегментах и тканях опорнодвигательной системы, скомпрометированных ишемией-
реперфузией - они являются благоприятной средой для развития местных, висцеральных и генерализованны х инфекционных осложнений.
Важным этиологическим фактором возникновения инфекционных осложнений при тяжёлых ранениях и травмах, сопровождающихся развитием травматического шока III степени,
является эндогенная микрофлора. Здесь также проявляется философский закон "единства и борьбы противоположностей", когда защитная, но затянувшаяся реакция централизации кровообращения приводит к глубоким нарушениям кровообращения и метаболизма в кишечной стенке. В результате нарушается естественный барьер кишечной трубки, т.е. стенка кишечных капилляров становится проницаемой для микроорганизмов, вегетирующих в просвете кишки у здорового человека. Таким образом, энтеробактерии, протей, кишечная палочка и другие условно патогенные микроорганизмы поступают в кровь, циркулируют в ней и оседают в очагах микротромбозов, в повреждённых тканях, где взаимодействуют с тканевыми и кровяными макрофагами и другими факторами иммунной защиты. Этот микробиологический феномен называется гематогенной транслокацией, т.е. переселение микроорганизмов через кровь в новую среду обитания с последующим формированием нового (метастатического) патологического микробиоценоза.
• Вторым важным фактором, влияющим на вероятность развития гнойно-инфекционных осложнений, является состояние очага повреждения: раны, области перелома, области отслойки кожи и т.п. Состояние очага повреждения определяется объёмом некротизированных тканей, их функциональной значимостью, степенью нарушения кровоснабжения повреждённого органа либо сегмента, а в конечном итоге - вероятностью прогрессирования или регрессирования вторичного некроза в очаге повреждения. Существенной является и эффективность лечебных мероприятий: полнота удаления некротизированных тканей во время хирургической обработки, восстановление адекватного кровообращения в повреждённом органе (сегменте), создание условий для восстановления микроциркуляции в очаге повреждения и регенерации тканей.
Третьим фактором, влияющим на вероятность развития инфекционных осложнений, является микробная инвазия. При открытых повреждениях инвазия "уличной" микрофлорой происходит
через рану - этот путь микробного загрязнения является наименее опасным, поскольку после удаления очага некроза хирургическим путём 1 г здоровых тканей самостоятельно уничтожает 1 млн микробных тел. Более опасной является инвазия госпитальной микрофлоры, устойчивой даже к современным антибактериальным
