
Методы / Метода к курсачу 2020 года
.pdfМИНОБРНАУКИ РОССИИ
_____________________________________________________________
Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В. И. Ульянова (Ленина)
_____________________________________________________________
РАСЧЕТ ГАЗОТРАНСПОРТНЫХ И ДИФФУЗИОННЫХ ПРОЦЕССОВ В ТЕХНОЛОГИИ
ИЗДЕЛИЙ ЭЛЕКТРОНИКИ И НАНОЭЛЕКТРОНИКИ
Учебно-методическое пособие
Санкт-Петербург Издательство СПбГЭТУ «ЛЭТИ»
2020

УДК 621.389(07) |
|
|
|
ББК З85-0697 |
|
|
|
Р24 |
|
|
|
Авторы: |
С. П. Зубко, |
Н. Ю. Медведева, |
А. А. Никитин, |
А. А. Семенов. |
|
|
|
Р24 Расчет газотранспортных и диффузионных процессов в технологии изделий электроники и наноэлектроники: учеб.-метод. пособие. СПб.: Изд-во СПбГЭТУ «ЛЭТИ», 2020. 32 с.
ISBN 978-5-7629-2656-0
Рассматривает методику термодинамического анализа процесса обработки оксидных катодов и окисляемости металлов, входящих в состав основания катода; термодинамические расчеты газотранспортных процессов осаждения слоев металлов и полупроводниковых материалов; методику расчета диффузионных процессов при двухстадийном легировании полупроводниковых материалов и формировании p-n-переходов.
Предназначено для подготовки бакалавров в рамках дисциплины «Фи- зико-химические основы технологии изделий электроники и наноэлектроники», обучающихся по направлению 11.03.04 «Электроника и наноэлектроника».
Утверждено редакционно-издательским советом университета
в качестве учебно-методического пособия
ISBN 978-5-7629-2656-0 |
СПбГЭТУ «ЛЭТИ», 2020 |
2
1. ТЕРМОДИНАМИЧЕСКАЯ ОЦЕНКА ОКИСЛЯЕМОСТИ МЕТАЛЛОВ ПРИ ТЕРМООБРАБОТКЕ ОКСИДНОГО КАТОДА
1.1.Общие сведения
Внастоящее время оксидные катоды являются одним из распространенных типов термокатода, применяемых в электровакуумных приборах (ЭВП) различных классов.
Впроцессе откачки ЭВП наибольшее газовыделение происходит на этапе термообработки оксидного катода. Оксидное покрытие наносится на поверхность металлического керна катода в виде суспензии карбонатов щелочноземельных металлов Ва, Sr, Са. Основным соединением смеси, приготовленной на основе органического связывающего вещества (биндера), является ВаСО3. В процессе термообработки оксидного катода в вакууме сначала
происходит разложение органической связки, сопровождающееся газовыделением и образованием углерода в покрытии. При увеличении температуры происходит разложение карбоната бария по реакции:
|
|
BaCO 3 тв BaO тв СО 2 газ . |
(1.1) |
|||
Константа |
|
химического равновесия |
имеет следующий вид: |
|||
K р1.1 (T ) = pСО |
2 |
, где pСО |
2 |
– парциальное давление СО 2 ; |
T – температура |
|
|
|
|
|
|
||
протекания реакции. Константа химического равновесия |
K р (T ) является |
|||||
только функцией температуры (T) и нечувствительна к суммарному давле- |
||||||
нию и исходному составу системы; индекс 1.1 |
показывает, что K р1.1 (T ) – |
|||||
константа равновесия для реакции (1.1).
Образующаяся окись бария ВаО, легированная металлическим барием и специальными присадками в керне, служит активным термоэмиссионным покрытием. Углекислый газ СО 2 , выделяющийся в реакции, способствует удалению углерода из оксидного слоя в процессе газотранспортной химической реакции:
CO 2 газ |
С тв 2 СО газ , |
(1.2) |
||||
закон действующих масс для реакции (1.2) имеет вид: |
|
|||||
K |
р1.2 |
(T ) |
pCO2 |
. |
|
|
|
|
|||||
pCO 2
3

Таким образом, при термообработке оксидного катода газовая фаза в основном содержит газы СО 2 и СО. По отношению к металлам (Ме), такая среда обладает окислительно-восстановительными свойствами:
|
m |
Me тв CO 2 газ |
|
|
1 |
Me m O n тв |
CO газ . |
(1.3) |
||||||
|
|
|
||||||||||||
|
n |
|
|
|
|
|
n |
|
|
|
|
|||
Закон действующих масс для реакции (1.3) имеет вид: |
|
|||||||||||||
|
|
K |
р1.3 |
(T ) |
|
pCO |
. |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
pCO |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
2 |
|
|
|
|
|
||
Направление протекания реакции (1.3) обусловлено составом газовой |
||||||||||||||
среды в вакуумном приборе. При этом давления |
pСО |
2 |
и pСО , формируемые |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
реакциями (1.1) и (1.2), являются неравновесными для реакции (1.3), поскольку определяются внешними условиями. В общем случае они отличаются от равновесных давлений, входящих в константу равновесия K р1.3 . В
дальнейшем равновесные давления будем обозначать pCO и pCO 2 , т. е. для реакции (1.3) K р1.3 pCO  pCO 2 .
pCO 2 .
Таким образом, для оценки термодинамической возможности окисления металлических деталей прибора следует в первую очередь выполнить расчет состава газовой среды, формируемой реакциями (1.1) и (1.2), а затем на основании уравнения изотермы Вант-Гоффа для реакции (1.3) определить направление ее протекания в газовой среде, созданной реакциями (1.1) и (1.2).
1.2. Расчет состава газовой фазы
Целью термодинамического расчета является определение температурных зависимостей pСО 2 (Tк ) и pСО (Tк ) , где Tк – температура обработки ка-
тода. Обычно условия разложения карбонатов при термообработке таковы, что скорость газовыделения намного больше скорости откачки. Таким образом, практическая ситуация соответствует изохорному процессу, протекающему в объеме, ограниченном вакуумной оболочкой прибора. В этом случае для реакций (1.1) и (1.2) надо применять закон действующих масс через мольно-объемные концентрации в форме:
с2
K с1.1 (T ) сCO 2 и K с1.2 (T ) с CO .
CO 2
4

Отсюда для температуры Tк находим: |
|
|
|
|
||||||
|
|
сCO 2 K с1.1 (Tк ) ; сCO |
|
|
|
|
||||
|
|
|
Kс1.1(Tк ) Kс1.2 (Tк ) . |
(1.4) |
||||||
Связь K р (T ) |
и K с (T ) определяется из основного газового соотношения |
|||||||||
pi сi RT , где |
pi |
– парциальное давление , |
сi ni / V – мольно-объемная |
|||||||
концентрация, ni |
– |
концентрация i -го компонента, V – объем: |
|
|||||||
|
|
K |
p |
(Т ) K |
с |
(Т )( RТ ) ν(газ) , |
(1.5) |
|||
|
|
|
|
|
|
|
|
|
||
где (газ ) к |
н – изменение числа молей газообразных начальных |
|||||||||||||
(н) компонентов ν н |
и конечных (к) |
|
компонентов ν к после реакции. Тогда, |
|||||||||||
подставляя (1.5) в (1.4), получаем: K |
p |
(Т ) K |
с |
(Т )( RТ ) ν(газ) |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
рСО |
|
(Т к ) K p1.1 (Tк ) ; рСО (Т к ) |
|
|
|
|||||||||
2 |
K p1.1(Т к ) K p1.2 (Т к ) . |
(1.6) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таким образом, расчет состава газовой фазы сводится к определению |
||||||||||||||
температурной зависимости констант равновесия K p1.1 (T ) и K p1.2 (T ) . |
||||||||||||||
|
|
|
1.3. Расчет констант равновесия |
|
||||||||||
Запишем химическую реакцию в обобщенном виде |
|
|||||||||||||
|
|
|
н Ан к Ак , |
(1.7) |
||||||||||
|
|
|
н |
|
|
|
|
|
|
к |
|
|
|
|
где Aн и Aк |
– химические символы начальных (н) и конечных (к) участников |
|||||||||||||
реакции; н |
и к – соответствующие им стехиометрические коэффициенты. |
|||||||||||||
В основе расчета температурной зависимости константы равновесия |
||||||||||||||
K р (T ) для любой реакции лежит соотношение, выражающее K р |
через стан- |
|||||||||||||
дартный изобарный потенциал GT0 : |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
ln K |
p |
|
(T ) |
GT0 |
, |
|
(1.8) |
||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
RT |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
при этом GT0 |
выражается через тепловой эффект реакции H T0 и изменение |
|||||||||||||
энтропии реакции ST0 в стандартных условиях. В приведенных обозначениях нижний индекс соответствует температуре Т , а верхний индекс отмечает так называемое стандартное состояние:
5
GT0 H T0 T ST0 . |
(1.9) |
Таким образом, расчет K p (T ) сводится к вычислению H T0 |
и ST0 для |
конкретной химической реакции. Исходными для расчета служат выражения:
|
|
|
|
H T0 |
H 2980 |
|
T |
|
|
|
|
|
||
|
|
|
|
|
|
c p (T )dT ; |
(1.10) |
|||||||
|
|
|
|
|
|
|
298 |
|
|
|
|
|
||
|
|
|
|
ST0 |
S2980 |
|
T |
|
c |
p |
(T ) |
(1.11) |
||
|
|
|
|
|
|
|
|
|
dT , |
|||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
T |
|
||||||
|
|
|
|
|
|
|
298 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где H 0 |
и |
S 0 |
– стандартные тепловой эффект и изменение энтропии |
|||||||||||
298 |
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
реакции при Т = 298 К и p = 1 атм; c p (T ) |
– изменение изобарной теплоем- |
|||||||||||||
кости в реакции, зависящее от температуры T. |
|
|
|
|||||||||||
Значения |
H 2980 |
, S2980 |
и c p (T ) |
вычисляют на основе таблиц стан- |
||||||||||
дартных термодинамических величин, которые содержатся в справочных изданиях и имеют различный вид. Примеры таблиц стандартных термодинамических данных приведены в приложениях. Для расчета состава газовой фазы, образующейся в процессе термообработки оксидного катода, необходимы термодинамические данные рассматриваемой химической системы, которые приведены в прил. 1.
Для определения H |
0 |
|
и S |
0 |
используют выражения: |
|
|||||
|
|
|
|
298 |
|
298 |
|
|
|
|
|
|
|
H 2980 |
к H 2980 |
к н H 2980 |
н ; |
(1.12) |
|||||
|
|
|
|
|
к |
|
|
н |
|
|
|
|
|
S 2980 |
ν к S 2980 |
к ν н S2980 |
н , |
(1.13) |
|||||
|
|
|
|
|
|
к |
|
|
н |
|
|
где H 2980 |
к, н |
и S2980 |
к, н – стандартные теплоты образования соединений из |
||||||||
простых веществ и стандартные энтропии веществ.
В качестве простых веществ, для которых H 2980 = 0, принимаются ато-
марные и молекулярные формы, которые устойчивы в стандартных условиях
(p = 1 атм, T = 298 К): H 2 , O 2 , Hg, I 2 , С и т. д.
Для вычисления с p (T ) применяют выражение, аналогичное по форме выражениям (1.12) и (1.13):
6
с p (T ) ν к с p к (T ) ν н с p н (T ) . |
(1.14) |
|
к |
н |
|
Температурная зависимость изобарных теплоемкостей с p н (T ) |
началь- |
|
ных и с p к (T ) конечных участников реакции аппроксимируется следующей функцией:
с p (T ) a bT cT 2 , |
(1.15) |
где a, b и c – коэффициенты, заданные для данного вещества в прил. 1. Таким образом, расчет температурной зависимости константы равнове-
сия K p (T ) через GT0 в соответствии с (1.8) выполняется по формулам
(1.9) (1.15). При этом возможны три приближения. Рассмотрим каждое из них подробно.
Первое приближение. В условиях первого приближения пренебрегают температурной зависимостью термодинамических величин, т. е. полагают, что с p 0 . Тогда (1.9) принимает вид:
|
G |
0 |
H 0 |
T S 0 . |
|
|
|
|
|
(1.16) |
||
|
T |
298 |
|
298 |
|
|
|
|
|
|
|
|
Второе приближение. Пренебрегаем температурной зависимостью те- |
||||||||||||
плоемкостей, т. е. полагаем Т = 298 K, с p (T ) с p ( 298) |
const . Тогда из |
|||||||||||
(1.9)–(1.11) следует: |
|
|
|
|
|
|
|
|
|
|
|
|
GT0 |
H 2980 |
T S2980 |
c p (298) Tf (T ) , |
|
|
(1.17) |
||||||
где c p (298) νк c p к (298) ν нc p н (298) , |
|
|
T |
|
298 |
|
|
|||||
Tf (T ) T ln |
|
|
|
|
|
1 |
– |
|||||
|
|
|
|
|||||||||
к |
н |
|
|
|
|
298 |
|
|
T |
|
|
|
функция Улиха относительно температуры Т (прил. 2).
Третье приближение является наиболее полным и учитывает точную температурную зависимость с p (T ) , рассчитанную по формуле (1.14) на ос-
нове табличных данных. В этом приближении используют формулу Темки- на–Шварцмана:
G 0 |
H |
0 |
T S |
0 |
T (M |
0 |
a M b M |
2 |
с) , (1.18) |
T |
|
298 |
|
298 |
|
1 |
|
7

где a, b и c – алгебраические суммы коэффициентов (1.15), найденные с учетом стехиометрических коэффициентов реакции (1.7) по общему правилу, например: a к aк н aн .
кн
Коэффициенты Темкина–Шварцмана, входящие в уравнение (1.18), вычисляются по следующим формулам:
|
|
T |
|
298 |
|
|
T n |
298 n 1 |
298 n |
|||
M 0 |
ln |
|
|
|
1 |
и M n |
|
|
|
|
|
, n 0 |
298 |
T |
|
|
|
||||||||
|
|
|
|
|
n(n 1) |
(n 1)T |
n |
|||||
и приведены в прил. 2.
1.4. Расчет окисляемости металлов
Для выяснения вопроса об окисляемости металлов в газовой среде, сформированной в процессе термообработки оксидного катода, необходимо рассчитать зависимость константы равновесия K окислительно-
восстановительной реакции (1.3) от температуры T. Изобарный потенциал этой реакции G в реальных условиях вычисляется по уравнению изотермы Вант-Гоффа:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
p |
CO |
|
|
|
|
p |
CO |
|
|
|
p |
CO |
2 |
|
|||||||||
|
|
|
|
|
|
|
G RT ln |
|
|
ln K p1.3 (T ) RT ln |
|
|
|
|
|
|
|
|
|
, |
(1.19) |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
p |
CO 2 |
|
|
|
|
|
|
p |
CO 2 |
|
|
|
p |
CO |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
где |
pCO pCO |
2 |
– отношение давлений, полученное из расчета газовой фазы, |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
отличающееся |
от соотношения равновесных |
величин |
для реакции |
(1.3) |
||||||||||||||||||||||||||||||
|
|
|
|
CO |
|
K p1.3 ; T – температура. Из (1.19) следует: |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
p |
CO |
|
p |
2 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а) при |
pCO pCO |
|
|
|
CO |
|
|
CO |
|
имеем G > 0, т. е. реакция (1.3) сдви- |
|||||||||||||||||||||
|
|
|
2 |
p |
p |
2 |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
нута влево и соответствующий металл не окисляется в данной газовой смеси;
б) при pCO pCO |
|
|
|
CO |
|
CO |
|
имеем G < 0, т. е. реакция (1.3) сдви- |
2 |
p |
p |
2 |
|||||
|
|
|
|
|
|
|
нута вправо и металл окисляется.
2. ХИМИЧЕСКОЕ ОСАЖДЕНИЕ ИЗ ГАЗОВОЙ ФАЗЫ
2.1. Общие сведения
Процессы осаждения из газовой фазы полупроводниковых, диэлектрических и проводящих слоев обладают рядом преимуществ по сравнению с методами вакуумного осаждения, которые могут казаться более простыми и
8
технологичными. Применение газовой эпитаксии обеспечивает высокую производительность процесса осаждения и структурное совершенство слоев, достигаемое благодаря равновесному термализованному режиму осаждения компонентов и газовому травлению подложек.
Наибольшее распространение получил метод газотранспортных химических реакций (ГТХР).
В методе ГТХР используется химический транспорт труднолетучих химических компонентов, которые с помощью обратимой гетерогенной реакции в зоне источника переводятся из твердой фазы в газовую, а затем в зоне синтеза происходит обратный перевод продукта реакции из газовой фазы в твердую. При этом синтез требуемой твердой фазы осуществляется на поверхности подложки, что приводит к эпитаксиальному наращиванию монокристаллических слоев полупроводников с высокой степенью морфологического, структурного и электрофизического совершенства. С этой целью в газовый поток, создаваемый за счет газа-носителя (водорода H 2 или инертного газа), вводится так называемый транспортный агент. Его основная функция – травление твердого полупроводникового материала с образованием газообразных продуктов реакции, переносимых общим потоком из зоны травления
взону осаждения.
Взоне источника реакция смещена вправо, в сторону газообразных продуктов. Поскольку реакция является эндотермической, кристаллизация вещества на подложке происходит при пониженной относительно источника температуре.
Примером применения ГТХР в открытой проточной камере является метод эпитаксии арсенида галлия в системе GaAs–H2O–H2.
2.2. Газотранспортные химические реакции в системе GaAs–H2O–H2
Для арсенида галлия GaAs роль транспортного агента могут выполнять пары воды H 2 O . Основной газотранспортной реакцией при этом является следующая реакция с образованием летучего окисла Ga 2O :
2GaAs тв H 2 O газ H 2 газ Ga 2 O газ |
As 2 газ . |
(2.1) |
|||||||
Закон действующих масс для этой реакции имеет вид: |
|
||||||||
K p 2.1 (T ) |
pH |
2 |
pGa |
2 |
O pAs |
2 |
, |
|
|
|
|
pH |
2 |
O |
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
9
где pH 2 , pGa 2O , pAs2 и pH 2O – парциальные давления соответствующих
участников реакции (2.1).
Обычно процесс проводится в открытой проточной системе, при атмосферном суммарном давлении.
Термодинамические данные химической системы GaAs– H 2 O – H 2 представлены в прил. 3. В этой же таблице представлены термодинамические данные для других химических систем, которые необходимы для выполнения заданий, связанных с термодинамическим анализом газотранспортных хими-
|
|
|
|
|
|
|
|
|
ческих реакций. |
|
|
H2 + H2O |
|
|
|
|
H2 |
+ H2O |
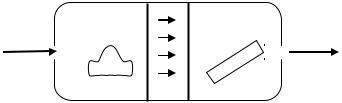
Схематическое |
изо- |
|||
|
|
|
|
||||||||
|
|
|
|
бражение |
процесса |
газо- |
|||||
|
|
|
|
|
|
|
|
|
|||
|
|
|
GaAs |
|
|
|
|
|
фазного осаждения (ГФО) |
||
|
|
|
|
|
|
|
|
||||
|
|
|
Подложка |
|
|
||||||
|
|
|
|
|
|||||||
|
|
|
|
|
приведено |
на рис. |
2.1. В |
||||
|
|
|
|
|
|
|
|
|
|||
|
|
(T 800 °C) (T = 550…750 °C) |
|
|
рассматриваемом процессе |
||||||
|
|
|
|
Рис. 2.1 |
|
|
происходят взаимодействие |
||||
|
|
|
|
|
|
|
|
|
GaAs |
с |
газом- |
транспортным агентом, образование летучих соединений, их перенос в зону осаждения и формирование эпитаксиальной пленки. На вход системы пода-
ется газ-носитель водород под давлением рH0 2 , содержащий пары воды.
Появление паров воды в газе-носителе (водороде) обеспечивается протеканием газа через барботер с водой, который находится в термостате. Пар-
циальное давление паров воды рH0 2O определяется точкой росы – давлением
насыщенного пара. Относительную влажность вводимого в систему водорода можно выразить следующим параметром:
|
|
|
|
|
|
p |
0 |
|
n |
0 |
|
|
|
|
|
|
|
x |
|
H 2O |
|
|
H 2O |
, |
(2.2) |
|
|
|
|
|
p0 |
n0 |
||||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
H 2 |
|
|
H 2 |
|
|
где |
n |
0 и |
n |
0 |
число молей водорода и паров воды, подаваемых на вход |
|||||||
|
|
H 2 |
|
H 2O |
|
|
|
|
|
|
|
|
реактора, которые определяются исходными парциальными давлениями.
В изучаемой системе наряду с основной газотранспортной реакцией (2.1) возможно протекание конкурирующих реакций, препятствующих транспорту арсенида галлия в газовой фазе с помощью паров воды. Это происходит вследствие «связывания» галлия в форме новой конденсированной
10
